SDCBP-AS1通过调控hnRNP K的泛素化和SUMO化来破坏β-catenin的稳定,从而抑制胃癌的发生和转移
胃癌(GC)是全球癌症相关死亡的主要原因,尽管其发病率因不同地理区域而异。尽管标准化治疗在过去十年中提高了患者的生存率,但5年生存率仍然很低。早期发现可以在很大程度上提高5年生存率;然而,由于缺乏有效的诊断和治疗策略,中国超过80%的GC患者在诊断时患有晚期疾病,5年生存率低于20%。因此,迫切需要新的生物标志物和治疗靶点用于GC的诊断和预后预测,以降低死亡率。该研究发表于《Cancer Communications》,IF: 15.283。
技术路线:
主要研究结果:
1. GC组织中SDCBP2-AS1的下调表明结局不佳
作者研究了SDCBP2-AS1表达与临床样本不同临床病理特征之间的潜在关联。结果表明,与匹配的相邻非肿瘤组织相比,GC组织中SDCBP2-AS1表达显著降低(图1A-B)。根据从截止查找器获得的SDCBP2-AS1的临界值(0.0058),将患者分为SDCBP2-AS1高表达组(n=59)和低表达组(n=73)。值得注意的是,SDCBP2-AS1的低表达与GC患者中腺癌(P=0.033)、肿瘤较大(P =0.016)、淋巴结转移(P <0.001)、远处转移(P =0.036)和晚期病理性TNM(p<0.001)分期(P 0.001)有关。Kaplan-Meier生存分析显示,低SDCBP2-AS1组的DFS和OS率低于高SDCBP2-AS1组(图1C)。单因素和多因素分析表明,SDCBP2-AS1表达是GC的独立预后因素。为了验证这些发现,使用Kaplan-Meier绘图仪使用数据集探索SDCBP2-AS1过表达与生存之间的潜在关联GSE22377。结果表明,SDCBP2-AS1的低表达与较短的OS和DFS有关(图1D)。这些发现证实,SDCBP2-AS1的低表达可预测GC患者的预后不良。
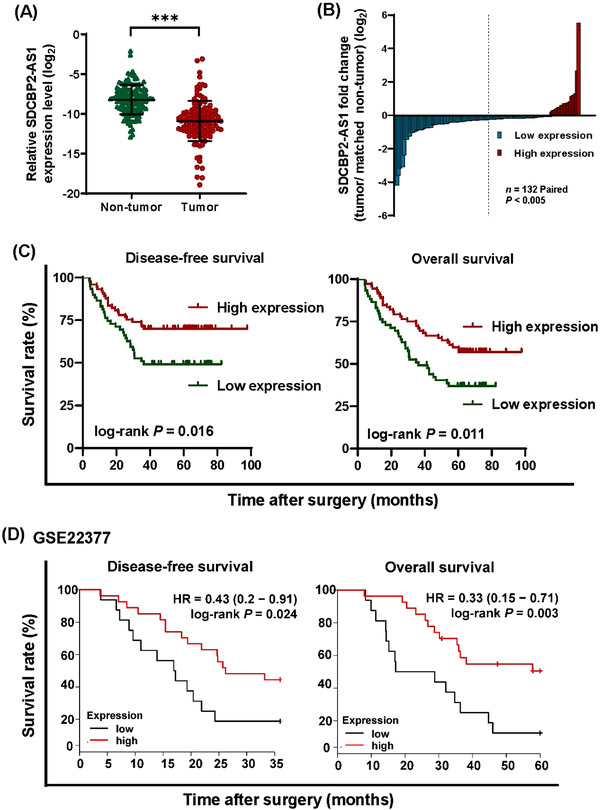
图1 SDCBP2-AS1在GC组织中下调,表明患者预后不良
2. SDCBP2-AS1在体外抑制GC细胞的增殖和转移
使用两种shRNA在BGC823和MKN28细胞中敲低SDCBP2-AS1。SDCBP2-AS1在SGC7901细胞中过表达。RT-qPCR分析用于确定转染的有效性。细胞增殖和集落形成测定表明,敲低SDCBP2-AS1显著促进了两种细胞系的增殖和集落形成(图2A-B),而SCBP2-AS1的过表达具有相反的效果(图2C-D)。进一步探讨了SDCBP2-AS1对GC细胞转移的影响。Transwell和伤口愈合测定的结果表明,SDCBP2-AS1的沉默增加了BGC823和MKN28细胞的迁移和侵袭(图2E-F),而SDCBP2-AS1的过表达增强了SGC7901细胞的迁移率(图2G-H)。这些体外数据表明,敲低SDCBP2-AS1积极促进GC细胞的增殖,迁移和侵袭。

图2 SDCBP2-AS1在体外抑制GC细胞增殖和转移
3. SDCBP2-AS1 抑制体内 GC 细胞的生长和转移
使用体内异种移植肿瘤和裸鼠肺转移模型测定SDCBP2-AS1对GC细胞致瘤和转移能力的影响。通过皮下注射稳定转染shSDCBP2-AS1#1(sh1)或NT对照的BGC823细胞建立异种移植肿瘤模型。由此产生的肿瘤明显更大,并且在sh1组中表现出比NT组更快的生长(图3A-C)。通过对Ki-67的H&E和IHC分析染色进一步证实了这种差异,结果表明,与NT组相比,sh1组在肿瘤组织中的Ki-67表达显着增加(图3D)。此外,肺转移模型显示,NT组的转移性病变比sh1组少(图3E-F)。通过对Ki-67的H&E和IHC分析对肺组织切片进行染色,进一步证实了这种差异(图3G)。综上所述,这些体内结果支持SDCBP2-AS1在GC中的肿瘤抑制作用。
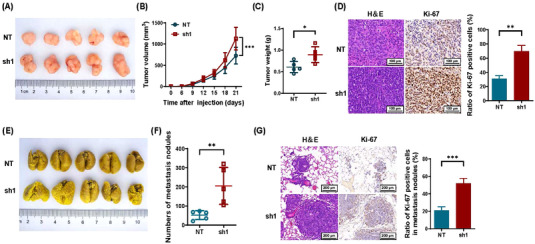
图3 SDCBP2-AS1抑制体内GC细胞的生长和转移
3.4. SDCBP2-AS1 与细胞质中的 hnRNP K 相互作用
为了确定潜在的机制,使用RNA-FISH和RNA亚细胞分离研究了SDCBP2-AS1在GC细胞中的分布。结果表明,SDCBP2-AS1在细胞质中更为普遍(图4A-B)。此外,使用生物素化SDCBP2-AS1进行RNA下拉测定法来鉴定SDCBP2-AS1的蛋白质伴侣。通过电泳分离回收的蛋白质并进行银染。最后,选择几个差分带进行质谱分析,证实hnRNP K与SDCBP2-AS1相互作用,但与反义SDCBP2-AS1不相互作用(图4C-D)。接下来,体内RIP分析显示hnRNP K与BGC823细胞中的SDCBP2-AS1相互作用(图4E)。总的来说,这些发现证明了SDCBP2-AS1和hnRNP K之间的相互作用。为了确定SDCBP2-AS1的哪些区域与hnRNP K结合,根据SDCBP2-AS1的预测二级结构构建了一系列SDCBP2-AS1缺失突变体(图4F)。RNA片段在体外从RNA下拉测定的缺失构建体转录(图4G)。不同 SDCBP2-AS1 RNA 片段拉下的蛋白质样品中 hnRNP K 的免疫印迹分析表明,核苷酸 541-2479 缺失的 RNA 片段完全失去了与 hnRNP K 结合的能力(图4H)。外显子2的序列可以与hnRNP K相互作用,其RNA二级结构与SDCBP2-AS1的全长序列完全不同。因此,外显子3序列被确定为SDCBP2-AS1和hnRNP K之间相互作用所必需的(图4H)。此外,hnRNP K具有几个参与RNA-蛋白质相互作用的功能结构域,据报道涉及三个K同源(KH)结构域(KH1,KH2和KH3)。然而,位于 KH2 和 KH3 结构域之间的 KI 结构域介导 hnRNP K 活性,尽管潜在机制尚不清楚。BGC823细胞中一系列标记的hnRNP K缺失突变体的RIP测定(图4I-J)表明KH3与SDCBP2-AS1结合的能力最大,而其他结构域与SDCBP2-AS1相互作用的能力没有显着差异(图4K)。这些结果确定了SDCBP2-AS1的特定区域,这些区域能够与GC细胞中的hnRNP K蛋白结构域结合。
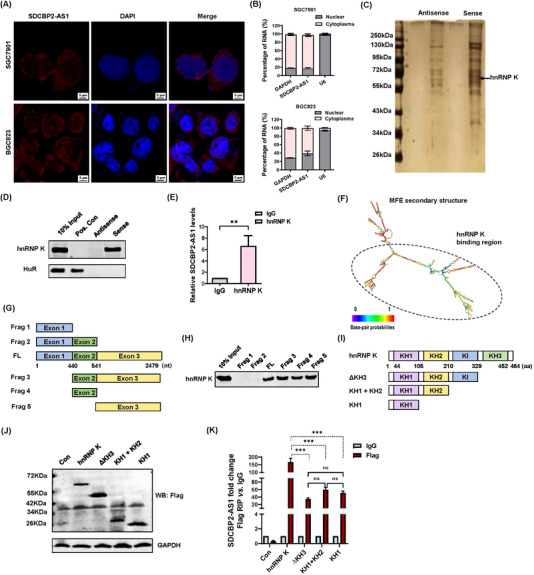
图4 SDCBP2-AS1与细胞质中的hnRNP K相互作用
5. 沉默 SDCBP2-AS1 稳定的β连环蛋白和禁止的转录活性
为了鉴定SDCBP2-AS1的推定靶标,进行了RNA测序以获得敲低SDCBP2-AS1后BGC823细胞的转录谱。在301个差异表达基因中,SDCBP2-AS1敲低组有51个上调,250个下调(图5A)。此外,RNA-seq数据的GSEA表明,SDCBP2-AS1的敲低与β-连环蛋白的过表达呈正相关(图5B)。lncRNA的亚细胞定位与功能。SDCBP2-AS1主要位于细胞质中,与β连环蛋白表达相关,提示SDCBP2-AS1干扰β连环蛋白的降解。为了确认,蛋白质免疫印迹分析显示,敲低SDCBP2-AS1显著提高了BGC823和MKN28细胞中β连环蛋白和hnRNP K的蛋白水平,而过表达SDCBP2-AS1的SGC7901细胞的β-连环蛋白和hnRNP K的表达水平较低(图5C)。此外,蛋白质印迹分析显示,敲低SDCBP2-AS1导致细胞质中β连环蛋白的表达降低,细胞核中表达较高(图5D)。hnRNP K的结果相反。IF测定的结果表明,SDCBP2-AS1改变了GC细胞中细胞核和细胞质之间β连环蛋白的穿梭(图5E)。TOP/FOP闪光素酶测定的结果显示,SDCBP2-AS1敲低细胞中激活了β连环蛋白信号传导(图5F)。此外,RT-qPCR和蛋白质印迹分析结果表明,SDCBP2-AS1的稳定过表达或敲低改变了β连环蛋白下游基因(即CCND1、MYC和MMP7)的表达模式。β连环蛋白的易位激活了Wnt信号通路,特别是通过Wnt3a,而不是Wnt5a(图5G-H)。综上所述,这些结果表明,敲低SDCBP2-AS1有助于稳定β连环蛋白并激活规范的Wnt信号通路。
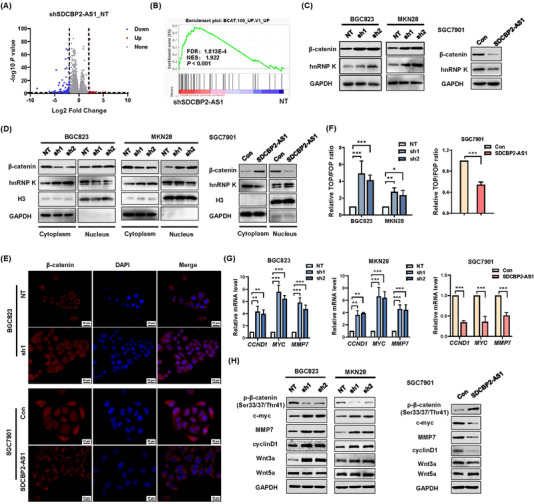
图5 SDCBP2-AS1的沉默稳定β连环蛋白和禁止的转录活性
6. SDCBP2-AS1 通过阻断 GC 细胞中 hnRNP K 的 SUMO化来破坏β连环蛋白的稳定性
由于发现SDCBP2-AS1在不同方向上调节β-连环蛋白和hnRNP K的蛋白质水平,SDCBP2-AS1也可能调节转录后修饰。因此,蛋白质合成抑制剂CHX用于评估SDCBP2-AS1对β连环蛋白稳定性的影响。用CHX处理后,所有组中β连环蛋白的蛋白质合成均显着下降,这意味着SDCBP2-AS1的敲低或SDCBP2-AS1的过表达不影响β连环蛋白的蛋白质合成(图6A)。此外,与蛋白酶体抑制剂MG132孵育后,SDCBP2-AS1的敲低和过表达对GC细胞中β连环蛋白的降解具有相似的作用(图6B)。SDCBP2-AS1调节β连环蛋白的降解,但不能调节合成。进行IP分析以确定SDCBP2-AS1是否参与形成靶向内源性β连环蛋白的降解复合物。由于APC、Axin1和GSK3β是诱导β连环蛋白降解的主要成分,因此在没有SDCBP2-AS1的情况下,β连环蛋白与破坏复合物之间的相互作用降低(图6C),表明SDCBP2-AS1可能干扰β连环蛋白的降解。SDCBP2-AS1的过表达一致地促进了β连环蛋白的泛素化和降解(图6C)通过与 hnRNP K 结合。在没有SDCBP2-AS1的情况下,β连环蛋白的泛素化是不完全的(图6D)。作者构建了一系列Flag标记截短的hnRNP K蛋白,蛋白质结构域图谱研究表明,hnRNP K的KH3和KI结构域对于其与β连环蛋白的相互作用至关重要(图6E)。同时,HA标记的β连环蛋白截断突变体的免疫沉淀表明,β连环蛋白的所有结构域都参与其与hnRNP K的相互作用,尽管全长具有最大的结合能力(图6F)。此外,SDCBP2-AS1主要与hnRNP K的KH3结构域相互作用。在KH3区域已经报道了几个翻译后修饰位点,例如位于422位的赖氨酸残基,它被确定为hnRNP K的主要SUMO化位点。因此,研究了SDCBP2-AS1调控hnRNP K翻译后修饰的能力,特别是KH3结构域的SUMO化和泛素化。SDCBP2-AS1的敲低增加了野生型的SUMO化,但K422R突变体没有增加(图6G),以及 hnRNP K 的内源性多泛素化减少(图6H)。与K422R突变体相比,SDCBP2-AS1通过阻断空间结构中KH3结构域的特定活性位点来改变SUMO化。这些结果表明,敲低SDCBP2-AS1导致β连环蛋白在细胞质中的积累,随后通过稳定GC细胞中的β连环蛋白进行核易位。
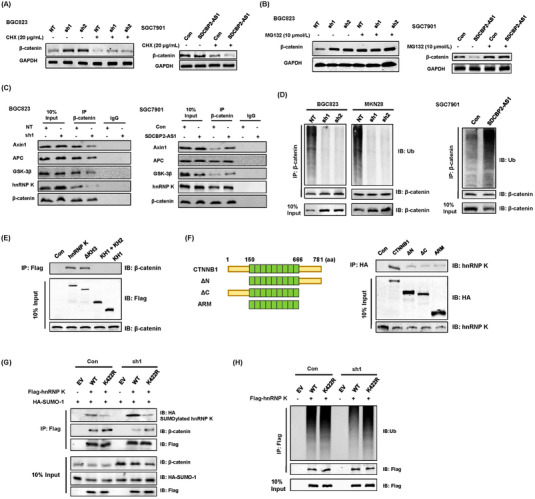
图6 SDCBP2-AS1通过阻断HNRNP K的SUMO化来破坏β连环蛋白的稳定性
7. SDCBP2-AS1 的肿瘤抑制功能通过与 hnRNP K 的相互作用部分发挥
建立具有稳定敲低hnRNP K的SGC7901细胞,以评估GC细胞中SDCBP2-AS1和hnRNP K之间的相互作用。此外,SDCBP2-AS1被过度表达以确定hnRNP K是否是关键介质。沉默hnRNP K消除了SDCBP2-AS1的肿瘤抑制功能,包括细胞增殖和迁移(图7A-C)。IF和蛋白质印迹测定的结果表明,如果没有hnRNP K,SDCBP2-AS1无法促进GC细胞中β连环蛋白的核易位(图7D-E)。此外,TOP/FOP-闪光素酶、qPCR 和蛋白质印迹测定的结果表明,如果没有 hnRNP K,SDCBP2-AS1 无法激活下游靶基因和 Wnt/β-连环蛋白通路的转录(图7F-H)。在异种移植肿瘤模型中,SGC7901细胞中hnRNP K的稳定敲低消除了SDCBP2-AS1过表达引起的生长速率和肿瘤重量的差异(图7I-K)。
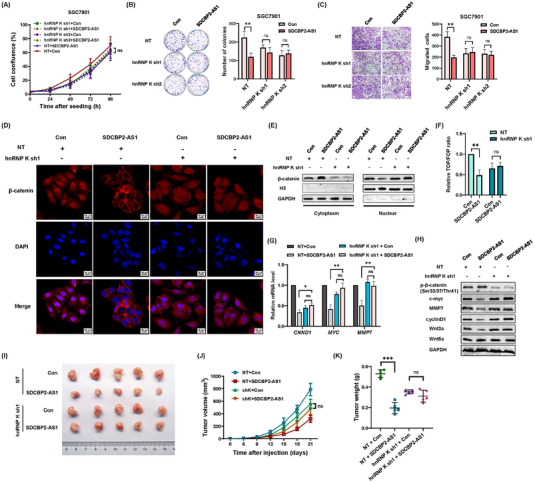
图7 SDCBP2-AS1通过与hnRNP K的相互作用部分发挥肿瘤抑制功能
结论:
该研究报道了SDCBP2-AS1作为一种新型肿瘤抑制因子lncRNA,可抑制GC细胞的增殖和转移。SDCBP2-AS1的肿瘤抑制功能通过直接与hnRNP K结合调节hnRNP K和β-连环蛋白的转录后修饰,从而促进β连环蛋白的降解。一致地,通过丢失 SDCBP2-AS1 稳定β连环蛋白导致 GC 患者预后不良,表明 SDCBP2-AS1 可能是 GC 患者的潜在诊断和预后生物标志物。
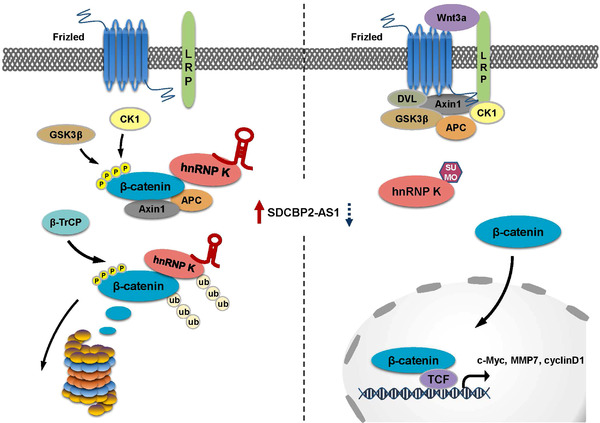
示意图:
说明SDCBP2-AS1诱导抑制GC肿瘤发生的机制:
参考文献:
Han J, Nie M, Chen C, Cheng X, Guo T, Huangfu L, Li X, Du H, Xing X, Ji J. SDCBP-AS1 destabilizes β-catenin by regulating ubiquitination and SUMOylation of hnRNP K to suppress gastric tumorigenicity and metastasis. Cancer Commun (Lond). 2022;42(11):1141-1161. doi: 10.1002/cac2.12367.






