NLRP6促进小细胞肺癌的转移
转移仍然是小细胞肺癌(SCLC)相关死亡的主要原因。越来越多的证据表明,肿瘤转移与以抗炎反应、免疫抑制和肿瘤来源的外泌体存在为特征的转移前微环境有关。为了阐明这些因素在SCLC中的关系,我们分析了SCLC患者样本和小鼠模型。我们发现,M2 TAM标记CD206+的高表达与SCLC患者较差的预后和转移状态相关。此外,在SCLC小鼠模型的转移灶中发现浸润性巨噬细胞(MØ)。我们观察到M2极化,并伴有NLRP6表达的增加。我们的研究结果首次表明SCLC来源的外泌体通过NLRP6/NF-κB通路诱导M2开关,从而促进SCLC在体外和体内的转移。总的来说,这些结果表明了一种新的机制,SCLC来源的外泌体通过激活NLRP6诱导远处MØ的免疫抑制,进而促进全身转移。在这里,我们强调了肿瘤来源的外泌体、炎症小体和免疫微环境在SCLC转移中的密切关系。本文于2022年10月发表于“Cell Death and Disease”(IF= 9.685)上。
技术路线

结果
1)M2 TAMs与SCLC患者转移和不良预后相关
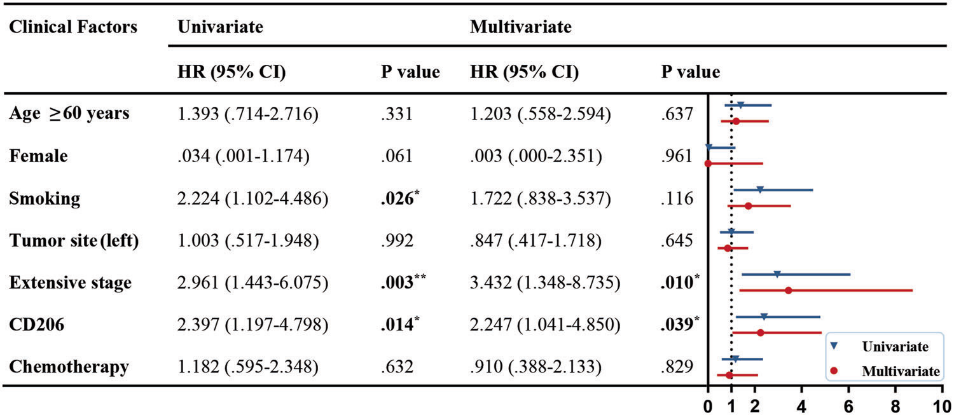
我们在患者的肿瘤组织切片中分析TAM标记物CD68和M2标记物CD206的表达。我们发现CD68+和CD206+ MØ主要位于肿瘤间质。CD68表达水平无明显差异。然而,CD206在远处转移患者中的表达明显高于没有远处转移的患者(图A)。在此之后,我们统计了CD206+ TAM的数量。根据中位数,将患者分为CD206+ TAM低表达和高表达两组。肿瘤间质中,高水平的CD206与转移和NLRP6高表达相关(图1B,C)。CD206的高表达也与OS降低相关(图1D)。数据的单因素和多因素Cox比例风险分析表明CD206是预后不良的独立危险因素(图2)。综上所述,这些结果表明M2 TAMs是SCLC转移和预后的危险因素。

2)在SCLC裸鼠模型中,NLRP6在转移灶中表达升高
炎症微环境是恶性肿瘤免疫调节的关键因素。我们分析了GSE116977。基因集富集分析(GSEA)显示,与转移部位相比,原发部位的炎症反应通路显著富集(图3A),表明转移部位的免疫抑制。此外,包括NLRP6在内的几种炎症小体在原发肿瘤和肝转移肿瘤中表达水平不同。M2 MØ标记CD163和IL10在转移部位上调,而M1标记、NOS2和IL6下调(图3B)。我们还分析了从RT SCLC尾静脉注射的同种异体移植模型中分离出来的肺肿瘤(图3C)。结果表明,与未注射SCLC细胞的小鼠相比,注射SCLC细胞的小鼠MØ和M2 MØ的比例都更高(图3D)。为了估计炎症小体蛋白水平的变化,我们对AIM2、NLRP1、NLRP3、NLRP6和NLRP9进行了qRT-PCR和western blotting分析。令人惊讶的是,与癌旁组织相比,NLRP6在癌组织中的表达显著上调(图3E,F)。这些结果表明NLRP6可能与SCLC的MØ极化和转移密切相关。

3)SCLC细胞通过外泌体分泌调节BMDMs的M2极化
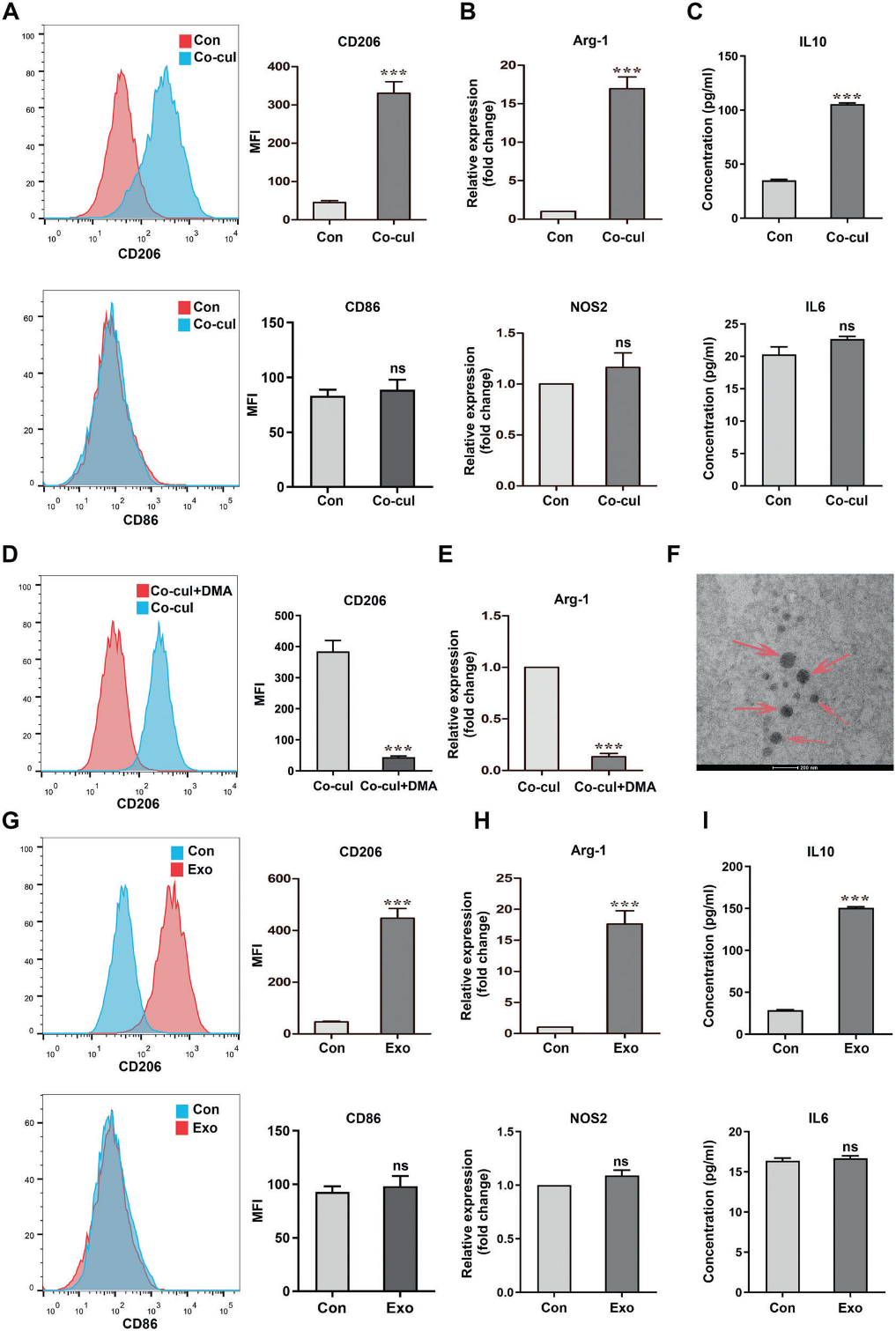
为了确定MØ极化是否由SCLC细胞诱导,我们联合培养了BMDMs和小鼠RT SCLC细胞。与SCLC细胞共孵育48小时后,收集BMDMs进行分析。流式细胞仪和qRT-PCR分析显示M2标记物Arg-1和CD206的表达显著升高。相比之下,M1标记物CD86和NOS2的表达没有明显变化。此外,他们表达了较高水平的M2标记物IL10(图4A-C)。然后我们研究了SCLC细胞在不直接接触的情况下影响BMDM的机制。我们发现在DMA治疗后的BMDMs中,MØ表型转换为M2(图4D,E)。为了确定肿瘤来源的外泌体与观察到的表型转换有关,将从SCLC细胞培养基中分离出的外泌体(图4F)添加到BMDMs中,共培养48 h。对上述标志物进行流式细胞术、qRT-PCR和ELISA实验的结果显示,来自SCLC的外泌体足以将BMDMs转换为M2表型(图4G-I)。因此,这些数据表明SCLC来源的外泌体将MØ群体极化为Arg1+CD206+ M2。
4)SCLC来源的外泌体对TAM极化的调控依赖于NLRP6/NF-κB通路
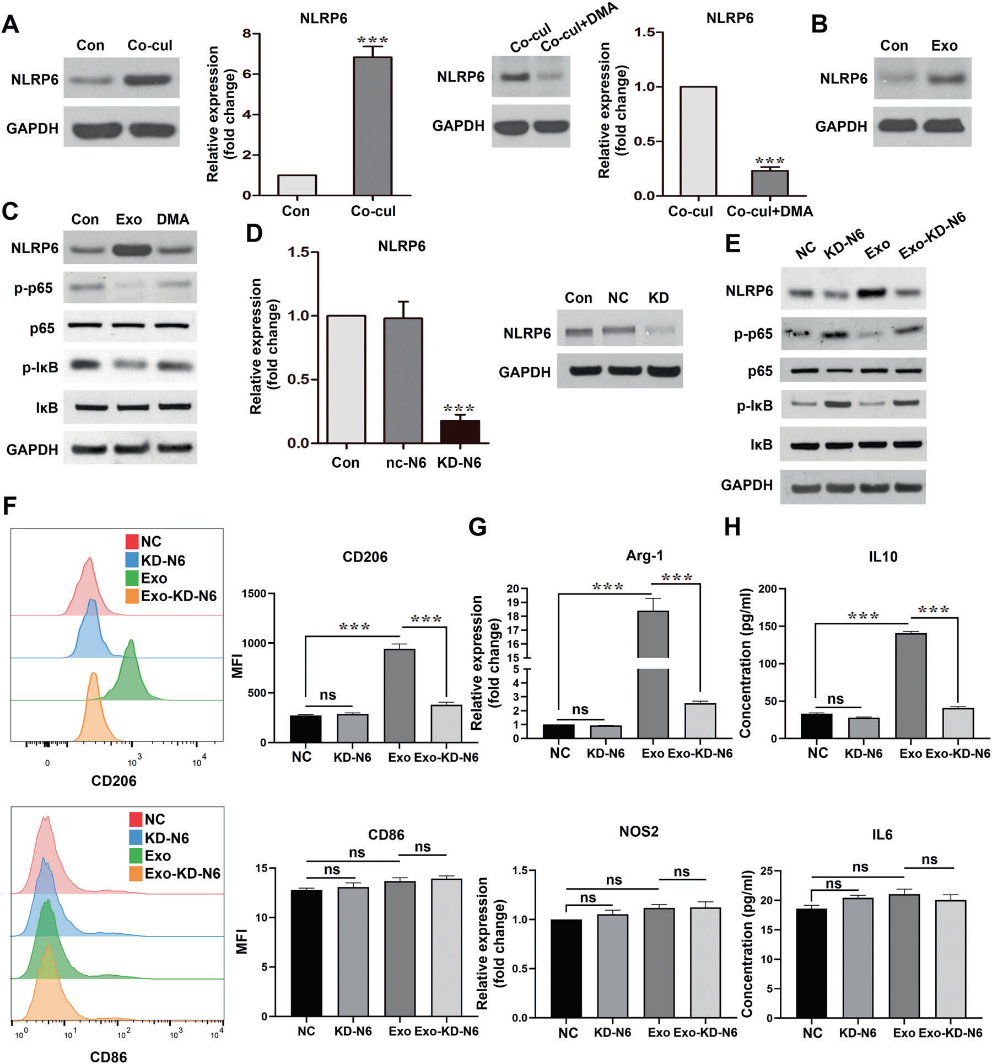
NLRP6先前已被证明可以抑制细胞的炎症反应。考虑到上述发现,我们假设SCLC来源的外泌体通过NLRP6途径促进TAM极化。通过qRT-PCR和western blotting检测NLRP6在BMDMs共培养后的表达变化。在与RT SCLC细胞或外泌体直接共培养后,NLRP6在BMDMs中的表达显著升高。同时,DMA培养可逆转这种表型(图5A, B)。由于NLRP6负向调控NF-κB信号通路,我们检测了共培养BMDMs中p65和IκB的水平。在总p65和IκB水平保持不变的情况下,磷酸化p65和磷酸化IκB水平显著下降,表明NLRP6可能负向调控了NF-κB的激活。外泌体提取前的DMA处理逆转了对磷酸化IκB和磷酸化p65的作用(图5C)。因此,在SCLC肿瘤来源的外泌体诱导的MØ极化中,NF-κB是NLRP6的关键下游因子。为了进一步研究肿瘤来源的外泌体、NLRP6表达和MØ表型开关之间的相关性,我们通过siRNA沉默降低了BMDMs中的NLRP6表达。通过western blotting和qRT-PCR分析转染效率(图5D)。与上述结果一致,敲低NLRP6可以促进IκB和p65的磷酸化(图5E)。此外,在SCLC来源的外泌体处理后,敲除组的BMDMs未能切换到M2表型(图5F-H)。敲低组和阴性对照组M1标记物的水平也相当(图5F-H)。总之,这些结果支持SCLC来源的外泌体通过NLRP6/NF-κB通路促进MØ中的M2开关的观点。
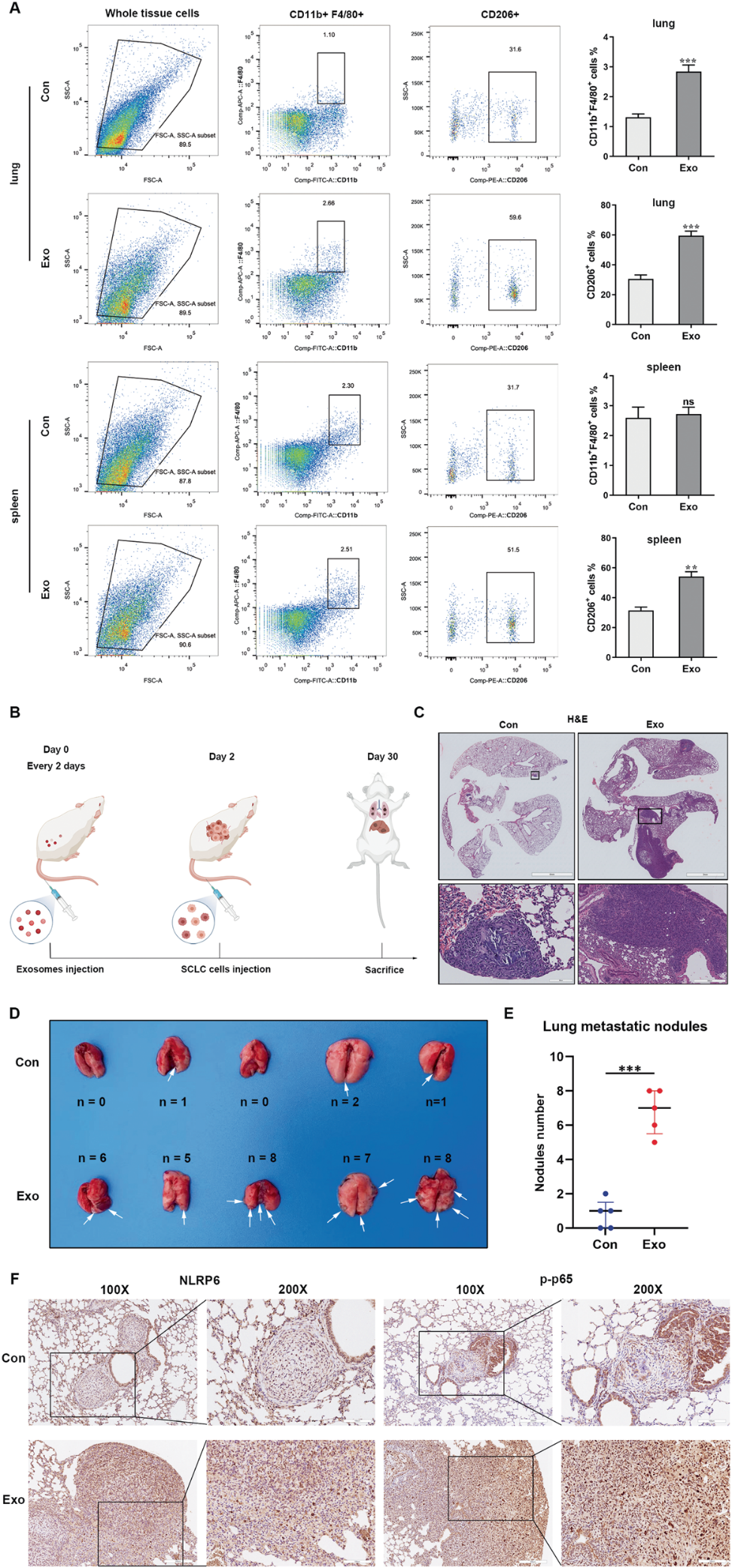
为了进一步验证SCLC来源的外泌体对M2 MØ极化的影响,在裸鼠体内注射外泌体1周后进行流式细胞术分析。与注射PBS的对照组相比,外泌体处理的小鼠肺和脾脏中CD206+ MØ的比例明显更高(图6A)。为了确定SCLC来源的外泌体是否促进体内转移,将小鼠RT SCLC细胞分离的外泌体静脉注射到SCLC尾静脉注射的异体移植物模型中(图6B)。4周后,统计肺部肿瘤的数量。外泌体治疗组的肺SCLC肿瘤数量明显高于对照组。免疫组化结果显示,与对照组相比,外泌体处理组NLRP6和p65磷酸化水平升高(图6C-F)。
结论:
我们的研究揭示了SCLC来源的外泌体与MØ表型切换的关系,其涉及NLRP6/ NF-κB通路的激活,从而促进SCLC的体内转移。本研究对炎症因子的研究为预防SCLC转移提供了新的方向。
参考文献:
Rao X, Zhou X, Wang G, Jie X, Xing B, Xu Y, Chen Y, Li J, Zhu K, Wu Z, Wu G, Wu C, Zhou R. NLRP6 is required for cancer-derived exosome-modified macrophage M2 polarization and promotes metastasis in small cell lung cancer. Cell Death Dis. 2022 Oct 21;13(10):891. doi: 10.1038/s41419-022-05336-0.






