外泌体circLPAR1通过与METTL3-eIF3h相互作用调节BRD4水平抑制结直肠癌肿瘤发生
外泌体是癌症的重要生物标志物,含有丰富的环状RNAs (circRNAs)。然而,外泌体circRNAs在结直肠癌(CRC)中的作用分子机制尚不清楚。circLPAR1被包裹在外泌体中,具有较高的稳定性,在CRC发生过程中,circLPAR1在血浆外泌体中的表达明显降低,但术后恢复。外泌体circLPAR1与生物标志物CEA和CA19-9联合分析,在CRC诊断中具有癌症特异性。此外,circLPAR1在CRC组织中下调,并与总生存率相关。机制上,外泌体circLPAR1被CRC细胞内化,并抑制肿瘤生长,可能是因为外泌体circLPAR1直接与eIF3h结合,特异性地抑制了METTL3-eIF3h相互作用,减少了癌基因BRD4的翻译。这项综合研究强调了血浆外泌体circLPAR1作为CRC诊断的一个有前景的预测因子,并描述了其在结直肠癌发生中的生物学调节。本研究为疾病发展的发病机制提供了新的视角。本文于2022年2月发表于Molecular Cancer (IF=41.444)上。
技术路线:

主要研究结果:
(1) 下调的circLPAR1在结直肠癌中被包裹在外泌体中
为了描述结直肠癌中失调的circRNAs,我们对52对结直肠癌肿瘤和NATs进行了RNA-Seq,观察到14221个circRNAs且其中大多数小于500 nt(图1A-B),其中超过70%的circRNAs起源于蛋白质编码外显子,其次是内含子和基因间区(图1C)。在建立筛选标准后,倍数变化(FC)≥|2|且P<0.005,我们得到5个circRNAs在结直肠肿瘤组织中的表达明显低于NATs(图1D-E)。我们使用exoRBase数据库注释外泌体中的circRNAs,发现了三种外泌体circRNAs,由RNA-Seq测定,丰度较高(图1F-G)。与正常FHC细胞相比,hsa_circ_0087960(来源于LPAR1,以下称为circLPAR1)是唯一在结直肠癌细胞(HCT116和DLD1)中表达显著下调的细胞系中得到验证的circRNA(图1H)。
随后,我们从细胞培养基中纯化了外泌体(FHC-Exos和HCT116/DLD1-Exos),并观察到典型的外泌体特征:直径50–100 nm且呈杯状,表达标记蛋白TSG101和Alix(图1I-K)。circLPAR1在HCT116/DLD1-Exos中的表达低于FHC-Exos(图1L)。外泌体分泌抑制剂GW4869处理后,细胞培养液中circLPAR1水平显著降低(补充图未展示)。

图1:组织中circRNAs的分析和外泌体circLPAR1的选择。从FHC、HCT116和DLD1细胞分离的外泌体分别命名为FHC-Exos、HCT116-Exos和DLD1-Exos
(2) circLPAR1在结直肠肿瘤中下调并与总生存率相关
circLPAR1是由位于chr9(113734352-113735838)上的LPAR1基因的外显子3和外显子4环状生成。Sanger测序证明,circLPAR1长226 bp并有一个头尾相连的后剪接位点(图2A)。为了检验circLPAR1的稳定性,我们用放线菌素D处理结直肠癌细胞,并观察到circLPAR1比线性LPAR1转录物更稳定(补充图未展示)。与线性LPAR1转录本相比,circLPAR1对RNase R消化(线性RNA的降解剂)具有耐药性(图2B)。为了可视化circLPAR1的表达模式,我们使用包含79对结直肠肿瘤和NATs的组织微阵列进行了FISH分析,circLPAR1在结直肠肿瘤中的表达水平显著低于NATs (P=0.001;图2C-D)。circLPAR1主要表达并定位于细胞质(图2E)。Kaplan-Meier分析表明,高circLPAR1水平的结直肠癌患者的总生存率明显高于低circLPAR1水平的结直肠癌患者(HR=0.46,95%可信区间(CI)=0.24-0.87;Plog-rank=0.017;图2F)。
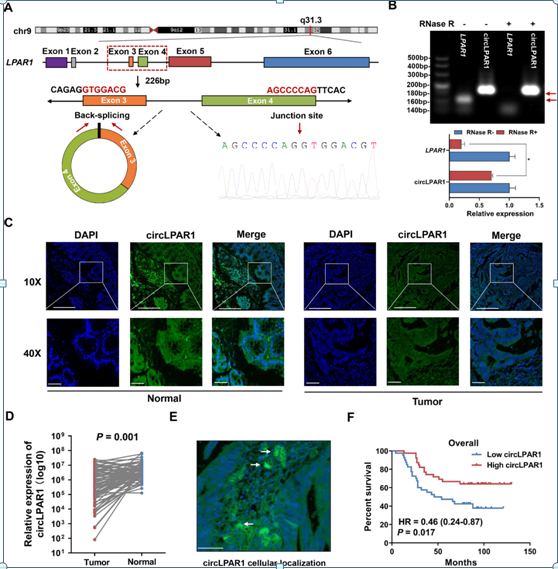
图2:circLPAR1在结直肠癌组织中的表达
(3) 血浆外泌体circLPAR1是结直肠癌诊断的特异性生物标志物
考虑到circLPAR1在结直肠癌肿瘤中的下调表达模式,我们推测circLPAR1由血浆外泌体携带,并作为结直肠癌的特异性生物标志物。每个分裂样本在不同冻融循环或室温维持不同时间(图3A-B)后,血浆中外泌体circLPAR1水平没有明显变化(P>0.05)。结直肠癌患者的外泌体circLPAR1明显低于无癌对照组(P<0.001)和息肉患者(P=0.039),表明外泌体circLPAR1在从癌前到癌前的疾病发展过程中可能降低(图3C)。我们在许多癌症中发现了相似的外泌体circLPAR1表达模式(图3C),包括GC、BRCA、BLCA、CESC、KIRC和LUAD (P>0.05),这些模式均与结直肠癌的模式有显著差异(P<0.001)。结直肠癌切除后外泌体circLPAR1水平显著升高(P=0.001;图3D)。图3E中的ROC曲线显示,在AUC为0.858的情况下,可以通过测量外泌体circLPAR1来区分结直肠癌患者和无癌对照组(95% CI=0.786-0.930,P<0.001)。CEA和CA19-9是两种结直肠癌诊断的临床生物标志物,在患者血浆中显著上调,但与外泌体circLPAR1比较,其AUC相对较低(CEA:AUC=0.706;Ca19-9:AUC=0.559;图3E)。外泌体circLPAR1、CEA和CA19-9联合使AUC值提高至0.875 (95% CI=0.809-0.941;P<0.001;图3E),敏感性和特异性分别为87.30%和76.30%。
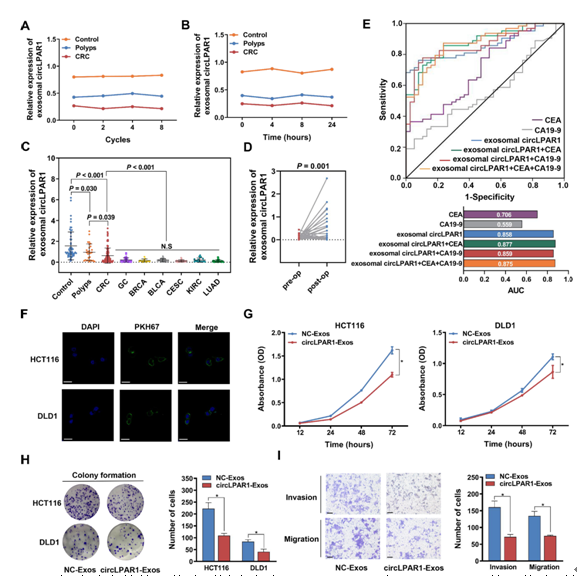
图3:血浆外泌体circLPAR1的表达模式及其对结直肠癌细胞表型的生物学影响。从HCT116和DLD1细胞分离的外泌体分别被命名为HCT116-Exos和DLD1-Exos。外泌体分别从转染circLPAR1/对照表达质粒的HCT116和DLD1细胞中分离,即circLPAR1-Exos和NC-Exos
(4) 外泌体circLPAR1在细胞间传递并抑制细胞表型
我们探讨了外泌体circLPAR1在结直肠癌发生中的生物学功能。荧光显微镜观察到HCT116和DLD1细胞的细胞质中有PKH67绿色荧光染料,而非Exos组中未观察到PKH67绿色荧光染料,提示HCT116/DLD1-Exos被结直肠癌细胞快速吞噬(图3F)。我们从转染了circLPAR1/NC载体(circLPAR1/NC-Exos)的结直肠癌细胞中分离出外泌体,发现直接与circLPAR1-Exos孵生显著增加了HCT116和DLD1细胞中的circLPAR1水平(补充图未展示)。外泌体circLPAR1显著抑制结直肠癌细胞的增殖、集合体形成、侵袭和迁移(图3G-I),与直接过表达circLPAR1得到的结果相似(补充图未展示)。
(5) 外泌体circLPAR1通过与eIF3h相互作用调节BRD4水平抑制结直肠癌肿瘤发生
circLPAR1在细胞系和组织的细胞质中富集(图2E和4A),促使我们分析受circLPAR1影响的特异性circRNA-RBP复合物。我们通过MS2-CP-Flag circRNA下拉试验进行了蛋白质组学分析(图4B)。图4C-D证实了circLPAR1-MS2载体或MS2-CP的转染效率。circRNA下拉产物富集捕获蛋白MS2-CP-Flag,随后捕获的circLPAR1高度富集(图4E);这两个实验都表明了circRNA下拉实验的成功特异性。接下来的质谱分析通过比较circLPAR1+MS2-CP转染组和circLPAR1-MS2+MS2-CP转染组,鉴定出23个分配给circLPAR1的候选RBPs(补充表未展示)。circLPAR1与6个RBPs显著相关(MGN2、RL27A、SF3A3、SPT4H、IF4E2和eIF3h;P<0.05;图4F),其中4个RBPs (MGN2、RL27A、SF3A3和eIF3h)与其亲本线性RNA呈正相关(补充表未展示)。
为了证实circLPAR1对eIF3h的结合亲和力,我们确定了circLPAR1和eIF3h在结直肠癌细胞的细胞质中的共定位(图4G)。RIP实验证实,与NC/NC-Exos组细胞相比,经circLPAR1慢病毒载体转染或与circLPAR1-Exos孵育的结直肠癌细胞中,circLPAR1或外泌体circLPAR1与eIF3h特异性沉淀(图4H)。这表明外泌体circLPAR1直接与eIF3h相互作用。eIF3h与METTL3之间存在直接的物理和功能相互作用,可以调节BRD4的翻译,影响肿瘤发生(图4I)。如图4J所示,与NC/NC-Exos组相比,经circLPAR1慢病毒载体转染或经circLPAR1-Exos孵育的结直肠癌细胞中,circLPAR1降低了BRD4蛋白水平。BRD4表达质粒提高了circLPAR1表达导致的BRD4水平下降,促进了结直肠癌细胞表型的获得,而AZD5153逆转了高BRD4水平的促瘤作用(补充图未展示)。circLPAR1可以海绵miR-762促进膀胱癌的侵袭转移。我们测量了上述circRNA下拉产物中的miR-762水平,但没有发现miR-762与circLPAR1一起富集(补充图未展示)。
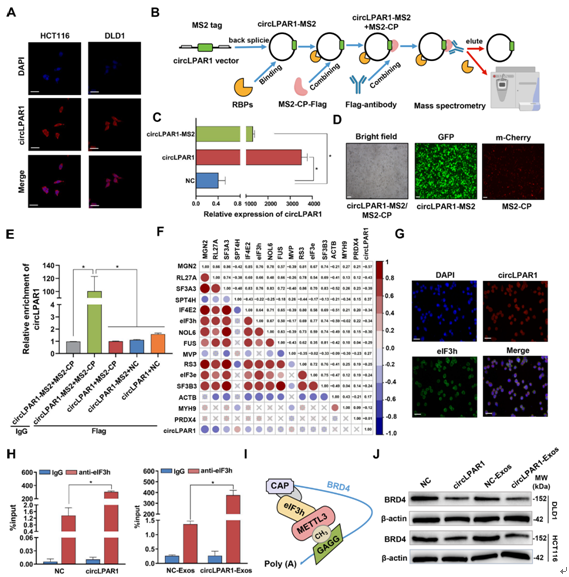
图4:外泌体circLPAR1通过结合eIF3h调节BRD4翻译。将circLPAR1和对照慢病毒载体分别转染到DLD1细胞,分别作为circLPAR1组和NC组。从转染circLPAR1和对照慢病毒载体的DLD1细胞中分离外泌体,分别作为circLPAR1-Exos组和NC-Exos组
为了在体内验证外泌体circLPAR1对结直肠癌的抑制作用,我们将稳定的circLPAR1/NC-过表达细胞或1,1-二八胱氨酸-3,3,3,3四甲基多三碳氰化钠(DiR)染色的circLPAR1/NC-Exos注射到人化的NCG小鼠体内(图5A)。与体外结果一致,与NC表达或NC-Exos处理相比,circLPAR1过表达或circLPAR1-Exos处理降低了肿瘤的平均大小和重量(图5B-C)。circLPAR1和circLPAR1-Exos组肿瘤组织的生长速度比NC/NC-Exos组肿瘤组织的生长速度慢(图5D)。活体成像结果还显示,DiR染色的circLPAR1/NC-Exos成功注射到小鼠体内(图5E)。与NC/NC-Exos组相比,circLPAR1或circLPAR1-Exos组肿瘤的circLPAR1水平更高(补充图未展示)。苏木素和伊红(H&E)染色和免疫组化(IHC)分析显示circLPAR1和circLPAR1-Exos组Ki67和BRD4受损(图5F-G)。
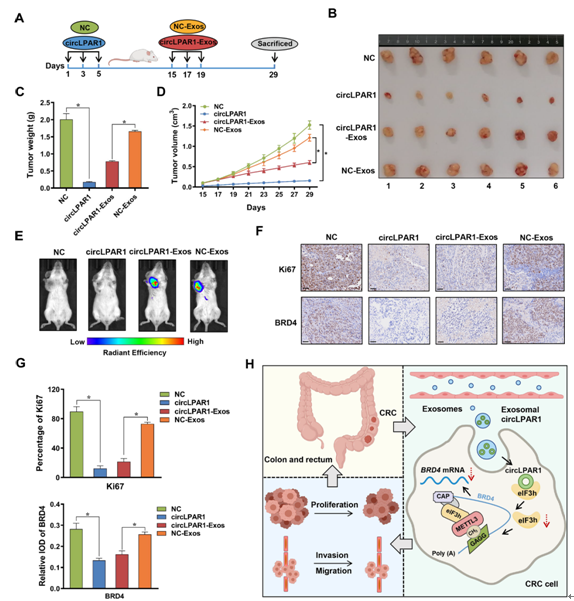
图5:体外靶向外泌体cricLPAR1的作用。将经circLPAR1/NC慢病毒载体转染的DLD1细胞株注射到人源化的NCG小鼠体内,分别标记为circLPAR1和NC,再将DiR标记的circLPAR1/NC-Exos注射到NC小鼠体内,分别标记为circLPAR1-Exos和NC-Exos
结论:
本研究强调了一种新的结直肠癌相关circRNA,称为外泌体circLPAR1,它在从血浆中获得的外泌体中检测到,可能作为一种非侵入性生物标志物,用于结直肠癌的早期检测。机制上,外泌体circLPAR1表达水平导致BRD4水平下降,因为它结合eIF3h并抑制METTL3-eIF3h相互作用,从而显著抑制结直肠癌的发展。本研究不仅报道了外泌体circRNA在结直肠癌中的新机制,而且为结直肠癌的诊断方法开辟了新的途径。
参考文献:
Zheng, R., Zhang, K., Tan, S., Gao, F., Zhang, Y., Xu, W., Wang, H., Gu, D., Zhu, L., Li, S., Chu, H., Zhang, Z., Liu, L., Du, M., & Wang, M. (2022). Exosomal circLPAR1 functions in colorectal cancer diagnosis and tumorigenesis through suppressing BRD4 via METTL3-eIF3h interaction. Molecular cancer, 21(1), 49. https://doi.org/10.1186/s12943-021-01471-y.






