结肠肿瘤细胞死亡通过旁分泌P2X4刺激引起mTOR依赖
实体肿瘤在细胞死亡和增殖之间表现出动态平衡,确保肿瘤持续生长。越来越多的证据将增强的癌细胞凋亡与肿瘤微环境中细胞的旁分泌激活联系起来,然而,死亡的癌细胞对邻近肿瘤上皮细胞的直接影响以及这种旁分泌效应如何潜在地导致治疗耐药性尚不清楚。在这里,我们证明了在患者来源的结直肠肿瘤类器官中,化疗诱导的肿瘤细胞死亡会导致ATP释放,触发P2X4,从而介导邻近癌细胞中mTOR依赖的前生存程序,从而使存活的肿瘤上皮细胞对mTOR抑制敏感。持久上皮细胞中诱导的mTOR依赖是由于活性氧的产生增加以及随后对邻近细胞死亡的DNA损伤增加。因此,抑制P2X4受体或直接mTOR阻断可阻止S6磷酸化的诱导,并与化疗协同,导致活性氧诱导的大量细胞死亡和单独应用时未见的显著肿瘤消退。相反,清除活性氧可以防止癌细胞依赖mTOR激活。总的来说,我们的研究结果表明,死亡的癌细胞在其存活的邻居中建立了对抗凋亡程序的新依赖,从而为表达P2X4的上皮肿瘤的联合治疗创造了机会。本文于2022年11月发表于“Nature”(IF=69.504)上。
技术路线

结果
1)hCRC PDTOs对5-FU的抗性依赖于mTOR的激活
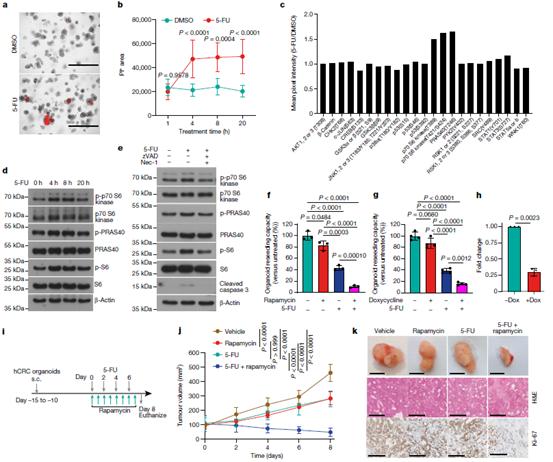
为了研究肿瘤细胞死亡对邻近上皮细胞的可能影响,并评估这种旁分泌效应是否可能导致治疗耐药性,我们使用5-氟尿嘧啶(5-FU)处理来自人类结直肠癌(hCRC)的患者来源的肿瘤类器官(PDTO)。在4小时内,可以观察到明显的细胞死亡(图1a,b)。为了确定在存活的类器官中哪些信号通路可能被激活以响应5-FU诱导的细胞死亡,我们使用磷酸激酶阵列来分析激酶活性。p70 S6激酶(T389和T421/S424)以及PRAS40(T246)的磷酸化增强(图1c),这两种激酶参与了mTORC1的调节。免疫印迹分析证实,在5-FU给药后4小时开始检测到细胞死亡时,S6核糖体蛋白磷酸化升高,从而激活了p70 S6激酶、PRAS40和mTOR(图1d)。为了证实这些激酶的激活是5-FU诱导的细胞死亡的结果,我们添加了zVAD和necrostatin-1来阻止细胞凋亡和坏死,这完全阻止了p70 (p-p70) S6激酶、p-PRAS40和p-S6在4小时的磷酸化诱导(图1e)。然后,我们研究了诱导的mTOR激活是否有助于PDTO对5-FU的抗性,并使用5-FU、雷帕霉素或两者的组合治疗PDTO。尽管单独处理的效果不大,但5-FU和雷帕霉素联合施用可显著抑制PDTO的再生能力(图1f),这证实了mTOR信号是存活类器官中5-FU抗性的关键。通过raptor(也称为RPTR)下调也可以观察到PDTOs对5-FU敏感性的增强(图1g,h)。这些结果在体内得到证实,与未治疗的肿瘤或单独治疗相比,雷帕霉素和5-FU联合给药可导致皮下移植的PDTO显著消退(图1i-k)。
2)死亡的肿瘤细胞以旁分泌的方式诱导mTOR存活信号
为了研究细胞死亡诱导的mTOR激活是否以旁分泌方式发生,我们利用了Lgr5eGFP-DTR+小鼠。该小鼠可以在白喉毒素(DT)处理下特异性杀死上皮肿瘤细胞,因此可以对存活的未表达转基因的周围细胞类群进行研究。我们从AOM–DSS诱导的Lgr5eGFP-DTR+小鼠肿瘤中建立了类器官,并证实单次DT给药后p70 S6激酶、PRAS40和S6核糖体蛋白的磷酸化增强(图2a)。肿瘤类器官中单独的Lgr5+细胞消融不会导致肿瘤类器官的大体形态或生长速率发生显著变化(图2b)。然而,雷帕霉素联合DT对mTOR的抑制导致细胞在24小时内大量死亡(图2b),并且在补种时形成类器官的能力大大降低,这在单独使用任何一种化合物时都没有观察到(图2c)。与mTORC1在Lgr5+细胞损失下存活的关键作用一致,在AOM-DSS处理的Villin-creERT2、raptorF/F、Lgr5eGFP-DTR+小鼠的肿瘤组织块中,他莫西芬诱导的raptor缺失证实了DT处理后肿瘤组织体的再生长能力大大降低(图2d,e)。为了产生更具有侵袭性的肿瘤类器官,可以在皮下生长,我们通过逆转录病毒或慢病毒转导,将一种组成性活性形式的AKT (myristoylated AKT),突变KRAS(KRAS(G12D))和一种活性形式的Notch1 (Notch胞内结构域)引入到AOM–DSS诱导的Lgr5eGFP-DTR+小鼠的肿瘤类器官中。此外,通过CRISPR-cas9介导的基因编辑敲除Tgfbr2,导致AOM-DSS (ATKN)肿瘤类器官(图2f)。在AOM-DSS (ATKN)肿瘤类器官中,DT诱导的Lgr5+细胞消融也触发了S6核糖体蛋白磷酸化(图2g)。值得注意的是,在DT+雷帕霉素联合治疗下,皮下生长的AOM–DSS(ATKN)肿瘤类器官中Lgr5−细胞也被诱导凋亡,这一效应通过cleaved caspase 3染色的免疫组织化学分析得到证实(图2h)。凋亡在12小时达到峰值,明显超过单纯接受DT或雷帕霉素的小鼠观察到的水平(图2h)。因此,DT和雷帕霉素联合治疗24小时后,可存活的Ki-67+肿瘤细胞大量减少(图2i),治疗8天内肿瘤几乎完全消退(图2j-l)。相比之下,单药雷帕霉素或DT给药治疗在抑制肿瘤生长方面效率较低,并导致肿瘤停滞。总的来说,这些数据证实了肿瘤细胞死亡在邻近的上皮细胞中诱导了一种新的mTOR依赖。

3)垂死的肿瘤细胞释放ATP,通过P2X4触发mTORC1
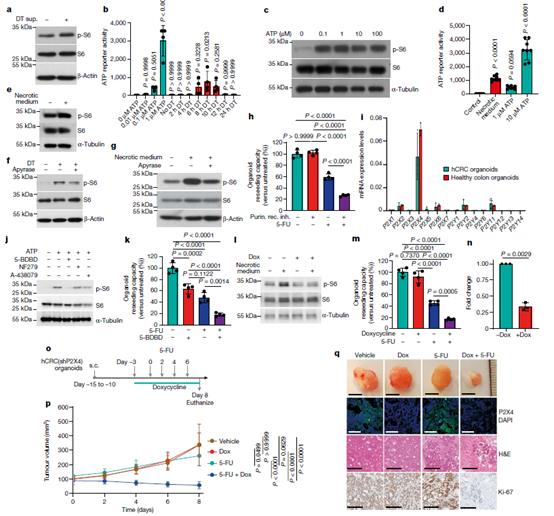
细胞死亡导致损伤相关分子模式的释放,包括各种生长因子、炎症介质、线粒体DNA (mtDNA)、活性氧(ROS)和代谢产物,引发炎症并激活先天免疫以阻止损伤并协调组织修复和伤口愈合。为了探索引起旁分泌mTORC1激活的机制,我们用载液或DT处理的Lgr5eGFP-DTR(+)肿瘤类器官的上清液处理Lgr5eGFP-DTR(−)肿瘤类器官2小时,并证实暴露于DT处理细胞的上清液的类器官中S6核糖体蛋白磷酸化增加(图3a)。我们关注的是细胞外ATP,它们可以被存在于肿瘤微环境中的ATP水解酶水解,产生ADP和腺苷。我们证实,DT处理开始后6-10小时,ATP (0.1-1 μ M)显著释放到含Lgr5+类器官的上清液中(图3b)。在相当浓度范围内添加细胞外ATP可诱导Lgr5eGFP-DTR(−)肿瘤类器官中S6核糖体蛋白磷酸化(图3c)。同样,坏死性结直肠癌细胞的上清液也含有大量的ATP(图3d),在小鼠和人类来源的肿瘤类器官和癌细胞中触发S6磷酸化(图3e)。使用apyrase水解凋亡或坏死细胞上清液中的ATP可阻止S6磷酸化(图3f,g)。此外,使用非选择性P2受体拮抗剂(50 μ M茶碱、20 ng ml−1百日咳毒素和30 μM PPADS)联合5-FU阻断嘌呤能受体,并复制了双重5-FU -雷帕霉素治疗对类器官存活的影响(图3h)。总的来说,这些结果支持细胞外ATP释放导致旁分泌mTORC1激活的观点。
ATP信号通过P2家族的嘌呤能受体,该家族包括7个P2X受体亚型和8个(小鼠7)P2Y受体亚型。为了检查一种或几种不同的受体亚型是否可能参与观察到的信号级联,我们测定了人类未转化和肿瘤类器官以及小鼠肿瘤类器官中所有已知亚型的基因表达,并检测到P2X4的显著表达(图3i)。使用选择性抑制P2X4可以减少ATP诱导的PDTOs中S6磷酸化,而选择性P2X1 (NF279)和P2X7 (A-438079)抑制剂则没有效果(图3j)。因此,与单独治疗相比,5-BDBD与5-FU联合使用会降低PDTO的生存期(图3k)。在离体培养的类器官(图3l-n)和皮下肿瘤(图3o-q)中,P2X4在PDTOs中的敲除可消融坏死培养基诱导的S6磷酸化,并显著增强5-fu介导的细胞毒性。
4)mTOR抵消ROS依赖的细胞凋亡诱导
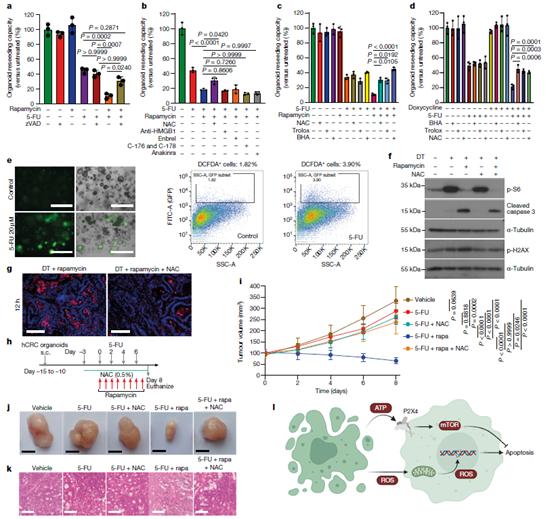
我们的数据清楚地表明,细胞死亡在存活的肿瘤细胞中诱导了旁分泌ATP依赖的P2X4介导的mTORC1激活。值得注意的是,存活的肿瘤细胞在诱导邻近细胞凋亡之前不依赖于mTOR,因为单独抑制mTOR不会导致可比的肿瘤消退。因此,我们推断死亡细胞在邻近的肿瘤上皮细胞中诱导第二个促凋亡的信号级联,该信号级联被mTORC1通过P2X4同时激活所抵消。与这一观点一致,使用zVAD抑制细胞凋亡逆转了5-FU和雷帕霉素联合使用对类器官存活的协同作用,而不会对单独使用5-FU产生深刻影响(图4a)。为了检查5- fu依赖性释放的其他特征良好的损伤相关分子模式是否可能参与邻近肿瘤细胞中促凋亡信号的诱导,我们阻断了氧自由基(n -乙酰半胱氨酸(NAC))、mtDNA (STING抑制剂C-176和C-178)、HMGB1(中和抗体)、TNF (Enbrel)或IL-1α (sIL-1ra;anakinra)。值得注意的是,只有NAC清除ROS能够防止5- fu -雷帕霉素处理的类器官的存活率下降(图4b),这也可以在维生素E类似物拮抗ROS形成时得到证实(图4c)。当将这些抗氧化剂添加到5-fu处理过的P2X4沉默的PDTO中时,可以观察到同样的保护作用(图4d)。此外,2 ',7 ' -二氯荧光素二乙酸染色显示给药5-FU后ROS生成增加(图4e)。NAC处理还阻止了雷帕霉素处理的Lgr5+细胞消融类器官的caspase 3切割(图4f),证实ROS诱导的细胞死亡确实以旁分泌方式触发。这与H2AX磷酸化的变化相关,表明旁分泌ROS水平升高可诱导DNA损伤,这可能与细胞死亡诱导有关(图4f)。重要的是,NAC可减少DT-雷帕霉素处理小鼠24小时后肿瘤组织的凋亡(图4g),并完全阻止5-fu-雷帕霉素处理小鼠的肿瘤生长抑制(图4h-k)。
结论:
这项研究发现了一种肿瘤中响应周围细胞死亡的复杂信号通路,肿瘤细胞死亡释放ATP激活P2X4,导致mTOR依赖,促进周围细胞存活,同时还会释放ROS促进周围细胞死亡。这种促凋亡和抗凋亡的平衡为传统的肿瘤细胞促凋亡治疗提供了一个新的思路。
参考文献:
Schmitt M, Ceteci F, Gupta J, Pesic M, Böttger TW, Nicolas AM, Kennel KB, Engel E, Schewe M, Callak Kirisözü A, Petrocelli V, Dabiri Y, Varga J, Ramakrishnan M, Karimova M, Ablasser A, Sato T, Arkan MC, de Sauvage FJ, Greten FR. Colon tumour cell death causes mTOR dependence by paracrine P2X4 stimulation. Nature. 2022 Dec;612(7939):347-353. doi: 10.1038/s41586-022-05426-1.






