基于癌相关成纤维细胞激活评分系统的肝细胞癌人工神经网络预后模型
肝细胞癌(HCC)占原发性肝癌的80%以上,是全球癌症相关死亡的第四大原因。对于HCC患者,明确其进展机制和预测预后至关重要。先前的研究发现,癌症相关成纤维细胞(CAFs)促进肿瘤增殖和免疫排斥。近日,有作者基于CAFs相关基因构建了一种新的人工神经网络(ANN) 模型,通过功能、突变、免疫和临床分析揭示了关于ANN模型的信息。研究于2022年7月发表在《Frontiers in immunology》,IF:8.786。
技术路线:

主要研究结果:
作者将单细胞的6个亚群(包括恶性细胞、B细胞和T细胞、肿瘤相关巨噬细胞(TAMs)、肿瘤相关内皮细胞(TECs)和癌症相关成纤维细胞(CAFs))进行分离,并绘制UMAP图(图1A)。然后,使用Monocle 2进行伪时间分析,发现CAFs出现在分化轨迹的末端(图1B)。此外,在六个亚簇之间进行了配体-受体相互作用网络(图1C),并提取了CAFs与其他亚簇之间配体-受体对的数量(图1D)。作者证明了CAFs和TECs具有最多的配体-受体对,其次是CAFs和TAMs。随后,在CAFs和其他亚簇之间进行了配体-受体相互作用(图1E)。选择与CAFs显著相关的基因进行功能富集分析,它们主要富集在与肿瘤相关的通路,如PI3K-Akt-mTOR信号通路、血管发育、受体酪氨酸激酶信号通路以及细胞迁移的正向调控(图1F和G)。
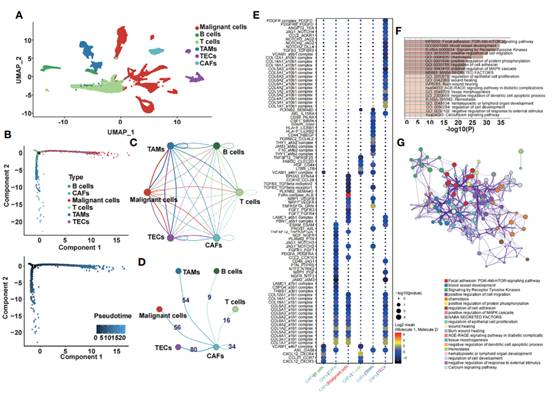
图1 CAFs相关基因的单细胞转录组分析及功能
2. 12个CAFs相关基因被确定为HCC的预测模型
单变量Cox回归分析进一步筛选TCGA数据集中与CAFs相关的预后基因:14个基因被选中(图2A)。为了进一步获得最严格的模型,进行随机森林分析并筛选候选基因。最后,选择12个可变重要值大于0的CAFs相关基因作为HCC患者的预后模型(图2B)。然后,绘制12个与CAFs相关的预后基因的突变图谱(图2C),发现HGF的突变率最高(24%),其次是CD44 (12%),CSF1和NRP1(6%),最高的突变类型是错义突变。突变分析结果中常见的变异和变异类型分别是错义突变和单核苷酸多态性(SNPs)。单核苷酸变异数显示,胞嘧啶(C)向腺嘌呤(A)突变最为常见(图2D)。每个样本的中位数变异为1。此外,作者列出了前10个突变基因供进一步分析。随后,在TCGA数据集中对12个与CAFs相关的预后基因进行了CNV分析(图2E),发现EFNA4具有最高的CNV增益突变,而CSF1具有最高的CNV损失突变。然后,构建一个圆形图来展示12个与CAFs相关的预后基因之间的相关性(图2F),结果发现12个与CAFs相关的预后基因均为危险因素,且p值< 0.0001,呈强正相关。
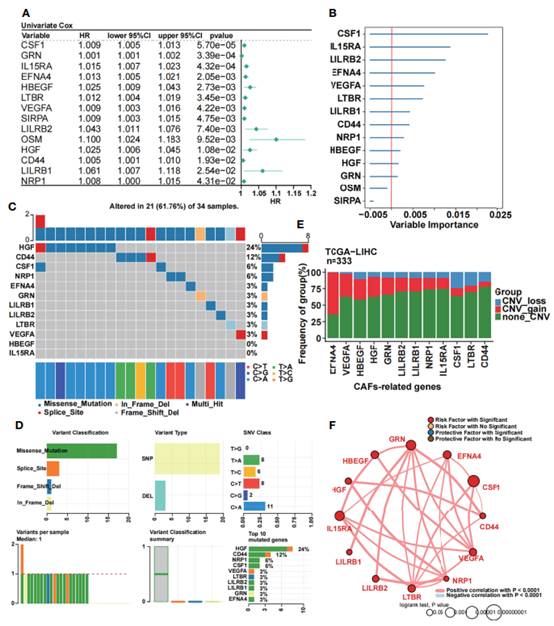
图2 12个与CAFs预后相关基因的鉴定
3. 基于12个与CAFs相关的预后基因,建立了ANN预测模型
基于TCGA数据集中12个选择的与CAFs相关的预后基因构建了一个神经网络模型(图3A)。输入层输入12个CAFs相关基因。网络超参数为:a) 3个隐层;B)每层35、27、19个节点;C) dropout rate= 0.286;D) learning rate= 0.4621984;e) weight decay= 0.3156897。结果:输出层包含一个神经元,通过Cox回归计算CAS。为了评估预测能力,引入c指数。在ANN模型中c指数高于Cox模型。此外,在ICGC和GSE76427数据集中,c指数是令人满意的(图3B)。通过AUC分析,ANN模型优于Cox模型 (图3C)。随后,在TCGA数据集中计算每个样本的CAS(图3D),CAS高的患者生存状态较差,反之亦然。通过对TCGA数据集进行Kaplan-Meier分析,发现高CAS的HCC患者总生存期较短(P = 0.0065)(图3E)。为了评估ANN模型的准确性,对TCGA、ICGC和GSE76427数据集进行了ROC分析,发现TCGA数据集中的1年、3年和5年AUC均大于0.6(图3F),这表明我们的ANN模型是一个准确的预后模型。
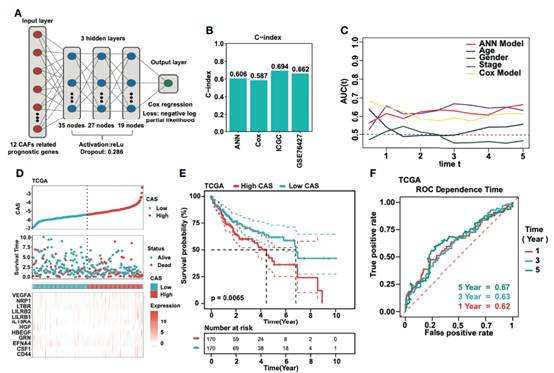
图3建立ANN模型
4. 基于CAFs相关ANN模型构建nomogram图
为了评估ANN模型是否可以作为独立的预后标志物,对三个队列(TCGA、ICGC和GSE76427)进行了单变量和多变量Cox回归分析(图4A, B)。单因素和多因素Cox回归结果显示, ANN模型的CAS与三个队列中较低的总生存率显著相关,这表明ANN模型可以作为HCC患者的独立预后标志物。因此,作者建立了一个基于CAS的nomogram图来预测HCC患者的1年、3年和5年的总生存期(图4C)。然后,建立评估预测风险与观察风险的校准曲线(图4D)。1年、3年和5年的校准曲线显示出很大的预测能力。此外,nomogram的AUC表明nomogram与单个参数相比具有最高的AUC(图4E)。最后,通过1年、3年和5年的DCA评估该模型是否值得使用(图4F),结果表明nomogram检查对HCC患者是可以接受的。
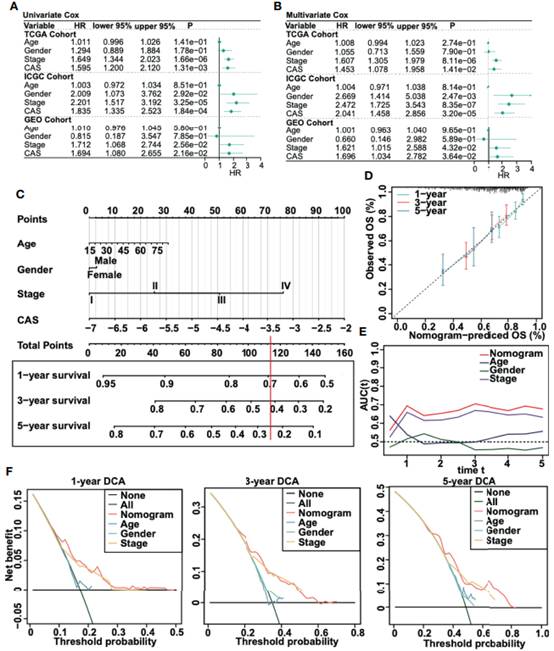
图4肝细胞癌患者计数图的创建
通过分析高CAS和低CAS样本之间的差异表达基因,并将基因输入在线富集分析工具metscape。高CAFs组中显著富集的terms如图5A所示:排在前五位的是基质金属蛋白酶、己糖反应、膜电位调节、含苯化合物代谢过程、甾体分解代谢过程。CAS组中显著富集的terms如图5B所示:前五项分别是核心母质体、ECM组织、母质体相关、蛋白多糖和细胞对生长因子刺激的反应。GSEA分析显示低CAS组中ABC转运蛋白、抗原加工和递呈、自然杀伤细胞介导的细胞毒性、结点样受体信号通路和toll样受体信号通路富集,而高CAS组中钙信号通路、ECM受体相互作用、Notch信号通路、核糖体和血管内皮生长因子(VEGF)信号通路富集 (图5C, D)。然后,根据CAS相关基因的中位表达,将样本分为两个亚组(高组和低组),并确定高组的激活细胞串扰高于低组(图5E)。作者总结显著的串扰通路,结果表明高组可以激活大部分通路(图5F)。此外,我们分析了一些关注的通路(图5G),发现T细胞共抑制,血管生成和主要组织相容性复合体I类在高CAS样本中显著上调。然而,II型干扰素(IFN)反应通路在低CAS样本中显著富集。此外,CAS和通路之间的相关性如图2所示, T细胞共抑制与CAS有最显著的正相关性。
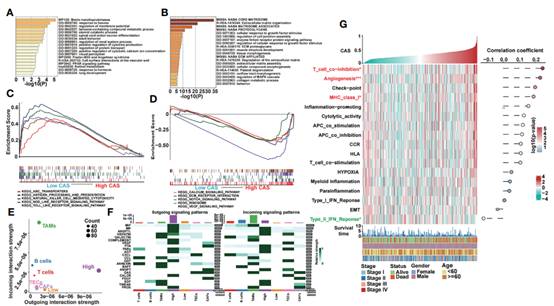
图5 ANN模型的功能分析
根据有或无显著性的风险或保护因素,将22例TIC分为4组,并进行相关分析(图6A),证明了M0巨噬细胞和活化的树突状细胞是危险因素,而静息记忆CD4 T细胞是保护因素。作者发现22个tic之间存在正相关或负相关。然后,绘制一个热图来分析TME和肿瘤纯度以及TICs和免疫能力的表达(图6B)。高CAS样本的免疫评分和ESTIMATE评分均显著升高,且与CAS呈正相关。激活的记忆CD4 T细胞、卵泡辅助T细胞和中性粒细胞在高CAS样本中高表达,而调节性T细胞和静息性记忆CD4 T细胞在低CAS样本中高表达,CD8 T细胞在低CAS患者中高表达。检查点CTLA4、IDO1和CD274在高CAS样本中高表达,而TBX2在低CAS样本中显著高表达。此外,在高CAS和低CAS样本之间对75种免疫调节剂进行了多组学分析,发现包括14个抗原递呈因子、3个共刺激因子、8个共抑制剂、22个配体、19个受体、3个细胞粘附因子和6个其他因子(图6C)。检测mRNA的表达,突变,扩增和缺失的频率,以及基因表达与DNA甲基化β值在高和低CAS样本之间的相关性。最后,在高CAS样本和低CAS样本之间检测了癌症-睾丸抗原(CTA)(图6D)、新抗原(图6E)和增殖(图6F)评分。CTA评分可加快肿瘤发生速度,抑制细胞凋亡,促进细胞增殖。高CAS样本具有更高的CTA评分、新抗原表达和增殖能力。通过相关分析,发现CAS与CTA评分(P= 0.03)、新抗原(P= 0.0014)、增殖(P= 0.044)呈显著正相关。
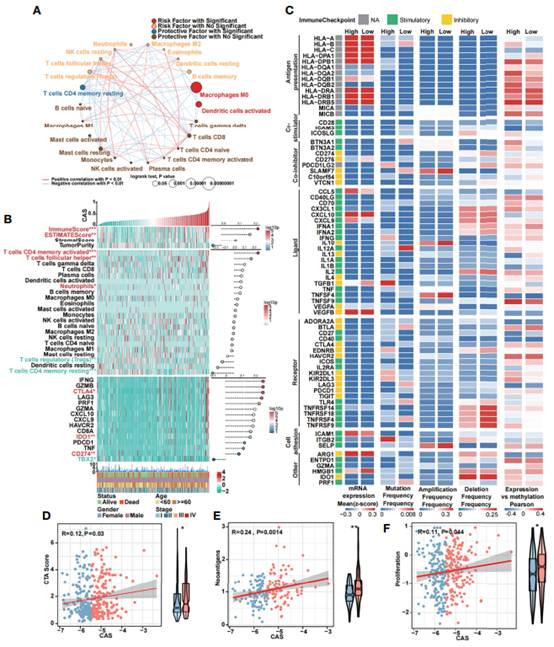
图6 ANN模型的免疫分析
7. CAFs相关ANN模型的突变分析
对低CAS和高CAS样本进行突变分析。首先,检测所有突变计数:非同义突变和同义突变计数(图7A)。然而没有发现两组之间有任何显著性。此外,筛选26个突变数超过15的基因,随后在高CAS和低CAS样本中展示了突变景观(图7B)。高CAS样本中突变频率最高的基因是TP53(33%),其次是CTNNB1(25%)和TTN(24%)。相比之下,低CAS样本中突变频率最高的基因是CTNNB1(25%),其次是TTN(25%)和TP53(23%)。森林图展示高CAS和低CAS样本之间的差异突变基因 (图7C):NBEA和FRAS1在高CAS样本中突变数较高,RYR2在低CAS样本中突变数较高。由于TP53在高CAS样本中具有最高的突变计数百分比,因此生成TP53的lollipop图来展示高CAS和低CAS样本中的突变频率和突变类型(图7D)。柱状图来展示了高CAS和低CAS样本中每个臂的扩增和缺失频率(图7E)。
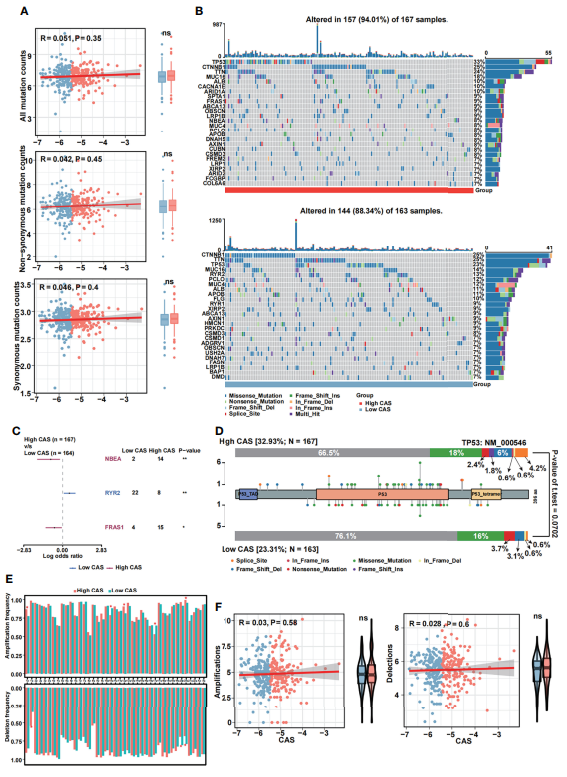
图7 ANN的突变分析
8. ANN模型可指导临床治疗
HCC的主要治疗方法之一是化疗,其中包括5-氟尿嘧啶、顺铂、吉西他滨和多柔比星。因此,作者预测了TCGA数据集中高CAS和低CAS样本之间化疗药物的敏感性(图8A)。3种药物(5-氟尿嘧啶、顺铂和吉西他滨)在高CAS样本中的敏感性高于低CAS样本(p值分别为0.00063、0.018和0.00045)。此外,利用CTRP和PRISM数据库对小分子药物进行了预测(图8B)。Brefeldin A、SR-II-138A、CR-1-31B、BRD-K97651142、KX2-391、tosedostat与CAS呈负相关,高CAS样本的AUC估计值较低。结果表明,预测的小分子药物在高CAS患者中具有较高的敏感性。此外,通过使用TCGA数据集中的子类映射来预测针对PD1和CTLA4的免疫反应(图8C)。然后,通过TIDE算法检测高CAS和低CAS样本之间的总免疫应答(图8D)。
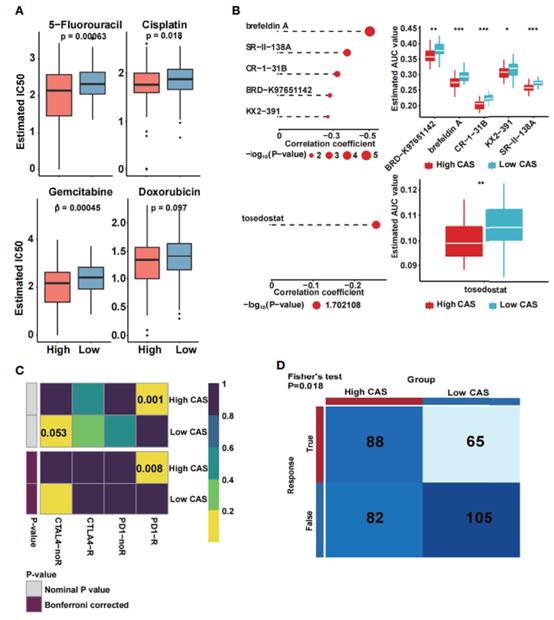
图8预测药物和免疫反应
结论:
作者创建了一个新的与CAFs相关的ANN模型,该模型适用于单独预测HCC患者的预后,并通过功能、突变、免疫和临床分析指导临床治疗。






