想让文章也在10分以上,那就这样聊靶向
PD-1及其配体PD-L1帮助肿瘤细胞逃避免疫监视,被认为是抗肿瘤免疫治疗的重要靶点。PD-L1的翻译后修饰在免疫抑制中具有潜在价值。在这里,作者鉴定泛素特异性蛋白酶8(USP8)去泛素化PD-L1。临床上,在多个胰腺癌患者来源的队列中,USP8的表达与肿瘤-淋巴结-转移阶段显著相关。本研究强调了靶向USP8的重要性,它可以提高PD-L1靶向胰腺癌对免疫治疗的敏感性,并可能成为未来治疗胰腺癌的一种新治疗策略。本研究于2022年12月20日发表于《Cell Death & Differentiation》期刊上,IF:10.46。
技术路线:
主要研究对象:
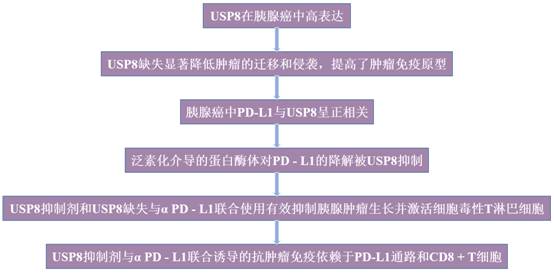
研究利用TCGA数据库中肿瘤样本和正常组织的mRNA表达数据对USP8进行生物信息学分析(图1a)。分析发现,与配对的正常组织相比,胰腺癌样本中USP8高表达(图1b)。为进一步验证USP8的差异表达,使用IHC染色比较了患者胰腺肿瘤组织样本中的USP8水平,结果显示PDAC(胰腺导管癌)组织中的USP8水平显著高于正常组织(图1c-d)。与正常小鼠胰腺组织相比,IHC也显示KPC(Kras LSL-G12D;Trp53 LSL-R172H;Pdx1-Cre)肿瘤组织中USP8表达升高,在PanIN1病变中USP8被初步激活(图1e-f)。WB证实临床胰腺肿瘤组织中USP8蛋白水平显著高于配对癌旁组织(图1g-h)。此外,WB用于评估胰腺癌细胞系中USP8的水平。正如预期的那样,在人胰腺癌细胞系(BxPC - 3、CFPAC - 1、T3M4、MIA PaCa - 2、SW1990和PANC - 1)和小鼠胰腺癌细胞系(KPC)中检测到高水平的USP8,但在Panc02中没有检测到;在HPNE细胞(正常胰腺导管细胞)中未检测到USP8(图1i)。这些结果表明,与正常组织相比,USP8在胰腺癌中高表达。
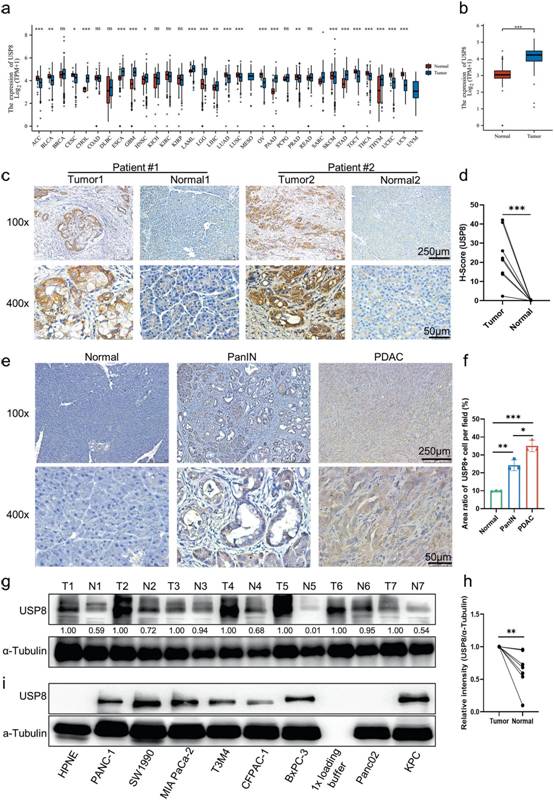
图1 USP8在胰腺癌中高表达
2、USP8缺失显著降低肿瘤的迁移和侵袭,提高了肿瘤免疫原型
作者利用shRNA慢病毒构建了稳定敲低Usp8 ( KD )的KPC细胞系,以确定USP8缺失是否以及如何提高抗肿瘤免疫原性。在免疫正常的C57Bl / 6J小鼠中,USP8 KD细胞形成的肿瘤相对于亲本KPC细胞形成的肿瘤体积和重量减小;然而,当使用Nude(免疫缺陷)小鼠重复实验时,没有观察到这种效应(图2a-f )。流式细胞术分析显示Usp8 KD细胞来源的肿瘤中肿瘤浸润的活化T细胞数量和功能增加(图2g-h)。同样,IHC染色显示USP8 KD细胞来源的肿瘤中CD8 +细胞、粒酶B +细胞、被切割的钙蛋白酶I+细胞显著增加,Ki67 +细胞显著减少。同时,USP8 KD细胞来源的肿瘤中额外的IHC染色也显示USP8表达和PD - L1表达降低(图2i-j)。接下来,用DMSO或USP8特异性抑制剂预处理(1μM , 24 h)的胰腺癌细胞分别注射免疫正常小鼠和免疫缺陷小鼠皮下,进一步评估抑制USP8对胰腺癌发生发展的影响(图2k)。USP8抑制剂预处理在免疫正常小鼠中导致肿瘤形成减少(图2l),但在裸鼠中未见肿瘤形成(图2m)。此外,将亲本和USP8 KD KPC细胞分别注射到免疫缺陷和免疫正常小鼠体内(图2n)。根据记录的死亡时间,与注射KPC细胞的亲本小鼠相比,免疫正常的USP8 KD肿瘤小鼠的生存期延长(图2o);然而,免疫缺陷小鼠并未获得这种生存获益(图2p)。总的来说,USP8与胰腺肿瘤的促进、迁移和侵袭有关。USP8缺失可以以免疫依赖的方式发挥抗肿瘤作用,USP8抑制可以在不同分子亚型的胰腺癌中发挥类似的肿瘤抑制作用。
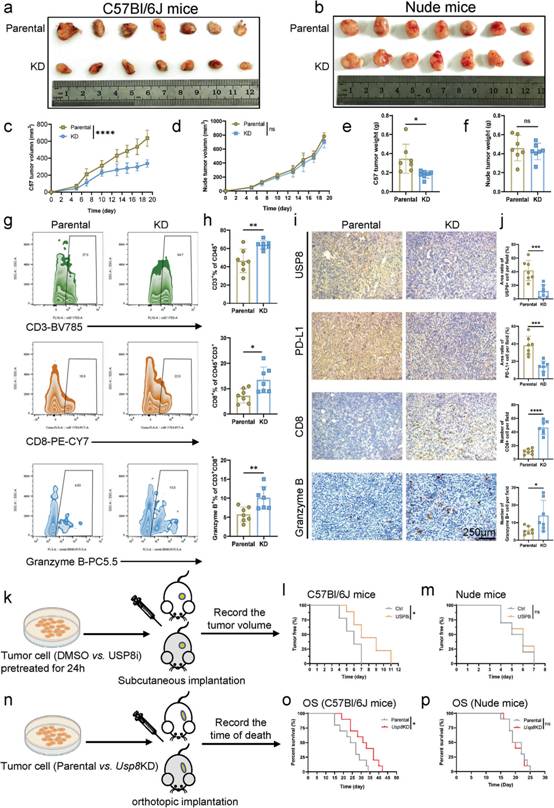
图2 USP8缺失显著降低肿瘤的迁移和侵袭,提高了肿瘤免疫原型
3、胰腺癌中PD-L1与USP8呈正相关
PD-1 / PD - L1抑制信号是抗肿瘤免疫治疗的重要靶点。因此,作者进一步评估USP8是否与PD - L1相互作用。通过TCGA数据库的生物信息学分析,我们观察到胰腺癌样本中USP8和PDL1 mRNA表达之间存在显著相关性(图3a)。此外,使用胰腺肿瘤组织芯片的分析显示它们在蛋白质水平上的相关性(图3b-d)。此外,在胰腺癌细胞系(KPC、BxPC - 3、SW1990)中观察到内源性USP8与内源性PD - L1存在相互作用(图3e-g)。此外,通过GST pull - down实验在体外证明了USP8与PD - L1的直接结合(图3h)。同样,免疫荧光分析和荧光强度图显示KPC细胞、Bx PC - 3细胞、KPC小鼠胰腺肿瘤组织和人胰腺肿瘤组织中存在明显的USP8 / PD - L1共定位(USP8:红色;PD-L1:绿色)(图3i-l);这些结果说明胰腺癌中PD-L1与USP8有一个正相关作用。
图3胰腺癌中PD-L1与USP8呈正相关
4、泛素化介导的蛋白酶体对PD - L1的降解被USP8抑制
考虑到USP8与PD - L1呈正相关,两者之间可能存在调控机制。WB分析发现,经浓度梯度和时间梯度的USP8抑制剂处理以及Usp8敲低后,胰腺癌细胞系中PD - L1蛋白水平下调(图4a-c)。同样,根据流式细胞术分析,使用USP8抑制剂和Usp8敲低处理下调胰腺癌细胞系中PD - L1的表达(图4d-e)。免疫荧光染色发现,与亲本KPC细胞相比,Usp8缺失的KPC细胞中USP8 (红色)和PD - L1 (绿色)水平下调(图4f-g)。此外,与亲代KPC肿瘤相比,PD - L1在Usp8 KD胰腺肿瘤中的表达显著下调(图4h-k)。然而,根据qRT-PCR结果,USP8抑制剂或Usp8敲低处理后,PDL1 mRNA水平无明显变化,说明USP8对PD - L1的调控发生在翻译后水平而非转录水平(图4l)。因此,作者推测在胰腺癌中,USP8通过PTM调节PD-L1水平。有趣的是,在胰腺癌细胞中,用蛋白酶体抑制剂MG132处理后,USP8抑制或耗竭介导的PD - L1下调得到恢复,提示USP8通过蛋白酶体途径调节PD - L1(图4m-n)。为验证USP8调控PD - L1稳定性,半衰期分析结果显示PD - L1的半衰期缩短,在USP8抑制和耗竭的细胞中PD - L1迅速降解,这种降解可以被MG132挽救(图4o-r)。随后,作者评估USP8抑制和缺失对PD - L1泛素化的影响。结果表明,与对照细胞相比,USP8抑制和缺失细胞中PD - L1泛素化水平显著升高(图4s-t)。因此,USP8可以通过降低PD - L1的泛素化水平来减少PD - L1的降解。总之,这些发现表明USP8通过泛素-蛋白酶体途径抑制PD - L1的降解来稳定胰腺癌细胞中PD - L1的水平。
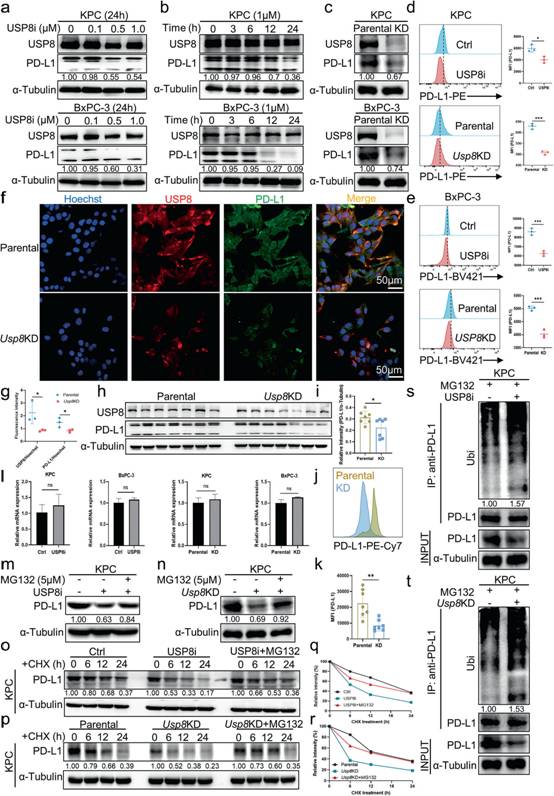
图4泛素化介导的蛋白酶体对PD - L1的降解被USP8抑制
5、USP8抑制剂和USP8缺失与α PD - L1联合使用有效抑制胰腺肿瘤生长并激活细胞毒性T淋巴细胞
为探究USP8抑制剂通过体内调节PD - L1水平的抗肿瘤作用,作者构建肿瘤模型,并将USP8抑制剂单独或联合αPD - L1给KPC来源的皮下肿瘤的小鼠(图5a)。观察到,在USP8抑制剂组中,与对照组相比,肿瘤大小、肿瘤体积和肿瘤重量显著降低,并且这些降低在联合组更加显著(图5b-d)。与对照组相比,WB和流式细胞术分析显示USP8抑制剂显著降低PD - L1水平(图5e-h)。此外,流式细胞分析和IHC染色显示,αPD - L1共处理显著增加了小鼠肿瘤浸润的细胞毒性CD8 + T细胞的数量和活化(图5i-l)。以上结果提示,USP8抑制剂联合PDL1阻断可增强抗肿瘤免疫,抑制胰腺肿瘤的生长。
为进一步研究USP8在胰腺癌免疫反应中的作用,作者构建亲代和Usp8 KD KPC细胞结合α PD - L1的原位荷瘤小鼠(图6a)。Usp8 KD联合α PD - L1抑癌效果最佳(图6b-c)。流式细胞术检测发现,USP8缺失降低PD - L1表达,增加MHC - 1表达,体外实验也证实了这一点(图6d-g)。
为验证USP8抑制剂联合αPD - L1的免疫治疗机制,作者构建了原位KPC - Luci细胞荷瘤小鼠(图7a)。正如预期的那样,与对照组相比,在联合给药组中观察到最明显的肿瘤大小和重量的下降(图7b-c)。通过对比活体成像中肿瘤发光强度的变化和最后一天的相对发光强度变化,我们发现随着给药时间的延长,肿瘤逐渐缩小,其中联合用药组的缩小最为明显(图7d-e)。此外,流式细胞术分析(图7h-i)发现,USP8抑制剂的应用增加了MHC - 1的表达。同时,其他实验结果与皮下给予USP8抑制剂和αPD - L1的模型结果相似(图7f-m);因此,联合使用USP8抑制剂和αPD - L1可以减少肿瘤在体内的迁移。以上结果验证抑制USP8通过调节PD - L1稳定性激活细胞毒性T淋巴细胞。
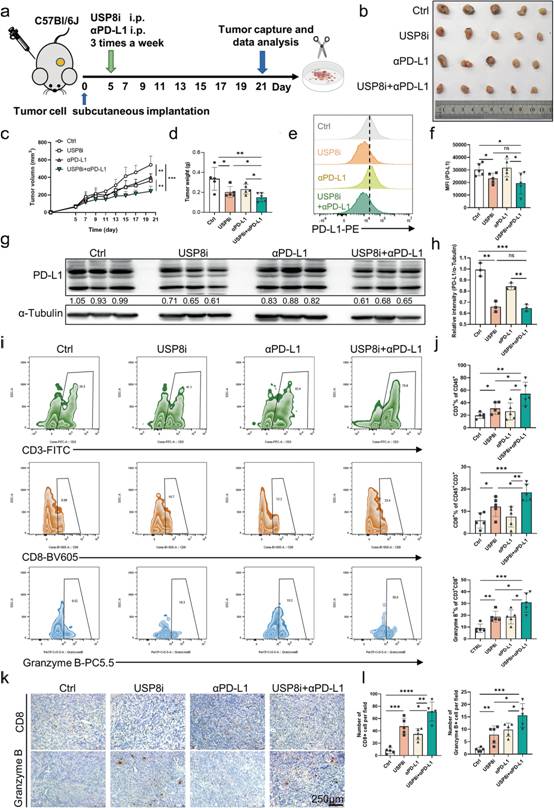
图5 USP8抑制剂联合αPD-L1可有效抑制胰腺肿瘤在体内的生长

图6 USP8缺失联合αPD-L1促进抗肿瘤免疫
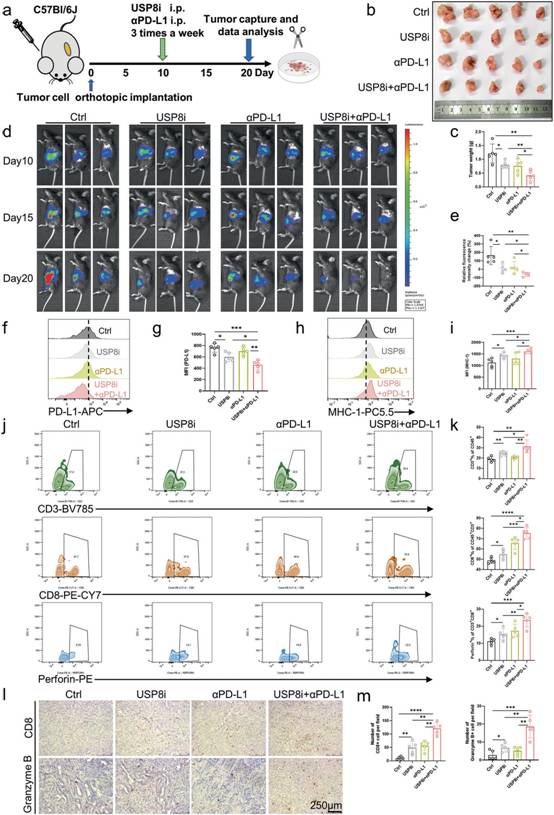
图7 USP8抑制剂使胰腺癌对PD-L1免疫治疗增敏
6、USP8抑制剂与α PD - L1联合诱导的抗肿瘤免疫依赖于PD-L1通路和CD8 + T细胞
为进一步确定PD - L1在USP8抑制剂和αPD - L1联合治疗效果中的作用,利用CRISPR / Cas9 KO质粒构建了Cd274敲除的KPC细胞系,并通过WB分析和流式细胞术验证(图8a-b)。作者构建原位亲代和Cd274 KO KPC细胞荷瘤小鼠,并给予联合治疗(图8c)。作者观察到与亲本组相比,使用联合治疗的Cd274 KO组肿瘤大小和重量没有明显减少(图8d-e)。此外,在研究中各组小鼠的平均体重无显著差异(图8f)。此外,为进一步证实CD8 + T细胞是抗肿瘤免疫的介质,在接种KPC细胞之前去除CD8 + T细胞,并联合USP8抑制剂和αPD - L1处理(图8g)。CD8耗竭抗体处理KPC肿瘤小鼠后,ctrl组与联合治疗组的肿瘤负荷差异消失(图8h-i)。给药组动物未见体重下降(图8j)。流式细胞术证实小鼠脾脏中CD8 + T细胞的耗竭(图8k-l)。总之,上述结果验证了联合治疗引起的抗肿瘤免疫依赖于PD-L1通路和CD8 + T细胞。
综上所述,在胰腺癌细胞中,USP8通过泛素-蛋白酶体途径抑制PD - L1的降解来稳定PD - L1。由USP8抑制剂和αPD-L1组成的联合治疗通过调节PD - L1的稳定性抑制胰腺肿瘤生长并激活细胞毒性T淋巴细胞(图8m)。
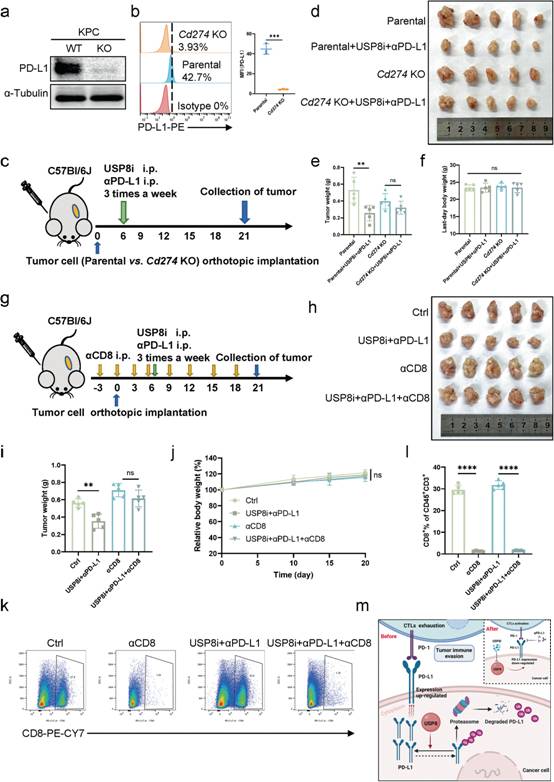
图8 USP8抑制剂与αPD - L1联合诱导的抗肿瘤免疫依赖于PD-L1通路和CD8 + T细胞
结论
综上所述,我们发现USP8是一种新型的PD - L1去泛素化酶,通过抑制泛素化调节的蛋白酶体降解途径上调PD - L1水平,从而通过免疫逃逸促进胰腺肿瘤生长。USP8抑制剂与α PD - L1联合治疗下调PD - L1蛋白水平,导致细胞毒性T细胞活化。总之,靶向USP8联合其他抗肿瘤药物可能是癌症免疫治疗中改善患者预后的潜在策略。
参考文献
Yang H, Zhang X, Lao M, Sun K, He L, Xu J, Duan Y, Chen Y, Ying H, Li M, Guo C, Lu Q, Wang S, Su W, Liang T, Bai X. (2022) Targeting ubiquitin-specific protease 8 sensitizes anti-programmed death-ligand 1 immunotherapy of pancreatic cancer. Cell Death Differ. doi: 10.1038/s41418-022-01102-z.






