LncRNA ELF3-AS1通过与SNAI2形成负反馈环路抑制胃癌,并通过与ILF2/ILF3复合物相互作用调节ELF3 mRNA的稳定性
胃癌(GC)是癌症相关死亡的第三大常见原因。尽管GC的治疗已得到极大改善,但由于无法在早期诊断该癌症,生存率仍然很低。约1/3的GC患者被诊断为晚期转移,4-14%的患者有肝脏转移性疾病。由于GC转移通常以多发性和弥漫性分布为特征,绝大多数患者此时已失去手术治疗的机会。因此,迫切需要解开肿瘤转移的分子机制。越来越多的证据表明,SNAI2通过转录调节下游靶基因在驱动肿瘤转移中起关键作用,揭示SNAI家族的靶基因对于更好地了解肿瘤转移至关重要。ELF3-AS1是一种细胞周期相关的lncRNA,据报道lncRNA ELF3-AS1在肺癌中作为癌基因起作用。然而,ELF3-AS1在GC中的生物学功能尚不清楚。该研究发表于《Journal of Experimental & Clinical Cancer Research》,IF: 12.658。
技术路线:

主要研究结果:
1. GC中转录阻遏因子SNAI2调控lncRNA的探索
为了探索SNAI2的靶基因,RNA测序研究(GSE161551)在过表达SNAI2的GC细胞系(SGC7901)中进行。共有318个编码基因,其中70个lncRNA被SNAI2强烈抑制,55个编码基因和53个lncRNA被SNAI2大幅上调。如图1A所示,IGFBP1/3、ITGB4、CLDN1/4、TJP3、EFNA1、KRT80、ELF3等的表达受到SNAI2的强烈抑制,而CYR61、CTGF、IL11、ID2/3、RBM3、THBS1等的表达受到SNAI2的强烈上调。类似地,大约123个lncRNA,包括linc01315,MIR210HG,FZD10-DT,linc00963,HOXB-AS3,LUCAT1,ITPR1-DT,PDCD4-AS1,ZNF197-AS1等,在过表达SNAI2后极大地改变了它们的表达。有趣的是,反义lncRNA ELF3-AS1及其邻近基因ELF3都被SNAI2强烈抑制(图1B)。
为了进一步确认ELF3-AS1和ELF3是否可能受到SNAI2的负调节,在两个GC细胞系中进行了关于SNAI2的功能丧失和功能获得研究。正如预期的那样,ELF3-AS1和ELF3在SNAI2过表达细胞系中显著下调,但在SNAI2去除细胞系中显著上调(图1C-E)。这些结果表明,在GC中,SNAI2对ELF3-AS1和ELF3均呈负调控。
ELF3-AS1是上皮肿瘤抑制基因ELF3的反义lncRNA。启动子分析显示,ELF3-AS1启动子含有一个序列“GGTACAGGTGGGT”,预测被SNAI2和SNAI1识别。该序列位于ELF3-AS1转录起点上游829 bp,这也是ELF3基因外显子2和内含子2之间的连接点(图1F)。因此,作者推测ELF3-AS1和ELF3可能受到SNAI2和SNAI1的转录调控。
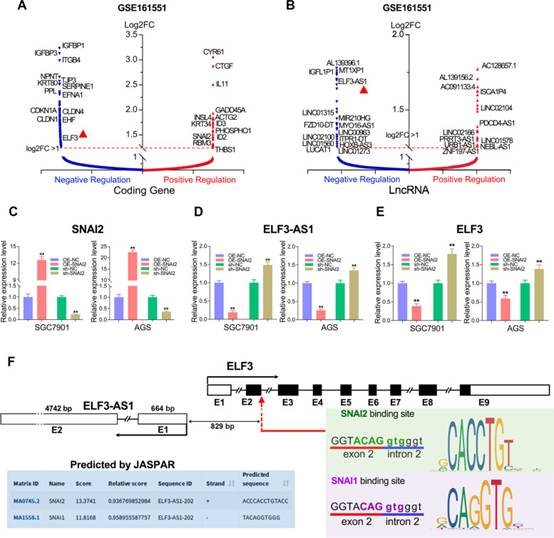
图1 通过RNA-seq鉴定GC中SNAI2调控的lncRNA
2. ELF3-AS1和ELF3被SNAI2和SNAI1转录抑制
LncRNA ELF3-AS1在人体细胞中含量丰富,在RNA测序时可被磁珠有效捕获。为了使作者的结果更具说服力,作者使用RNA-seq研究来可视化ELF3-AS1和ELF3的表达。正如预期的那样,RNA-seq分析和qRT-PCR测定共同表明ELF3-AS1和ELF3被SNAI2 / SNAI1过表达下调(图2A-F)。此外,SNAI2对ELF3和ELF3-AS1表达的抑制强度远大于SNAI1(图2B,E)。
此外,为了确定SNAI2/SNAI1是否在转录水平上抑制ELF3 / ELF3-AS1,在SNAI1和SNAI2过表达细胞系中进行双荧光素酶和CHIP测定。如图2G所示,当SNAI1/2结合序列发生突变时,SNAI1/2过表达对荧光素酶表达的强烈抑制部分恢复,提示该序列是SNAI1/SNAI2抑制ELF3/ELF3-AS1表达所必需的。另一方面,CHIP测定表明SNAI1和SNAI2可以直接与ELF3-AS1启动子结合(图2H-J)。综上所述,SNAI2和SNAI1都参与了GC中ELF3和ELF3-AS1的转录调控。

图2 ELF3-AS1和ELF3在GC中被SNAI2和SNAI1转录抑制
3. ELF3-AS1和ELF3表达降低预示GC预后不良
由于ELF3和ELF3-AS1被EMT相关转录因子SNAI1/2抑制,作者进一步进行了ELF3/ELF3-AS1与EMT生物标志物的基因表达相关性分析。正如预期的那样,ELF3和ELF3-AS1都与上皮生物标志物高度共表达(图3A)。
此外,对30对GC组织中ELF3-AS1表达的分析表明,与相应的正常样品相比,ELF3-AS1在超过80%的GC样品中下调(图3B)。另一方面,作者分析了癌症基因组图谱(TCGA,n = 375)数据库中GC样本中ELF3-AS1下调的临床意义。LncRNA ELF3-AS1在弥漫性和低分化的GC组织中表达低(图3C和D)。总生存期分析表明,ELF3-AS1表达水平较低的GC患者总生存时间较短(图3E,p=0.029)。
作者之前的研究暗示ELF3在GC中起肿瘤抑制作用。在此,作者进一步确认了ELF3在GC中的表达显著下调(图3F,G)。此外,与肠道GC相比,在弥漫性GC中观察到ELF3的表达较低(图3H)。3ELF3的低表达与GC的恶性进展呈正相关(图3I,J)。ELF3表达较低的GC患者总生存时间和无病生存时间较差GSE62254GC队列(图3K)。临床分析与作者的发现非常吻合,即ELF3-AS1和ELF3在GC中被SNAI2和SNAI1转录抑制。
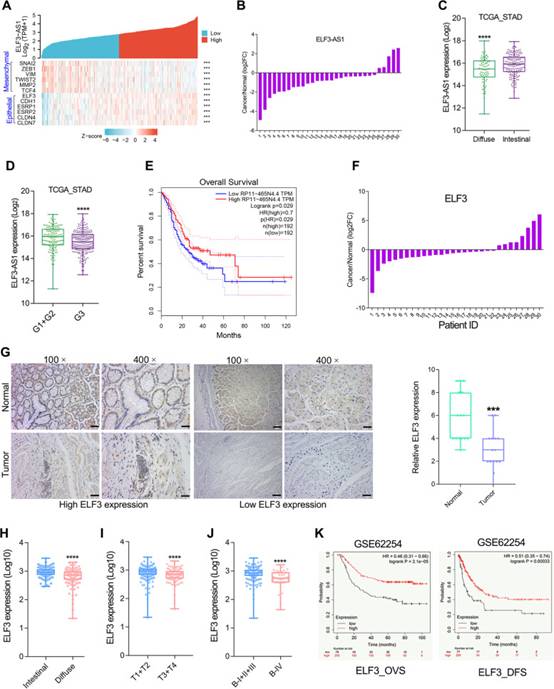
图3 ELF3-AS1和ELF3表达降低与GC预后不良相关
4. 上皮转录因子ELF3在GC中发挥肿瘤抑制作用
反义lncRNA通常与其相邻的蛋白质编码基因高度共表达。同样,作者还观察到ELF3-AS1和ELF3在正常胃组织,GC细胞系和泛组织中存在高共表达(图4A-E)。有趣的是,当ELF3-AS1在GC细胞系中被有效敲低时,ELF3 mRNA及其蛋白质显著降低至约60-70%(图4F-I)。然而,目前尚不清楚ELF3-AS1如何影响GC中的ELF3表达。
此外,对30对GC组织中ELF3-AS1表达的分析表明,与相应的正常样品相比,ELF3-AS1在超过80%的GC样品中下调(图3B)。另一方面,作者分析了癌症基因组图谱(TCGA,n = 375)数据库中GC样本中ELF3-AS1下调的临床意义。LncRNA ELF3-AS1在弥漫性和低分化的GC组织中表达低(图3C和D)。总生存期分析表明,ELF3-AS1表达水平较低的GC患者总生存时间较短(图3E,p=0.029)。
作者之前的研究暗示ELF3在GC中起肿瘤抑制作用。在此,作者进一步确认了ELF3在GC中的表达显著下调(图3F,G)。此外,与肠道GC相比,在弥漫性GC中观察到ELF3的表达较低(图3H)。ELF3的低表达与GC的恶性进展呈正相关(图3I,J)。ELF3表达较低的GC患者总生存时间和无病生存时间较差GSE62254GC队列(图3K)。临床分析与作者的发现非常吻合,即ELF3-AS1和ELF3在GC中被SNAI2和SNAI1转录抑制。
5. 上皮转录因子ELF3在GC中发挥肿瘤抑制作用
反义lncRNA通常与其相邻的蛋白质编码基因高度共表达。同样,作者还观察到ELF3-AS1和ELF3在正常胃组织,GC细胞系和泛组织中存在高共表达(图4A-E)。有趣的是,当ELF3-AS1在GC细胞系中被有效敲低时,ELF3 mRNA及其蛋白质显著降低至约60-70%(图4F-I)。然而,目前尚不清楚ELF3-AS1如何影响GC中的ELF3表达。
鉴于ELF3属于ETS转录因子家族,作者最初假设ELF3-AS1和ELF3的共表达可能是由于ELF3调节ELF3-AS1的表达。为了验证这种可能性,在两个GC细胞系中进行了关于ELF3的功能丧失和功能获得研究。然而,在GC中敲低或过表达ELF3后,ELF3-AS1的表达没有显著改变(图4J和K)。尽管转录因子ELF3不能调节ELF3-AS1的表达,但划痕伤口愈合测定和Transwell测定证实ELF3在GC细胞迁移和侵袭中具有肿瘤抑制作用(图4L和M)。

图4 ELF3负调节细胞转移,但不能调节GC中ELF3-AS1的表达
6. ELF3-AS1主要通过抑制SNAI2信号传导抑制GC转移
作者通过miRNA测序分析了ELF3-AS1敲低后差异表达的miRNA(图5A)。令人惊讶的是,在ELF3-AS1耗竭大幅下调的前10种miRNA中,miR-33a,miR-33b和miR-203a是众所周知的靶向SNAI2的miRNA(图5B)。为了确认miRNA测序的可靠性,作者检查了ELF3-AS1去除细胞系中miR-33a,miR-33b和miR-203a的表达水平。结果表明,ELF3-AS1敲低确实能显著降低miR-33a、miR-33b和miR-203a的表达(图5C-E)。相应地,ELF3-AS1的耗竭导致SNAI2 mRNA和蛋白质的显著上调(图5F-H)。一致地,分析来自另一项独立研究的RNA-seq数据(GSE92250)还表明ELF3-AS1敲低导致A549和Hela细胞系中的SNAI2 mRNA上调(图5I),表明ELF3-AS1对SNAI2表达的负调控可能在癌症中广泛存在。
基于上述发现,作者推测ELF3-AS1可能通过抑制SNAI2信号传导来抑制GC进展。为了验证这种可能性,在体内和体外进行了救援测定。敲低SNAI2表达挽救了ELF3-AS1去除的GC细胞系的致瘤特性(图5J和K)。这些数据强烈表明,ELF3-AS1主要通过抑制SNAI2信号传导来抑制GC细胞的迁移和侵袭。
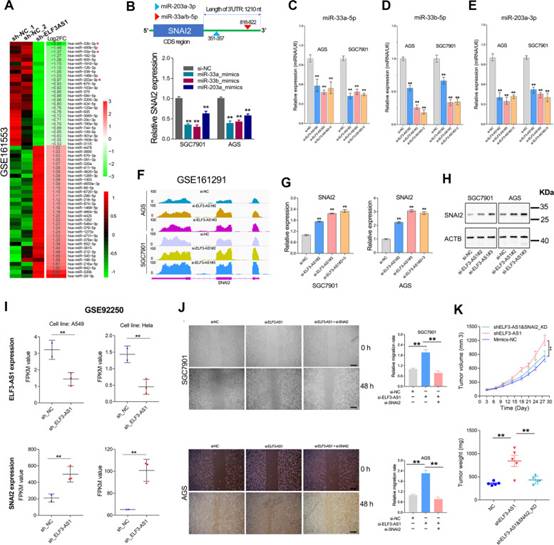
图5ELF3-AS1主要通过抑制SNAI2信号传导来抑制GC转移
7. 核定位的lncRNA ELF3-AS1在细胞周期进程中起关键作用。
lncRNA的生物学功能与其亚细胞位置密切相关。ELF3-AS1是GC中的核定位lncRNA(图6A和B)。之前的一项研究报道,ELF3-AS1是一种细胞周期相关的lncRNA。作者的研究还表明,lncRNA ELF3-AS1在细胞周期进程中起着至关重要的作用。ELF3-AS1敲低显著加速了GC中细胞周期的G1/S转变(图6C和D)。有趣的是,RNA-seq分析表明,敲低ELF3-AS1导致几乎所有组蛋白编码基因的显著上调超过2倍(图6E和F)。众所周知,组蛋白的合成发生在细胞周期的S期,与DNA复制同步。这些结果表明,ELF3-AS1通过影响G1/S转换和组蛋白合成来负调节GC细胞的细胞周期进程。
为了更好地理解ELF3-AS1调控细胞周期过程的分子机制,作者分析了ELF3-AS1敲低后细胞周期相关基因的表达变化。结果表明,敲低ELF3-AS1增加了GC中CDK6和CASP7的表达,但降低了CDKN1A(也称为p21)的表达(图6G和H)。p21蛋白作为G1/S转变的细胞周期检查点。CDK6/CCND1蛋白复合物对细胞周期G1相进展和G1/S转变非常重要。因此,ELF3-AS1敲低引起的G1/S转变的促进可能是由于P21的下调和CDK6的上调.
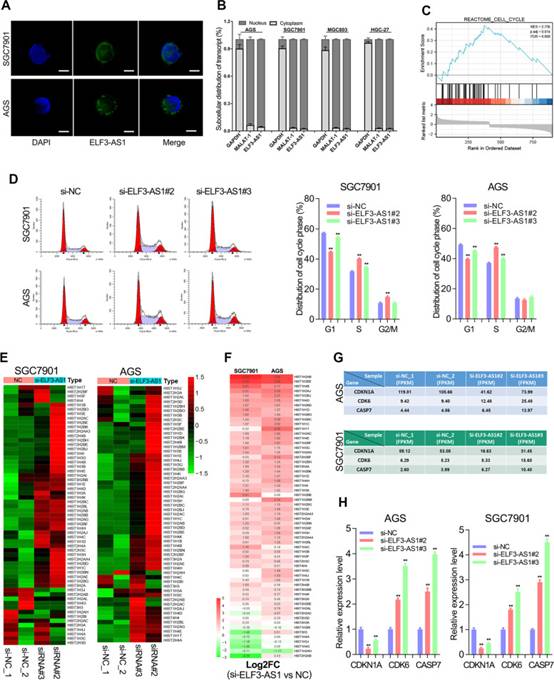
图6 核定位的lncRNA ELF3-AS1通过影响G1 / S过渡和组蛋白合成来调节细胞周期进程
8. ILF2/ILF3复合物可直接调节ELF3-AS1/ELF3 RNA双链体的稳定性
通过RNA下拉分析鉴定了与lncRNA ELF3-AS1相互作用的潜在蛋白质。根据位于45道尔顿处的差分带的质谱(MS)分析(图7A),有7种蛋白质匹配覆盖率大于20%。在这些蛋白质中,RINI,ILF2(也称为NF45)和TARBP2是双链RNA(dsRNA)结合蛋白(图7B)。有趣的是,另一种名为ILF3的蛋白质(也称为NF90 / NF110)也出现在该条带的MS结果中(图7C)。作者随后的蛋白质印迹测定进一步验证了ILF2,ILF3和TARBP2可以与外源性lncRNA ELF3-AS1结合(图7D)。此外,CHIRP下拉试验证实内源性ELF3-AS1也与ILF2和ILF3蛋白结合(图7E和F)。维恩图显示,在三个MS结果的交点处显示了大约22种蛋白质,包括ILF2,ILF3,RINI等(图7F)。为了弄清楚ELF3-AS1转录本的哪个区域可以与ILF2和ILF3相互作用,作者截断了不同长度的ELF3-AS1转录本。在通过蛋白质印迹分析了不同长度的ELF3-AS1转录本拉下的蛋白质后,作者发现第一个外显子区域对于ELF3-AS1转录本与ILF2 / ILF3复合物之间的相互作用是必需的(图7G)。此外,作者在转染不同长度的ELF3-AS1转录本的GC细胞中检测到ELF3表达。结果表明,仅过表达含有外显子1的ELF3-AS1转录本上调ELF3表达(图7H)。RNA免疫沉淀测定显示,与ILF2和ILF3蛋白结合的ELF3-AS1转录本比对照IgG组高数千倍(图7I,J)。
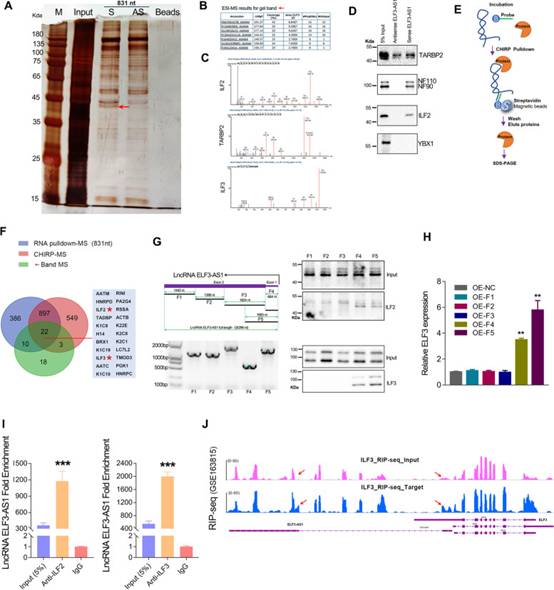
图7 ELF3-AS1直接与ILF2 / ILF3蛋白复合物相互作用
由于选择性剪接,ELF3基因具有不同的转录本。在这些不同类型的ELF3转录本中,ELF3-201,ELF3-202和ELF3-203可以编码全长ELF3蛋白。ELF3-201转录本和ELF3-AS1转录本重叠约664个核苷酸(图8A)。换句话说,ELF3-AS1可以与ELF3-201的第一外显子区结合形成双链RNA分子。另一方面,RNA-seq分析表明,与ELF3-203或任何其他ELF3转录本水平相比,ELF3-AS1的敲低对ELF3-201表达的影响更深远(图8B)。这些数据暗示ILF2 / ILF3复合物可能与ELF3-AS1和ELF3-201形成的dsRNA结合。为了进一步验证这种可能性,作者还检查了ILF2 / ILF3的RIP测定中的ELF3-201转录本水平。与ILF2和ILF3结合的ELF3-201转录本远高于对照IgG组(图8C,D),表明ILF2 / ILF3复合物可以与ELF3-AS1和ELF3-201形成的dsRNA结合。
据报道,ILF2/ILF3复合物在调节mRNA稳定性中起重要作用。RNA-seq数据和qPCR检测表明,ILF3的敲低显著降低了ELF3-AS1和ELF3-201的mRNA水平,而ILF2的敲低显著提高了ELF3-AS1和ELF3-201的mRNA水平(图8E-G)。这些结果表明,ILF2和ILF3蛋白对ELF3-AS1转录本的稳定性具有相反的影响。先前的一项研究报道,NF45在ILF2/ILF3复合物中作为调节亚基起作用。有趣的是,作者还注意到ILF2的敲低可能会影响ILF3基因的选择性剪接(图8H)。因此,推测ILF2可能通过影响ILF3基因的选择性剪接来调控ELF3-AS1和ELF3-201的表达。
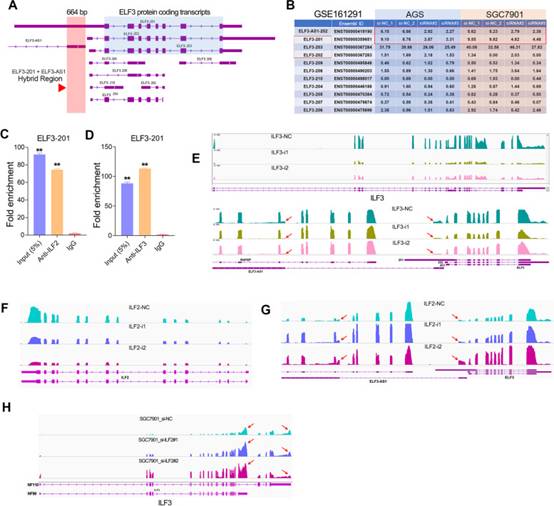
图8 ILF2/ILF3与ELF3-AS1/ELF3 RNA双链体相互作用,影响RNA双链体的稳定性
结论:
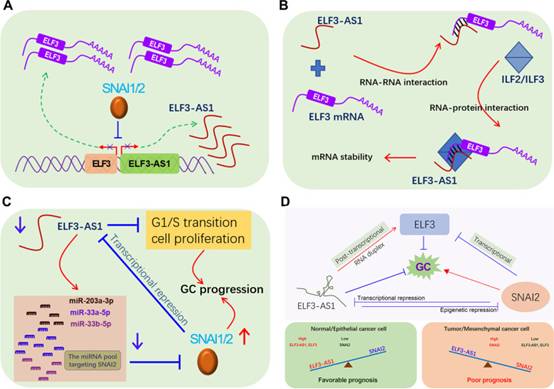
综上所述,在GC中发现了SNAI2和lncRNA ELF3-AS1之间新的双负反馈环。SNAI2-ELF3-AS1反馈环通过连续激活SNAI2信号传导并在转录和转录后水平调节ELF3表达来驱动GC转移。在GC中,SNAI2过表达,导致ELF3和ELF3-AS1的表达水平降低。反过来,ELF3-AS1下调通过持续激活SNAI2信号传导和促进细胞增殖进一步推动肿瘤进展,从而导致GC预后不良。
参考文献:
Li D, Shen L, Zhang X, Chen Z, Huang P, Huang C, Qin S. LncRNA ELF3-AS1 inhibits gastric cancer by forming a negative feedback loop with SNAI2 and regulates ELF3 mRNA stability via interacting with ILF2/ILF3 complex. J Exp Clin Cancer Res. 2022 Dec 2;41(1):332. doi: 10.1186/s13046-022-02541-9.






