教你如何分析多组学文章
近年来,转录组和代谢组的联合分析得到了广泛的应用,成为鉴定许多与生物表型性状相关的关键基因和代谢物的有力工具。为此,有研究通过整合代谢组和转录组分析,研究了5个不同颜色茄子品种的特征性代谢组分和候选调控基因。通过加权基因共表达网络分析(WGCNA)得到类黄酮合成的调控网络和一些新的关键基因。这一发现不仅对类黄酮合成的分子网络提供了新的见解,而且为未来茄子的分子育种提供了有价值的信息。该研究2022年11月发表在《international Journal of Molecular Sciences》,IF:6.2。
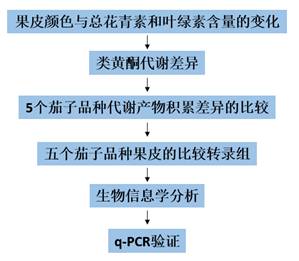
技术路线:
主要研究结果:
1. 果皮颜色与总花青素和叶绿素含量的变化
研究中使用的5个品种:A1和A3的果皮为黑紫色,但花萼颜色不同,A2的果皮为绿色,A4的果皮为白色,A5的果皮为红紫色(图1A)。A1(黑紫)、A2(绿色)、A3(黑紫)、A4(白色)、A5(红紫)的明度值(L*)分别为24.21、53.75、24.61、89.47、33.05。黑紫色品种A1和A3的明度值最低。也就是说,A1和A3的果皮颜色比其他品种更深。红度值(a*)在−20.54 ~ 27.23之间,其中A5红度值最高,果皮呈红紫色。黄度参数(b*)范围为−8.55 ~ 37.88,其中果皮为绿色的A2黄度值最高(图1B)。测定了5个品种的总花青素和叶绿素含量。花青素总含量以A1最高,其次是A3和A5,而A2和A4的花青素总含量显著较低(图1C)。A2的叶绿素总含量略高于A1和A3。在A4和A5中检测到的总叶绿素量非常低(图1D)。总花青素和叶绿素含量均以A4最低。总体上,果皮颜色值和色素含量与果皮颜色变化趋势一致。
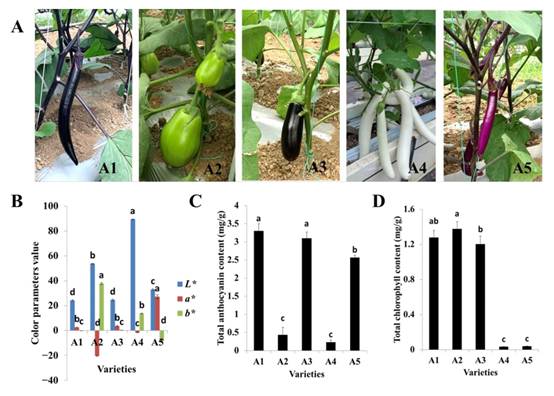
图1 5个不同果色茄子品种的表型
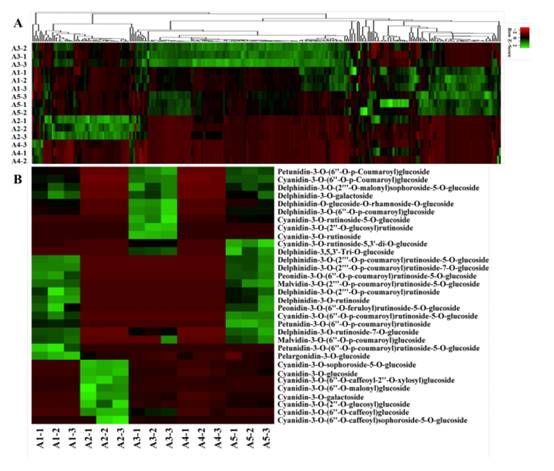
2. 类黄酮代谢差异
基于LC-MS/MS对彩色茄子果实中的黄酮类化合物进行了广泛的靶向代谢物分析。共鉴定出260种黄酮类代谢物,包括花青素32种、查尔酮10种、黄烷醇5种、黄酮25种、黄烷醇11种、黄酮58种、黄酮碳苷11种、黄酮醇86种、异黄酮10种、原花青素A6和单宁11种。层次聚类分析(HCA)展示五个茄子品种的相对含量的表型变异(图2A)。共鉴定出32种花青素,其中飞燕草苷10种、矢车菊苷14种、牵牛花苷3种、马尔维甲苷2种、杜鹃花苷2种、天竺葵苷1种。5个茄子品种中鉴定出的花青素的相对含量差异很大(图2B)。在绿色和白色果皮的A2和A4中均未检测到飞燕草苷、牵牛花苷和马尔维定苷。在红色至深紫色组(A1、A3和A5)已鉴定的花青素中,A1和A5中含量最高的是D3R、del-3-O-(2-O-p-coumaroyl)rutinoside-7-O-glu和del-3-O-(2-O-p-coumaroyl)rutinoside-5-O-glu (nasunin)。有趣的是,D3R和nasunin是紫茄子中最具代表性的花青素化合物,在A3中没有检测到,而del-3-O-(6-O-p-coumaroyl)glu和cya-3-O-(6-O-p-coumaroyl)glu的含量在A3中最高。总体上,已鉴定的花青素在A1中含量最高,其次是A3和A5。在本研究中,5个品种之间的黄酮类代谢产物存在显著差异。检测到以鼠李糖、半乳糖、芦丁糖和葡萄糖为主要糖配体的各种类黄酮苷。其中,山奈酚、槲皮素、杨梅素、木犀草素及其衍生物是茄子中主要的黄酮醇和黄酮。黄酮类化合物在A4中积累最多,含量最低,其次是A2。在红-黑-紫组(A1、A3和A5)中,A1和A5的类黄酮积累模式与A3更为相似。通常情况下,大多数查尔酮,单宁和黄酮醇在A3中的含量高于A1和A5。主成分分析来说明5个品种中多个变量的内部结构(图3)。在PCA图中,质量控制(QC)样本被分组在一起,表明分析的稳定性和重复性。与HCA结果一致,A1和A5在图中距离较近,表明其代谢积累模式相似。虽然A1和A5聚在一起较近,但5个品种可以很容易区分。
3. 5个茄子品种代谢产物积累差异的比较
建立正交偏最小二乘判别分析(OPLS-DA)评分图,分析5个品种的两两差异。高可预测性以及5个品种间两两比较OPLS-DA模型的拟合优度(R2X和R2Y)较强(图4),说明代谢数据的可靠性。虽然在PCA图中A1和A5相互靠近,但在OPLS-DA模型中,A1、A2、A3、A4和A5明显分开,表明不同果皮颜色组之间的黄酮类化合物代谢谱存在主要差异。采用差异倍数≥2或≤0.5和VIP (variable importance in project)≥1的标准进行两两比较,进一步确定差异累积的代谢物(dam)。与果皮颜色为白色的A4相比,A1(黑紫色)、A2(绿色)、A3(黑紫色)、A5(红紫色)分别鉴定出156、101、145、150只母鼠(图5A)。正如预期的那样,随着果皮颜色从白色变成黑紫色,其他4个品种的大多数水坝都上调了。在A4 vs. A1、A4 vs. A2、A4 vs. A3和A4 vs. A5比较组中,共观察到48只母鼠(图5B)。在红色到黑紫色组(A1 vs A3, A1 vs A5, A3 vs A5)中,A1 vs A5的dam数量最少(A5中上调46个,下调32个)。与A3相比,A1和A5分别观察到146个dam(105个下调和41个上调)和143个dam(99个下调和44个上调)(图5A)。大多数的水坝,包括查尔酮,黄烷醇,黄酮醇和单宁,在A3上调。
将5个品种之间的差异代谢产物映射到KEGG数据库中,并对每个对照组的dam进行KEGG富集分析。所有对照组中检测到的最丰富的途径是类黄酮生物合成、花青素生物合成、黄酮和黄酮醇生物合成、异类黄酮生物合成和次生代谢产物生物合成。
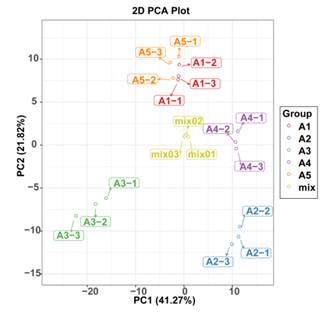
图3 5个茄子品种类黄酮谱的PCA评分图
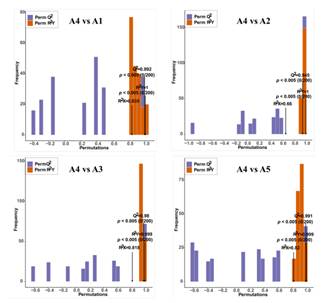
图4 比较组的正交偏最小二乘判别分析(OPLS-DA)模型
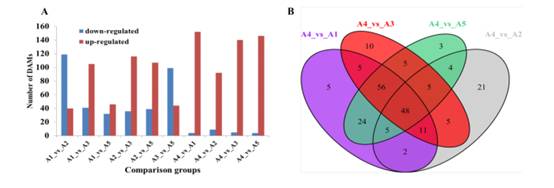
图5 5个茄子品种的类黄酮差异分析
4.五个茄子品种果皮的比较转录组
5个品种共建立15个文库,每个品种3个生物重复。去除适配器和低质量序列后,每个品种共获得20.66~21.4 Gb的清洁读长。每个文库的Q20和Q30值分别等于或大于97.43和92.92%(表1)。这些干净的reads被映射到参考基因组,匹配率在96.64~ 97.91%。以log2比值表达变化倍数≥1且错误发现率≤0.01为阈值鉴定差异表达基因(DEGs),在所有样本中共获得10110个DEGs。比较组分别有4265、3987、4005、4253、3837、3629、4456、4095、2881和2152个DEGs,包括A1 vs. A2、A1 vs. A3、A1 vs. A5、A2 vs. A5、A3 vs. A5、A4 vs. A1、A4 vs. A2、A4 vs. A3、A4 vs. A5(表2)。在这些比较组中,A4 vs. A5组的上调和下调DEGs数量最少。对这些DEGs进行GO富集分析显示,与“细胞”、“细胞部分”和“细胞器”相关的基因在细胞成分类别中占主导地位。在分子功能类别中,富集最多的项是结合和催化活性。在生物过程类别中,基因主要参与代谢和细胞过程。KEGG注释结果显示,所有样本的DEGs共映射到141条KEGG通路,其中次级代谢物生物合成、植物激素信号转导、苯丙素生物合成、类黄酮生物合成、花青素生物合成、光合作用、光合-天线蛋白、卟啉和叶绿素代谢等KEGG通路显著富集。
5. 参与类黄酮生物合成的DEGs的鉴定
为了探索不同果皮颜色茄子中黄酮类物质的积累机制,分析了苯丙素和黄酮类物质通路中涉及的基因表达模式。正如预期的那样,大部分参与类黄酮生物合成的结构基因,包括PAL、C4H、4CL、CHS、CHI、F3H、DFR、ANS和UFGT,在A2和A4中转录水平显著较低,这可能是A2和A4中类黄酮水平较低的原因之一(图6)。F3。wH在A2和A4中没有或非常弱的表达水平,这表明F3thaH可能是直接决定茄子果皮紫色的关键因素。
在A1与A3、A1与A5、A3与A5比较组中,类黄酮生物合成途径相关的结构基因也存在差异表达。在A1与A5和A3与A5的比较中,A5的早期和晚期生物合成基因均下调,包括PAL、4CL、C4H、CHS、CHI、F3H、F3 3HH、DFR、ANS和UFGT。值得注意的是,在A1和A3的比较中,早期生物合成基因包括CHS、CHI、F3H和F3nd H没有差异表达,大部分DEGs是晚期生物合成基因,如DFR、ANS和花青素修饰基因(Smechr0502047、Smechr0400421和Smechr1102789)。
总体而言,在黑紫色果皮的A1和A3中,大部分参与类黄酮生物合成的结构基因均高表达。随着紫色的降低,A5中黄酮基因表达量下降,A2和A4表达量最低。
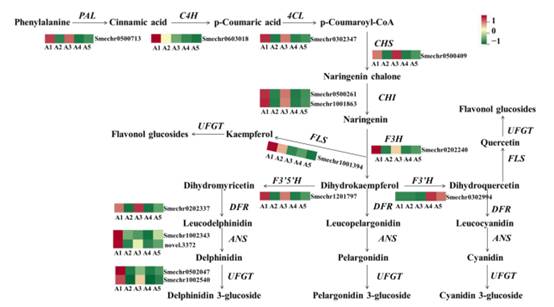
图6 花青素/类黄酮通路相关基因的表达谱
茄子果皮的绿色主要受叶绿素的影响。在这项研究中,共计27度与叶绿素代谢被确定(图7)。A2绿色水果皮相比,大多数的度显示低表达在A4和A5, (Smechr0402030和Smechr0100518),包括宋春芳HEMC (Smechr0702754)、血红素(Smechr0400257和Smechr0601135), HEMF (Smechr0400064) HEMG (Smechr0102139) CHLH (Smechr0400430) CHLM (Smechr0303264), CRD (Smechr1002947)、运动(Smechr0702049), DVR (Smechr0100030),曹(Smechr0601739和Smechr1200635),NOL (Smechr0701042)和HCAR (Smechr0902459)。
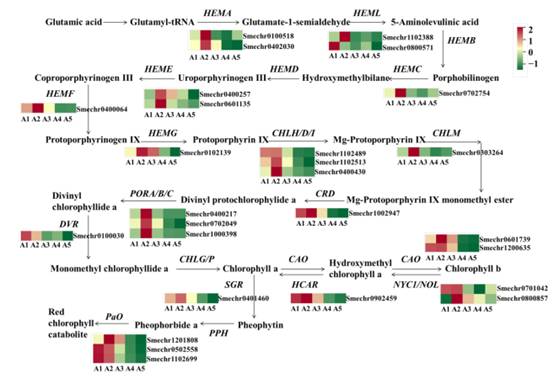
图7 叶绿素代谢途径相关基因的差异表达
7. 参与激素介导信号通路的DEGs的鉴定
KEGG富集分析显示,植物激素信号转导通路是富集最显著的通路之一。在生长素信号通路中,5个DEGs的表达水平与颜色变化相关,包括AUX/IAA (Smechr0303465)、ARF (Smechr0101326)、GH3 (Smechr0400187)和SAUR (Smechr0100144和Smechr1100127)。在赤霉素信号通路中,GID1 (Smechr1000150)和DELLA (Smechr0500162和Smechr0500354)的表达与果皮颜色变化呈正相关。与乙烯信号通路相关的基因ETR (Smechr0902323)和EBF1/2 (Smechr0700262和Smechr1200241)以及与BR信号通路相关的基因BRI1 (Smechr0702406)和BKI1 (Smechr0502339)的表达与5个品种的颜色变异相关。ABA信号通路中的ABF (Smechr0100651)和SnRK2 (Smechr0401004和Smechr0802058)在黑紫色果皮的A1和A3中表达量较高。同时,SA信号通路中TGA (Smechr1002700)的表达与5个品种的颜色变异具有相关性。具体而言,参与JA信号通路的两个bHLH转录因子在5个品种中表达水平不同,其中SmTT8 (Smechr0901701)也参与类黄酮的生物合成(补充图S2)。
8. 共表达基因网络和关键候选基因的鉴定
为了研究茄子果实果皮着色的基因调控网络,使用6241个非冗余DEGs进行加权基因共表达网络分析(WGCNA),得到了20个不同颜色标记的模块(图8)。以总花青素含量和总叶绿素含量以及飞葵素型花青素作为表型数据进行分析。分析表明,紫模块和紫模块分别与花青素含量和叶绿素含量呈正相关(图9A)。分组到不同模块的基因KEGG富集分析显示,紫色模块的基因富集于类黄酮生物合成,而紫色模块的基因富集于光合-天线蛋白、卟啉和叶绿素代谢。在紫色模块的关联网络中,四个转录因子SmGL2 (Smechr0303487)、SmGATA26 (Smechr0601814)、SmWRKY44 (Smechr1002420)和SmTT8 (Smechr0901701)以及连接度最高的类黄酮生物合成通路相关基因SmF3mFtH (Smechr1201797)、SmUFGT (Smechr1002540)、SmPAL (Smechr0500713)和Sm4CL (Smechr0302347)被确定为枢纽基因(表3,图9B)。SmWRKY44和SmTT8已被报道参与花青素的生物合成。因此,为了进一步研究SmGL2和SmGATA26的功能,构建TRV2-SmGL2, TRV2-SmGATA26和TRV2-SmWRKY44重组体来沉默茄子紫色皮中的SmGL2, SmGATA26和SmWRKY44。与TRV2相比,沉默SmGL2、SmGATA26和smwrky44的茄子果皮中的花青素积累减少,表明SmGL2和SmGATA26可能参与花青素的生物合成(图9C)。
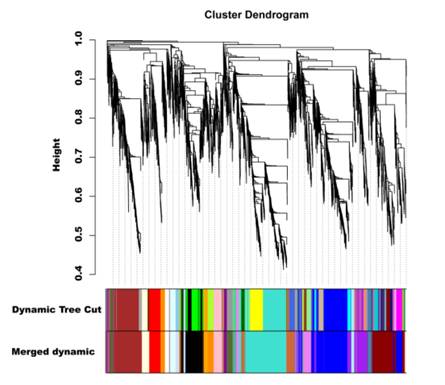
图8 层次聚类呈现20个共表达基因的模块
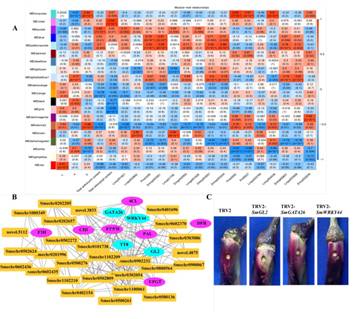
图9花青素合成相关基因网络及关键候选基因的鉴定
9. 实时荧光定量PCR对差异表达基因的验证
为验证RNA-Seq数据的准确性,选取16个差异表达基因(包括8个hub基因)进行实时荧光定量PCR (qRT-PCR)分析。如图10所示,qRT-PCR结果显示这些基因的表达模式与RNA-seq结果一致,说明转录组测序结果可靠。
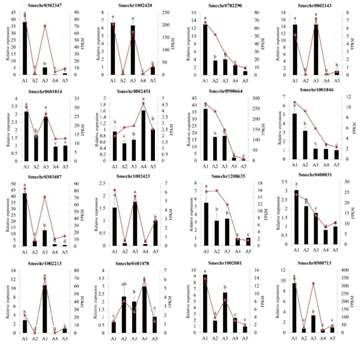
图10 5个茄子品种中16种DEGs的实时荧光定量PCR分析






