外泌体CircATG4B编码的新蛋白通过促进自噬诱导结直肠癌奥沙利铂耐药
奥沙利铂是结直肠癌(CRC)手术后常用的化疗方案。然而,获得性耐药严重影响CRC患者的疗效,其机制尚不清楚。本文鉴定circRNA circATG4B在结直肠癌奥沙利铂耐药中起重要作用。并发现circATG4B通过促进自噬诱导奥沙利铂耐药。此外,circATG4B的作用归因于其编码一种新型蛋白质circATG4B-222aa的潜力。进一步研究发现circATG4B-222aa作为诱饵,和TMED10竞争与ATG4B的相互作用,导致自噬增加,随后诱导耐药。因此,本研究揭示外泌体circATG4B参与CRC细胞化疗敏感性的降低,为CRC奥沙利铂耐药的潜在治疗靶点提供新的理论依据。本研究于2022年12月9日发表于《AdvSci (Weinh)》,IF:17.521
技术路线:

主要研究结果:
越来越多的证据证明circRNA参与宿主基因的功能。基于在线数据库circBase,作者评估15种源于ATG4B的circRNA的表达,发现hsa_circ_0 007159 (circATG4B)在奥沙利铂耐药患者CRC组织中显著上调(图1A),与细胞表达状态一致(图1B)。以cDNA和基因组DNA(gDNA)为模板,对PCR产物进行电泳验证,结果表明,扩增的cDNA中只有预期大小的产物,而gDNA中没有(图1C)。此外,Sanger测序证实扩增的circATG4B头尾剪接,提示circATG4B来源于ATG4B基因的外显子,这与circBase中circATG4B数据是一致的(图1D)。与线性形式相比,circATG4B具有较长的半衰期,并对RnaseR处理具有抗性(图1E-F),进一步说明circATG4B确实以环状形式存在。FISH结果显示circATG4B主要定位在细胞质中,在耐奥沙利铂CRC细胞中比敏感细胞中含量高的多(图1G)。接着,作者评估几种奥沙利铂耐药细胞系和匹配的CRC细胞中的circATG4B水平。与这些结果一致的是,circATG4B在奥沙利铂耐药细胞系显著高表达(图1H)。Kaplan - Meier生存分析显示,在circATG4B低表达的患者中,接受奥沙利铂治疗的患者无病生存期(DFS)显著长于对照组(图1I)。相反,在circATG4B水平较高的患者中,奥沙利铂治疗组与对照组的DFS时间无差异(图1J)。此外,作者发现奥沙利铂治疗仅在circATG4B低表达的患者中是独立的预后因素,而在circATG4B高表达的患者中则不是(表1)。此外,在接受奥沙利铂治疗的队列中,与circATG4B低表达的患者相比,circATG4B高表达的患者有更差的DFS(图1K)。这些结果表明circATG4B与CRC细胞对奥沙利铂的反应密切相关。
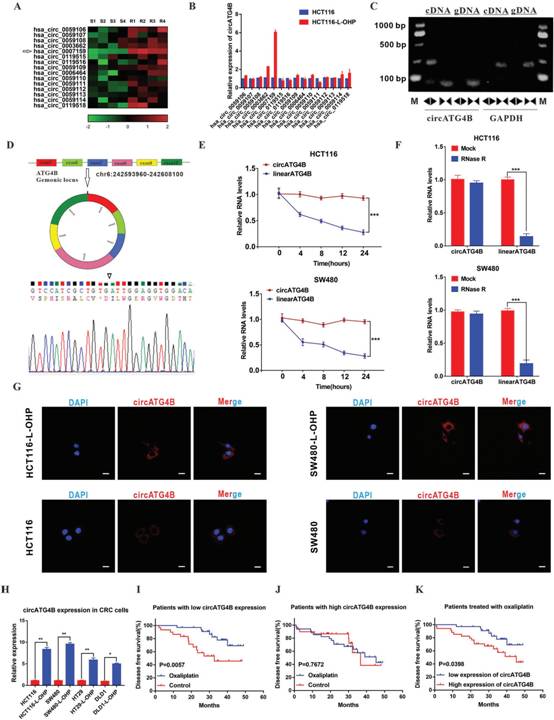
图1 circATG4B在奥沙利铂相关CRC细胞过表达
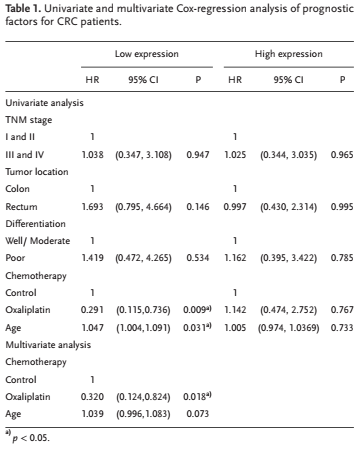
表1
2、外泌体转移的circATG4B诱导奥沙利铂耐药
作者猜想circATG4B可能从奥沙利铂耐药CRC细胞通过外泌体转移到奥沙利铂敏感细胞。为证明这个猜想,作者从耐奥沙利铂CRC细胞上清中分离出外泌体,经电镜鉴定为典型的具有双层膜的圆形颗粒(图2A)。NTA(纳米颗粒追踪分析)发现颗粒大小(图2B)。图2C展示外泌体外泌体因子CD45,CD9和Annexin的表达。qRT-PCR显示,circATG4B在奥沙利铂耐药CRC细胞系中明显上调,尤其是在HCT116-L-OHP和SW480-L-OHP细胞系衍生的外泌体中上调(图2D),与细胞表达水平一致。当CRC细胞与来自奥沙利铂耐药CRC细胞的外泌体(PKH26标记)共培养时,在受体细胞中观察到大量外泌体(红色),表明CRC细胞具有较高的外泌体摄取效率(图2E)。在与分离的外泌体或PBS在母本细胞中孵育后,作者发现circATG4B由于与用si-NC或不使用si-NC处理的奥沙利铂耐药细胞的外泌体共培养而显著上调,当外泌体的circATG4B被siRNA击杀后,这一现象被逆转(图2F)。
假定外泌体circATG4B来源于奥沙利铂耐药细胞,作者进一步研究其对化疗耐药的影响。作者的结果展示与exo-si-NC相比,共孵育exo-si-circATG4B增加CRC细胞中奥沙利铂对小鼠细胞凋亡的抑制率和诱导率(图2G-H)。为探索体内外泌体circATG4B的作用,采用皮下注射HCT116细胞建立小鼠异种移植模型。每4天测量一次肿瘤的大小,16天后处死所有的小鼠(图2I)。exo-si- NC处理的肿瘤的生长率和肿瘤重量均高于外源性exo-si-circATG4B或PBS处理的肿瘤(图2J-L)。这表明CRC中外泌体circATG4B对奥沙利铂的敏感性降低。以上结果说明外泌体转移的circATG4B诱导奥沙利铂耐药。
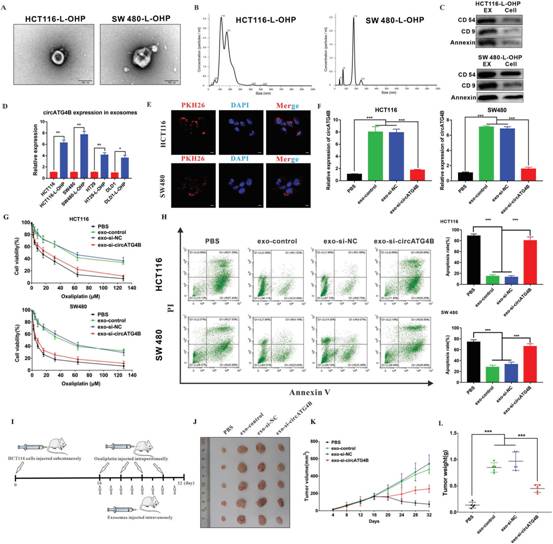
图2外泌体转移的circATG4B诱导奥沙利铂耐药
3、外泌体CircATG4B提高奥沙利铂抗药过程的活性
自噬在化疗耐药中起着重要的作用,因此作者测量抗奥沙利铂细胞和亲代细胞的自噬水平。值得注意的是,在奥沙利铂耐药细胞中观察到LC3B-II/I的比例高于相应的亲本细胞(图3)。为确定自噬是否对奥沙利铂耐药至关重要,作者用雷帕霉素(RAPA,自噬诱导物)处理CRC细胞,发现RAPA治疗诱发药物耐药(图3B)。相反,作者发现3-MA(甲基腺嘌呤),一种常见的自噬抑制剂,增加耐药CRC细胞对奥沙利铂的敏感性(图3C),进一步表明自噬在奥沙利铂耐药中起重要作用。此外,作者发现用外对照处理的CRC细胞比用PBS处理的细胞表现出更高的耐药性,并且这种化学耐药性在用PBS处理后大大逆转(图3D),表明外泌体可能通过调节自噬,促进从药物敏感到耐药的转变。转染circATG4B过表达质粒的CRC细胞化疗耐药性增加。然而,3-MA处理逆转这种效应(图3E ),表明circATG4B可以通过自噬诱导化疗耐药。此外,作者探究外泌体circATG4B在自噬过程中的作用。用奥沙利铂耐药的CRC细胞分泌的多种外泌体处理后,在受体细胞系HCT116和SW480中进行一系列实验。免疫荧光(IF)染色结果显示,exo-si-NC预处理的CRC细胞中自噬小体形成显著增加,而circATG4B水平降低的外泌体预处理的CRC细胞中绿色斑点数量减少(图3F)。此外,TEM分析显示,exo-si-NC预处理后自噬体数量增加,而exo-sio-circATG4B预处理后自噬体数量明显减少(图3G)。此外,与PBS处理相比,转染si - NC的奥沙利铂耐药结直肠癌细胞分泌的外泌体处理显著促进LC3B - I到II的转化,而当外泌体circATG4B被敲低时,LC3B - II积累被抑制(图3H)。此外,在前期建立的异种移植小鼠模型中IHC结果显示,与exo-si-NC组相比,exo-si-circATG4B处理的CRC细胞中p62的表达水平显著升高,LC3B和Ki67(细胞增殖的标志物)的表达水平降低(图3I),进一步证实外泌体circATG4B通过调节自噬诱导奥沙利铂耐药。
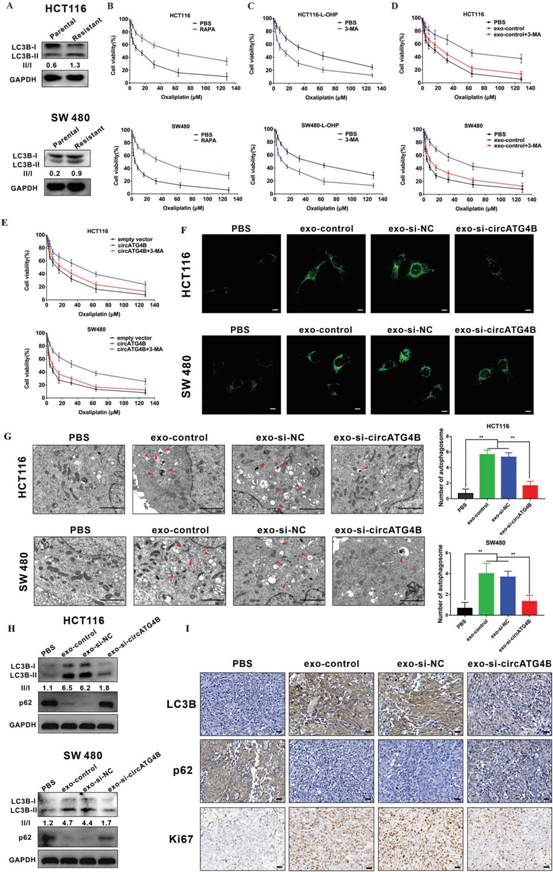
图3外泌体circATG4B促进自噬水平
4、CircATG4B编码一种新的222氨基酸(aa)蛋白,CircATG4B-222a
RIP结果显示circATG4B与AGO2不相关(图4A),提示circATG4B可能通过不同的机制行使其功能。查阅circ RNA Db中的注释,作者发现circATG4B有一个669 nt的开放阅读框(ORF),具有编码222个氨基酸蛋白的潜力(图4B)。在circATG4B的ORF中,circRNA序列中串联的' AUG '密码子可以启动新蛋白的翻译,而终止密码子' UAG '可以终止翻译。包含有33个特异性氨基酸的新序列命名为' circATG4B-222aa '(图4C)。
由于circRNA没有5′- cap序列,可以启动蛋白质翻译,因此需要一个内部核糖体进入位点(IRES)。作者在ORF中发现一个IRES,并通过双荧光素酶实验验证circATG4B中IRES的活性(图4D-E)。为确认circATG4B - 222aa的存在,研究构建4个带有不同flag标签的载体,并将其克隆到CMV诱导表达载体中(图4F)。在转染circATG4B - flag载体或circATG4B - flag - mut载体的CRC细胞中,circATG4B的表达明显上调。与转染空载体相比,转染circATG4B - 222aa载体并未明显改变circATG4B的表达(图4G)。这4种载体均不影响线性ATG4B mRNA水平。此外,ATG4B的表达不受4种载体的影响(图4H)。最后,通过SDS - PAGE分离转染circATG4B和空载体的HEK - 293T细胞总蛋白,切取大小约为24 kD的蛋白条带进行LC - MS / MS分析,成功鉴定出circATG4B剪接连接处形成的独特肽段序列,表明circATG4B能够编码一种新的蛋白(图4I)。此外,circATG4B - 222aa在化疗耐药的CRC细胞系中表达明显升高(图4J)。将带有鞭毛的circATG4B - 222aa转染至HCT116细胞后,使用抗鞭毛抗体进行免疫荧光染色以鉴定circATG4B-222aa的细胞质定位(图4K)。最后,circATG4B - 222aa表达与接受奥沙利铂治疗的CRC患者的不良预后呈正相关,表明circATG4B - 222aa可能是奥沙利铂耐药的预后标志物(图4L)。
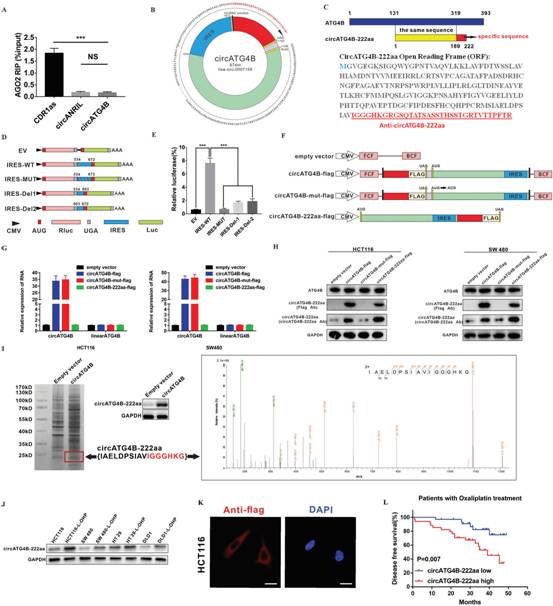
图4 circATG4B编码能力的评价
5、CircATG4B-222aa而非CircATG4B增加体内CRC细胞自噬并诱导奥沙利铂耐药
为探究circATG4B - 222aa的生物学功能,将上述4种带不同flag标签的载体转染CRC细胞系。转染circATG4B或circATG4B - 222aa过表达载体后,LC3B的点状聚集数量、自噬体形成和LC3B - I / II的转换均显著增加(图5A-C)。而转染circATG4B - mut载体的CRC细胞无明显变化,推测其无法启动circATG4B - 222aa的翻译。这些结果表明,仅过表达circATG4B - 222aa可增加自噬水平。有趣的是,过表达circATG4B - 222aa降低奥沙利铂敏感性和奥沙利铂诱导的细胞凋亡。而过表达突变体circATG4B对这些现象无明显影响(图5D-E)。为进一步探讨circATG4B - 222aa在体内的作用,通过皮下注射稳定转染不同circATG4B载体的HCT116细胞建立异种移植小鼠模型。每4 d测量一次肿瘤的大小,circATG4B和circATG4B - 222aa组的生长速度和肿瘤重量均大于vector对照组和circATG4B - mut组(图5F-H)。检测裸鼠移植瘤中LC3B、p62和Ki67的表达。IHC结果显示,与对照组和circATG4B - mut组相比,circATG4B和circATG4B - 222aa组中LC3B和Ki67的表达水平显著升高,p62的表达水平显著降低(图5I)。总之,这些结果表明circATG4B-222aa而不是circATG4B增加CRC细胞的自噬并诱导奥沙利铂耐药。
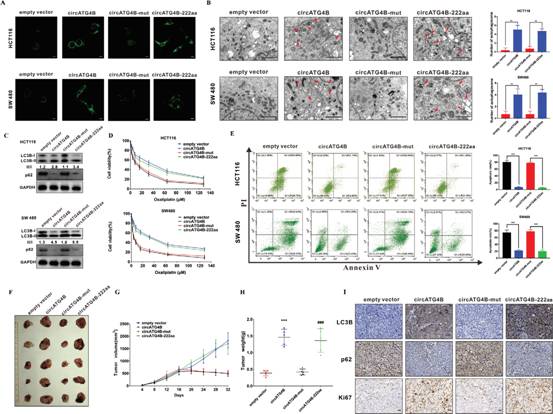
图5 CircATG4B-222aa而非CircATG4B增加体内CRC细胞自噬并诱导奥沙利铂耐药
6、CircATG4B-222aa防止ATG4B的影响TMED10介导的抑制
为探索circATG4B - 222aa在自噬中的潜在作用机制,将带有鞭毛的circATG4B - 222aa质粒转染至HEK - 293T细胞中,免疫共沉淀和质谱分析检测circATG4B - 222aa潜在的相互作用蛋白。作者对差异表达蛋白进行鉴定(图6A),发现在识别蛋白的排序列表中丰度最高的蛋白为TMED10(图6B)。因此,推测TMED10是circATG4B - 222aa的潜在靶点。此外,进一步的实验证实circATG4B - 222aa在CRC细胞中确实与TMED10存在相互作用(图6C)。在HCT116细胞中转染带有flag标签的circATG4B - 222aa,免疫荧光染色也表明circATG4B - 222aa与TMED10存在共定位(图6D)。
为探究TMED10与circATG4B - 222aa相互作用的结构域,作者构建一系列带有GFP标签的TMED10缺失突变体(图6E)。TMED10的LD - only突变体与circATG4B - 222aa不结合,表明TMED10的TD和CD都是TMED10与circATG4B - 222aa相互作用所必需的(图6F)。通过对circATG4B - 222aa的带有flag标签的截短突变体进行Co - IP分析,作者也鉴定circATG4B - 222aa参与TMED10 - circATG4B - 222aa相互作用的区域(图6G)。circATG4B-222aa ( aa1 - 111)和circATG4B - 222aa ( aa112 ~ 222)的截短体均可被TMED10拉下(图6H),表明全长circATG4B - 222aa与TMED10存在相互作用。
在进一步的研究中,作者发现circATG4B - 222aa的表达增加LC3B - I / II的转换,但两个截短突变体均不能(图6I),表明全长circATG4B - 222aa负责自噬过程。Co - IP结果表明,过表达circATG4B - 222aa削弱TMED10与ATG4B的相互作用(图6J),表明circATG4B - 222aa导致ATG4B与TMED10解离。作者进一步在CRC细胞中验证TMED10与circATG4B - 222aa的相互作用。在CRC细胞中,增加circATG4B - 222aa水平通过激活ATG4B增强GLUC连接的LC3的切割(图6K)。这些结果表明circATG4B - 222aa可能作为TMED10的诱饵,逃避TMED10诱导的ATG4B抑制。
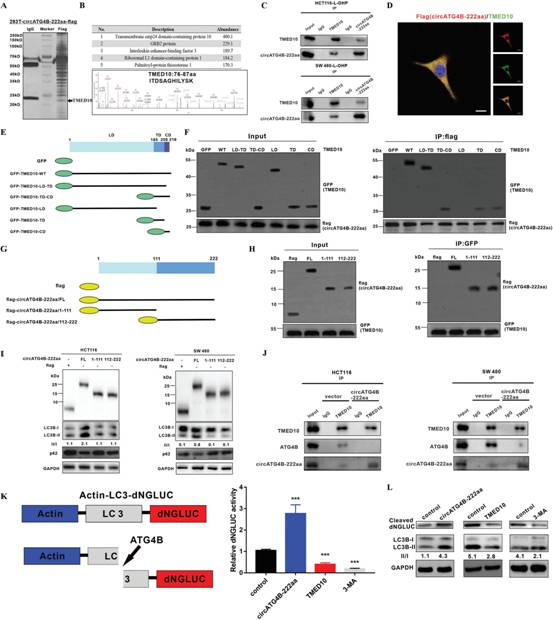
图6 CircATG4B-222aa防止ATG4B的影响TMED 10介导的抑制
7、在奥沙利铂耐药的CRC细胞中,CircATG4B – 222aa逆转TMED10诱导的化疗敏感性
随后,作者评估circATG4B - 222aa与TMED10的相互作用在奥沙利铂耐药中的功能。circATG4B - 222aa逆转TMED10诱导的CRC耐药细胞凋亡和化疗敏感性的增加(图7A-B)。为进一步研究circATG4B - 222aa与TMED10在体内的功能联系,将稳定转染不同质粒的耐药结直肠癌细胞移植瘤小鼠于第16天给予奥沙利铂治疗。过表达TMED10细胞组的肿瘤生长和重量均显著下降,而过表达circATG4B - 222aa逆转这种抑癌作用(图7C-E)。这些结果表明circATG4B - 222aa可以通过与TMED10相互作用并增加自噬活性来诱导奥沙利铂耐药(图7F)。
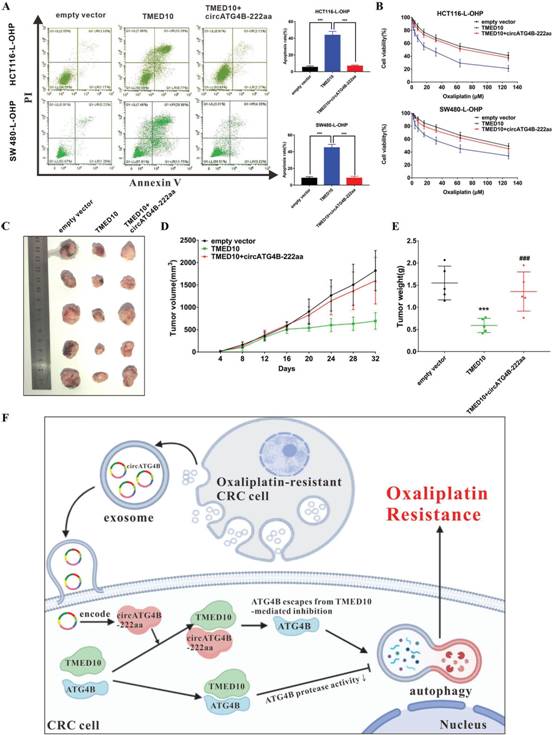
图7在奥沙利铂耐药的CRC细胞中,Circatg4B - 222Aa逆转Tmed10诱导的化疗敏感性
结论:
综上所述,研究发现奥沙利铂耐药的CRC细胞来源的上调的外泌体circATG4B可以转移到受体细胞中,从而在受体细胞中诱导奥沙利铂耐药。此外,circATG4B编码一个新的功能蛋白(circATG4B-222aa)。circATG4B-222aa在体内外均可促进CRC细胞自噬并诱导奥沙利铂耐药,但circATG4B本身并不促进自噬。此外,circATG4B - 222aa与TMED10存在竞争性相互作用,并作为诱饵阻止TMED10与ATG4B结合,导致自噬增加并诱导耐药。总之,本研究证明circRNA在CRC耐药获得中的新机制。新型circATG4B - 222aa是重要的生物标志物,可能作为奥沙利铂耐药CRC的潜在治疗靶点。
参考文献
Pan Z, Zheng J, Zhang J, Lin J, Lai J, Lyu Z, et al. (2022) A Novel Protein Encoded by Exosomal CircATG4B Induces Oxaliplatin Resistance in Colorectal Cancer by Promoting Autophagy. AdvSci (Weinh);9(35):e2204513. doi: 10.1002/advs.202204513.






