阻断长链非编码RNA HOTAIR信号轴可改善化疗诱导的膀胱癌恶病质
癌症恶病质被定义为与癌症进展相关的复杂代谢紊乱,其特征是体重减轻和骨骼肌萎缩伴或不伴脂肪量减少。值得注意的是,大约三分之一的癌症相关死亡是由恶病质而不是肿瘤负担造成的。恶病质对患者的生活质量和身体功能产生负面影响,并与预后和生存率低有关。虽然在了解恶病质的病理生理学方面取得了很大进展,但目前尚无特定的治疗方法或干预措施。该研究发表于《Journal of Biomedical Science》,IF: 12.771。
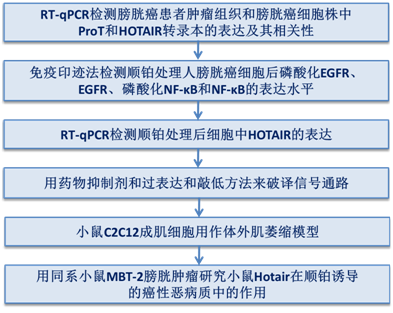
技术路线:
主要研究结果:
1. ProT和HOTAIR在膀胱肿瘤中的表达升高,并显示出正相关
为了研究HOTAIR及其潜在的上游EGFR-ProT轴对顺铂诱导的膀胱癌恶病质的贡献,我们首先询问了HOTAIR,ProT和EGFR是否在临床膀胱肿瘤组织中过表达。我们通过RT-qPCR检查了它们在六对膀胱肿瘤组织和相应相邻正常组织中的表达水平。ProT(图1a)和HOTAIR(图1b)在肿瘤组织中的表达明显高于正常组织对应物。然而,与正常组织相比,膀胱肿瘤中EGFR的表达没有显著变化(图1c)。我们进一步证实了它们在19例膀胱癌患者的肿瘤组织中的关联。图1d表明ProT表达与HOTAIR表达呈高度正相关(r = 0.8939,p < 0.0001)。此外,我们分析了TCGA膀胱癌队列(n=408)的临床数。我们使用肿瘤免疫估计资源(TIMER,https://cistrome.shinyapps.io/timer)网络服务器的相关模块检查了膀胱肿瘤样本中ProT(即PTMA基因)、HOTAIR和EGFR转录本之间的相互相关性。图1e表明ProT和HOTAIR的表达水平呈正相关(r = 0.108,p = 0.029)。我们还检查了ProT和HOTAIR在不同尿路上皮癌细胞系中的表达水平,包括6种膀胱癌、1种前列腺癌(PC3)、1种肾癌(BFTC909)和1种正常尿路上皮(SV-HUC-1)细胞系。我们的结果表明,细胞系在ProT(图1f)和HOTAIR(图1g)的表达水平方面呈异质性。在检查的膀胱癌细胞系中,TCCSUP细胞相对表达最高水平,而J82和HT1197细胞表达最低水平,ProT和HOTAIR。此外,正常的尿路上皮SV-HUC-1细胞表达相对低水平的ProT,特别是HOTAIR。与从临床肿瘤样本中获得的数据一致,ProT和HOTAIR在尿路上皮癌细胞系中的表达水平也呈正相关(r = 0.7661,p = 0.0266)(图1h)。总之,这些结果表明,ProT和HOTAIR的表达在临床膀胱肿瘤样本和癌细胞系中上调并呈正相关。
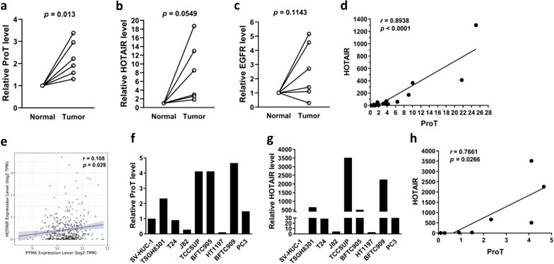
图1 ProT和HOTAIR在膀胱肿瘤中的表达升高,并显示出正相关
2. 顺铂治疗增加EGFR和NF-κB活化,以及J82细胞中的ProT和HOTAIR表达,并且这些作用被EGFR抑制剂或ProT敲低所消除
鉴于EGFR在膀胱肿瘤中没有显著过度表达(图1c)并且顺铂可以在过表达受体的各种细胞类型中诱导EGFR活化,我们考虑了顺铂诱导EGFR活化的可能性,导致所提出的ProT-NF-κB-HOTAIR信号轴上调,从而导致恶病质相关的促炎细胞因子产生增加。我们用顺铂处理内源性表达相对低水平的ProT和HOTAIR的J82细胞,并在磷酸化方面检测EGFR活化。NF-κB的活化伴随着其亚基p65(在Ser 536处)的磷酸化,活化的NF-κB反过来又易位到细胞核中以激活多种促炎基因表达。因此,我们检查了顺铂处理的J82细胞中ProT和HOTAIR的表达以及NF-κB磷酸化。免疫印迹分析显示,顺铂处理以剂量依赖性方式增加了磷酸化-EGFR(Tyr1068)、ProT和磷酸化-NF-κB p65(Ser536)的表达(图2a)。为了确认EGFR的激活作用于ProT-NF-κB-HOTAIR信号轴的上游,使用两种EGFR激酶抑制剂吉非替尼和厄洛替尼在存在或不存在顺铂的情况下治疗J82细胞。我们的结果表明,用吉非替尼或厄洛替尼治疗逆转了顺铂诱导的ProT和磷酸化-NF-κB p65蛋白的上调(图2b),以及HOTAIR的表达(图2c)。此外,我们使用慢病毒介导的ProT特异性shRNA递送(shProT-17和-19)以及J82细胞中的对照shRNA(shLuc)来进一步鉴定ProT作为NF-κB-HOTAIR信号轴的上游调节因子。免疫印迹分析显示,顺铂诱导的NF-κB磷酸化在ProT敲低J82细胞中被消除(图2d)。值得注意的是,顺铂诱导的HOTAIR上调在ProT敲低细胞中也被废除(图2e)。综上所述,这些结果表明顺铂可以上调ProT和HOTAIR的表达,并且EGFR和NF-κB的激活参与膀胱癌细胞的这一途径。此外,顺铂处理通过EGFR-ProT轴上调HOTAIR。
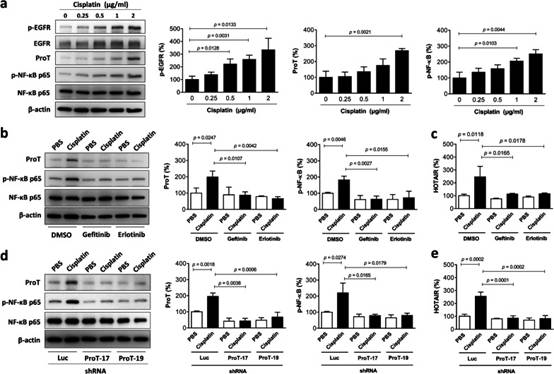
图2 顺铂治疗通过膀胱癌细胞中的EGFR-ProT轴上调HOTAIR
3. ProT的过表达增加,而ProT的敲低降低,膀胱癌细胞中的HOTAIR表达和HOTAIR上调通过NF-κB抑制剂治疗而降低
已经证明ProT敲低J82细胞没有诱导NF-κB磷酸化(图2d)和HOTAIR上调(图2e)在顺铂处理后,我们进一步在J82细胞(J82/ProT)中过表达ProT,以检查其对NF-κB和HOTAIR表达的影响。正如预期的那样,J82/ProT细胞表达更高水平的ProT mRNA(图3a)和蛋白质(图3b),而用GFP和亲本(模拟)细胞转导的细胞中的ProT表达处于相似水平。根据ProT敲低J82细胞的结果(图2d),在J82细胞中,ProT的过表达增加了NF-κB磷酸化(图3b)和HOTAIR表达(图3c)。鉴于ProT可以诱导NF-κB活化,并且NF-κB可以在顺铂诱导的DNA损伤过程中上调HOTAIR表达,我们进一步使用NF-κB抑制剂来研究ProT对HOTAIR表达的影响是否需要NF-κB信号传导。如图3c所示,JSH-23抑制NF-κB p65的核易位,从而消除NF-κB信号传导和TPCA-1,一种抑制NF-κB信号通路活化的激酶IKKβ抑制剂,可以逆转ProT介导的J82细胞中HOTAIR表达的上调。值得注意的是,用这两种NF-κB抑制剂治疗不影响ProT表达,表明ProT作用于NF-κB信号通路的上游(图3d)。为了进一步验证ProT通过NF-κB信号上调HOTAIR表达,我们通过慢病毒介导的ProT特异性shRNA递送沉默了ProT高表达TCCSUP膀胱癌细胞中的ProT表达,这被RT-qPCR证实(图3e)和免疫印迹(图3f)。值得注意的是,敲低ProT表达降低了NF-κB p65磷酸化(图3f)和HOTAIR表达(图3g)在 TCCSUP 细胞中。此外,用NF-κB抑制剂处理也降低了TCCSUP细胞中的HOTAIR表达(图3h),这与ProT敲低的效果相似(图3g)。总的来说,使用ProT过表达和敲低方法,我们表明抑制NF-κB活化消除了ProT诱导的HOTAIR表达,表明ProT通过激活NF-κB信号通路上调HOTAIR表达。因此,根据从图2和3获得的数据,我们得出结论,顺铂诱导的HOTAIR上调是通过EGFR-ProT-NF-κB-HOTAIR信号轴介导的。
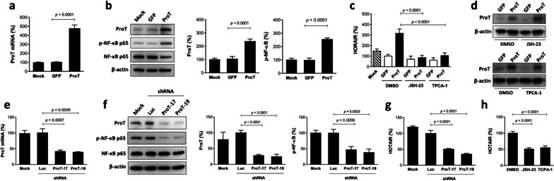
图3 ProT通过膀胱癌细胞中的NF-κB激活上调HOTAIR
4. HOTAIR的过表达增强J82细胞中的细胞增殖和促炎细胞因子表达
由于HOTAIR可能在炎症和免疫反应中发挥作用,我们进一步研究了HOTAIR在表达导致癌症恶病质的促炎细胞因子中的作用。我们生成了HOTAIR过表达J82(J82/HOTAIR-2和-5)细胞及其载体对照(J82/GFP)细胞,并比较了它们的增殖速率和细胞因子表达水平。图4a证实HOTAIR在J82/HOTAIR细胞中的表达水平远高于J82/GFP细胞。J82/HOTAIR细胞的增殖速度明显快于J82/GFP细胞或亲本细胞(图4b)。此外,J82/HOTAIR细胞显著表达更高水平的IL-6(图4c)、TNF-α(图4d)和IL-1β(图4e)比J82/GFP细胞。鉴于顺铂上调HOTAIR表达和HOTAIR增强J82细胞中的促炎细胞因子表达,我们接下来确定顺铂治疗是否上调下游促炎细胞因子,以及EGFR抑制剂是否可以逆转这种上调。用吉非替尼或厄洛替尼治疗消除了顺铂诱导的IL-6上调(图4f)、TNF-α(图4g)和IL-1β(图4h)在J82细胞中的表达。由于ProT充当NF-κB/HOTAIR轴的上游调节器(图3),我们验证了J82/ProT细胞表达更高水平的IL-6(图4i)、TNF-α(图4j)和IL-1β(图4k)与载体对照J82/GFP细胞相比。综上所述,这些结果表明,在人膀胱癌细胞中强制表达HOTAIR或ProT可增强IL-6,TNF-α和IL-1β的表达。此外,顺铂治疗后人膀胱癌细胞中促炎细胞因子的表达进一步升高,EGFR抑制剂可消除其作用。
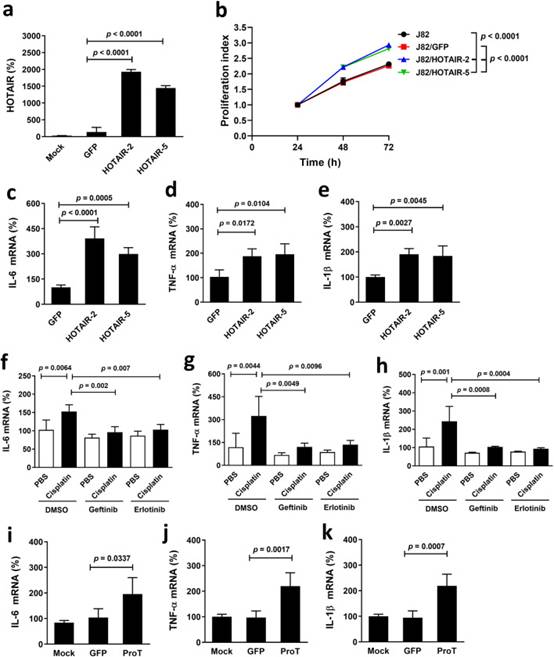
图4 HOTAIR过表达、顺铂治疗和ProT过表达上调人J82膀胱癌细胞中的促炎细胞因子表达
5. 敲低Hotair可降低MBT-2细胞中的细胞增殖和促炎细胞因子表达
在证明了人HOTAIR对人膀胱癌细胞中恶病质相关促炎细胞因子表达的影响后,我们试图确认小鼠Hotair在小鼠膀胱癌细胞中是否具有与人HOTAIR相似的效果。由于质粒构建体对MBT-2细胞进行瞬时转染没有达到较高的转染效率,因此我们使用慢病毒转导介导HotairCRISPRi基因沉默。选择转导的细胞并在嘌呤霉素处理下扩增,以获得MBT-2/CSi-HOTAIR和载体对照MBT-2/CSi-GFP细胞。慢病毒转导和嘌呤霉素选择后,载体对照和亲本细胞之间的一些生物学特性可能不同。因此,将我们的敲低细胞与它们的载体对照细胞而不是亲本细胞进行比较。我们测试了CRISPRi介导的Hotair表达敲低是否可以降低小鼠MBT-2膀胱癌细胞中下游促炎细胞因子的表达,这些细胞因子表达这种lncRNA水平升高。图5a显示了MBT-2/CSi-Hotair-F4和-F6电池与MBT-2/CSi-GFP电池相比的HOTAIR敲低确认。HOTAIR敲低细胞中的细胞增殖速度慢于GFP敲低细胞或亲本细胞(图5b)。此外,HOTAIR敲低MBT-2细胞表达较低水平的IL-6(图5c)、TNF-α(图5d)和IL-1β(图5e)与GFP敲低细胞相比,尽管IL-1β的差异并不显著(图5c,d,e)。值得注意的是,顺铂治疗显著促进了这些细胞因子在GFP敲低细胞中的表达,而不是HOTAIR敲低细胞(图5c,d,e),表明Hotair的敲低消除了顺铂诱导的小鼠膀胱癌细胞中IL-6,TNF-α和IL-1β的上调。总的来说,这些结果表明,敲低Hotair可降低细胞增殖和促炎细胞因子表达,并减少顺铂诱导的MBT-2细胞中促炎细胞因子的上调。此外,我们的研究结果表明,小鼠Hotair在诱导恶病质相关促炎细胞因子表达方面具有与人类HOTAIR相似的生物学效应。
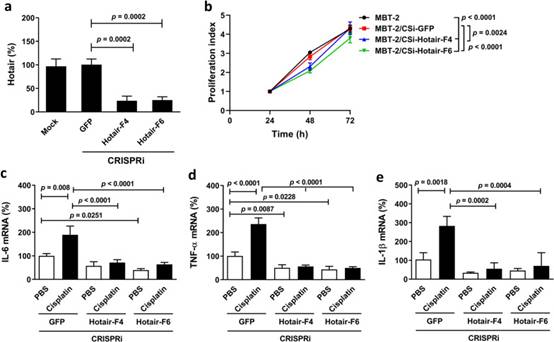
图5 敲低Hotair可减少小鼠MBT-2膀胱癌细胞中的细胞增殖并下调促炎细胞因子表达
6. HOTAIR与顺铂诱导的膀胱癌骨骼肌萎缩呈正相关
鉴于癌症恶病质最常见的体外肌肉模型是用从培养的癌细胞中收集的CM治疗小鼠C2C12肌管,并且IL-6和TNF-α与癌症恶病质有关,我们接下来研究了HOTAIR表达与骨骼肌萎缩的相关性。在存在或不存在顺铂的情况下,用J82/HOTAIR,J82/GFP或亲本J82细胞的CM处理C2C12肌管,并通过测量肌管直径评估肌肉萎缩。重组小鼠TNF-α作为诱导C2C12肌管萎缩的阳性对照。鉴于恶病质患者血浆中所含的促炎细胞因子可以在C2C12细胞中诱导NF-κB活化,并且人TNF-α和IL-6对人和鼠细胞均有活性,我们测试了这两种人细胞因子是否对C2C12肌管有影响。我们的结果证实,人TNF-α和IL-6能够诱导小鼠肌管萎缩(图6a,b),表明体外小鼠C2C12肌管模型可用于评估人类癌细胞诱导的癌症恶病质。与从载体对照细胞暴露于CM的C2C12肌管的平均直径相比,暴露于J82/HOTAIR细胞的CM的平均直径较低(图6c,d)。此外,顺铂处理进一步降低了暴露于J82细胞来源CM的C2C12肌管的平均直径(图6c,d)。除了检查HOTAIR过表达后人J82细胞的CM外,我们还评估了Hotair的CRISPRi敲低后小鼠MBT-2细胞来源的CM对C2C12肌管萎缩的影响。与从J82细胞获得的数据一致(图6c,d),与培养基对照相比,用GFP敲低MBT-2细胞的CM处理显著降低了C2C12肌管的平均直径(图6e,f)。值得注意的是,Hotair的敲低将肌管直径恢复到暴露于培养基对照的对照细胞直径的相似水平。此外,顺铂治疗导致每次治疗中肌管直径的进一步减小。然而,在MBT-2细胞中敲低Hotair减轻了暴露于顺铂的MBT-2细胞CM诱导的肌管直径减小。C2C12肌管测定的结果表明,人和小鼠膀胱癌细胞产生促进骨骼肌萎缩的因子,特别是在顺铂存在下。肌肉特异性E3泛素连接酶MuRF-1、UBR2(也称为E3α-II)和趾激素-1在介导癌症恶病质中肌肉蛋白的降解中起关键作用。因此,我们进一步检查了这些E3泛素连接酶在用MBT-2细胞或其衍生物的CM处理的C2C12肌管中的表达。免疫印迹分析显示,在用MBT-2或MBT-2/CSi-GFP细胞CM处理的细胞中,MuRF-1、UBR2和atrogin-1的表达增加。值得注意的是,Hotair的敲低减轻了MBT-2细胞CM诱导的MuRF-1,UBR2和atrogin-1的上调(图6g,h)。综上所述,使用C2C12肌管测定,我们证明HOTAIR在顺铂诱导的骨骼肌萎缩中起关键作用,这可能是通过上调萎缩相关的E3泛素连接酶介导的。
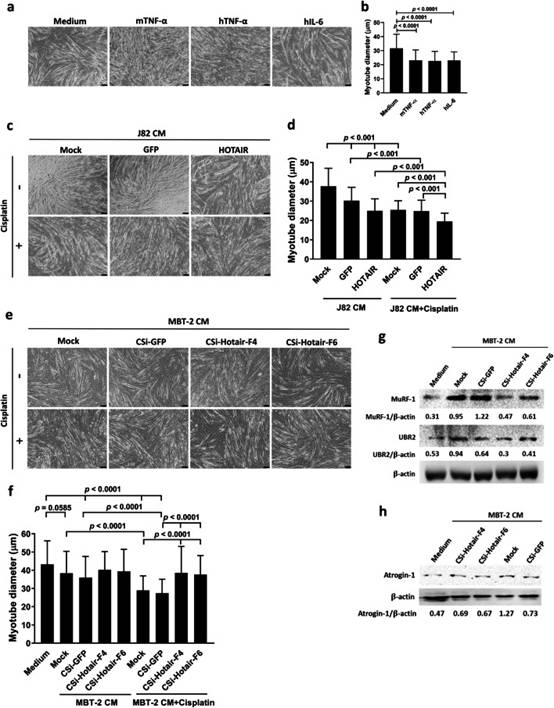
图6 HOTAIR过度表达膀胱癌细胞的CM,特别是在顺铂存在下促进肌肉萎缩
7. 在膀胱肿瘤荷载小鼠中敲低Hotair可减弱顺铂诱导的癌症恶病质
为了确认体外结果的相关性,我们使用同源MBT-2膀胱肿瘤模型来研究Hotair在小鼠肿瘤中的敲低是否可以改善接受顺铂化疗的荷瘤小鼠的体重减轻和骨骼肌萎缩。协议时间表如图7a所示。在植入MBT-2细胞的所有小鼠组中都注意到体重减轻(减去估计的肿瘤重量后)(图7b)。在实验结束时处死小鼠后计算相对体重变化(减去第0天绝对肿瘤重量/体重后的体重)。虽然携带MBT-2或MBT-2/CSi-GFP肿瘤的小鼠体重减轻超过20%,但与携带MBT-2/CSi-GFP肿瘤的小鼠相比,MBT-2肿瘤中Hotair的敲低显著改善了荷瘤小鼠的体重减轻第29天(图7c)。值得注意的是,肿瘤体积要小得多(图7d),降低血清IL-6水平(图7e)与健康小鼠相当,小腿周长更大(图7f)在MBT-2/CSi-HOTAIR小鼠中检测到,而不是在MBT-2/CSi-GFP携带小鼠中检测到。关于骨骼肌萎缩,与MBT-2/CSi-GFP细胞相比,MBT-2/CSi-Hotair小鼠的腓肠肌肌纤维横截面积明显更厚(图7g)。虽然从携带亲本MBT-2或MBT-2/CSi-GFP肿瘤的小鼠获得的肌肉组织表达升高的MuRF-1水平,但其表达在携带MBT-2/CSi-Hotair肿瘤的小鼠的肌肉组织中显著降低(图7h)。总之,这些结果表明顺铂治疗可以诱导膀胱肿瘤小鼠的恶病质。更重要的是,沉默膀胱肿瘤中Hotair表达可以改善顺铂诱导的小鼠恶病质。总之,我们的动物研究提供了证据表明HOTAIR参与顺铂诱导的膀胱癌恶病质。
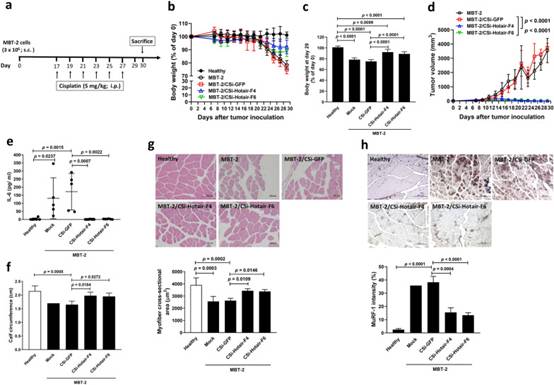
图7 敲低MBT-2膀胱荷瘤小鼠中的Hotair可减轻顺铂诱导的癌症恶病质
8. EGFR抑制剂厄洛替尼抑制肿瘤生长,但不能缓解顺铂诱导的膀胱肿瘤小鼠癌症恶病质
鉴于吉非替尼和厄洛替尼消除了顺铂诱导的膀胱癌细胞中促炎细胞因子的上调(图4f,g,h),我们接下来询问厄洛替尼治疗是否可以恢复顺铂诱导的体内恶病质。MBT-2肿瘤模型中的治疗方案如图8a所示。健康小鼠和未接受顺铂或厄洛替尼的携带MBT-2小鼠之间的体重没有显著差异(图8b)。然而,接受顺铂但不接受厄洛替尼治疗的荷瘤小鼠与接受载体(PBS)的小鼠相比体重较低。值得注意的是,厄洛替尼治疗并没有改善用顺铂治疗的荷瘤小鼠的体重减轻。此外,用顺铂治疗的荷瘤小鼠的小腿围减少,厄洛替尼治疗无法恢复(图8c)。关于肿瘤大小,顺铂和厄洛替尼联合治疗显著减少了小鼠的肿瘤体积,而顺铂或厄洛替尼的单次治疗对抑制肿瘤生长没有影响(图8d)。总之,与单次使用顺铂或厄洛替尼治疗相比,厄洛替尼治疗与顺铂联合用于膀胱荷瘤小鼠显著减小肿瘤大小。此外,我们的结果表明,顺铂治疗诱导体重减轻,厄洛替尼对缓解膀胱肿瘤小鼠体重减轻和骨骼肌萎缩没有影响。
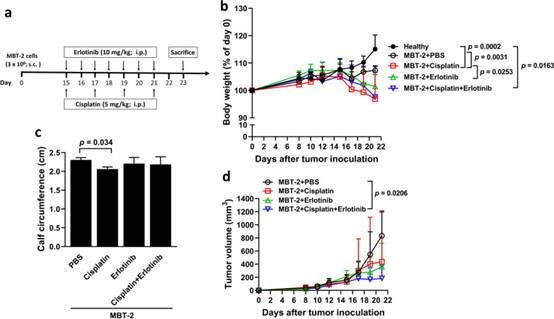
图8 厄洛替尼治疗抑制肿瘤生长,但不能缓解MBT-2膀胱肿瘤小鼠顺铂诱导的癌症恶病质
结论:
该研究证明了HOTAIR在顺铂诱导的膀胱癌恶病质中的关键作用,并将HOTAIR确定为膀胱癌和其他可能癌症恶病质的新治疗靶点。尽管其他基因或信号通路参与顺铂诱导的膀胱癌恶病质不容忽视,但EGFR-ProT-NF-κB-HOTAIR信号轴的组分代表了预防或改善顺铂诱导的膀胱癌和其他癌症恶病质的新治疗策略的靶标。
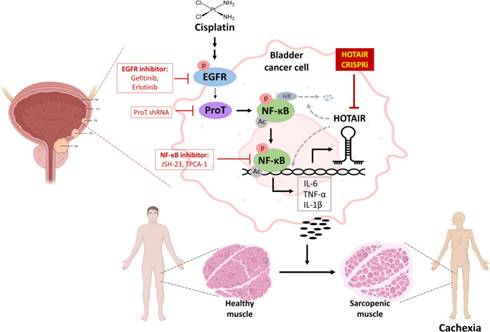
示意图:
参与顺铂诱导的癌症恶病质的EGFR / ProT / NF-κB / HOTAIR轴的示意图:
参考文献:
Hu CY, Su BH, Lee YC, Wang CT, Yang ML, Shen WT, Fu JT, Chen SY, Huang WY, Ou CH, Tsai YS, Kuo FC, Shiau AL, Shieh GS, Wu CL. Interruption of the long non-coding RNA HOTAIR signaling axis ameliorates chemotherapy-induced cachexia in bladder cancer. J Biomed Sci. 2022 Dec 6;29(1):104. doi: 10.1186/s12929-022-00887-y.






