EWSR1诱导的circNEIL3通过稳定IGF2BP3促进胶质瘤进展和外泌体介导的巨噬细胞免疫抑制极化
胶质瘤是最常见的恶性原发性脑肿瘤,具有高度免疫抑制肿瘤微环境(TME),预后差。环状RNAs (circRNA)是一种新发现的内源性非编码RNA,具有高稳定性、丰度、保持性等特点,在多种肿瘤的病理生理过程和TME重构中发挥重要作用。circNEIL3可被EWS RNA结合蛋白1(EWSR1)环化,在胶质瘤组织中上调,并与胶质瘤恶性进展呈正相关。功能上,circNEIL3在体内和体外促进胶质瘤的发生和癌变进程。机制上,circNEIL3通过阻止HECTD4介导的泛素化来稳定IGF2BP3蛋白(一种已知的致癌蛋白)。circNEIL3过表达胶质瘤细胞驱动巨噬细胞浸润到肿瘤微环境(TME)。circNEIL3被hnRNPA2B1包装成外泌体,并传递给浸润的肿瘤相关巨噬细胞(TAMs),使它们通过稳定IGF2BP3获得免疫抑制特性,进而促进胶质瘤的进展。本文揭示了circNEIL3在促进胶质瘤发生、恶性进展和巨噬细胞肿瘤促进表型极化方面发挥着显著作用,突出了circNEIL3是胶质瘤潜在的预后生物标志物和治疗靶点。本文于2022年1月发表于Molecular Cancer (IF=41.444)上。
技术路线:

主要研究结果:
(1) circNEIL3在胶质瘤组织中显著上调
为了鉴定参与胶质瘤发生和发展的潜在致癌circRNAs,我们利用RNA测序(RNA-seq)分析了39个胶质瘤组织和8个正常脑组织(NBTs)中circRNAs的表达谱。火山图显示,在GBM和LGG之间以及LGG和NBTs之间,circRNA表达存在系统性差异(图1A,B)。我们进一步分析了胶质瘤组织中差异上调的circRNAs,并鉴定出hsa_circ_0001460,这是唯一一种随着胶质瘤分级升高而上调的circRNAs(图1C)。将hsa_circ_0001460命名为circNEIL3,它是从NEIL3生成的。与NBTs相比,circNEIL3在胶质瘤组织中明显上调且其表达随着胶质瘤级别的升高而升高(图1D)。采用ROC曲线评估circNEIL3对胶质瘤分级的诊断效果,曲线下面积AUC为0.719,表明circNEIL3可以预测胶质瘤患者预后不良(图1E)。
circNEIL3后剪接在NEIL3基因的第8外显子和第9外显子之间,长度为596 nt(图1F)。使用发散引物扩增circNEIL3的后剪接结位点,并通过Sanger测序确认(图1F)。我们设计了发散型和收敛型引物来扩增circNEIL3及其线性形式。RT-qPCR产物琼脂糖凝胶电泳分析结果显示,circNEIL3只能从cDNA中扩增,而其线性形式可以从cDNA和gDNA中扩增(图1G)。我们通过RNase R和放线菌素D的处理,证实circNEIL3比NEIL3更稳定(图1H,I)。circRNAs的功能主要与其在细胞内的定位有关。然后我们进行了核细胞质分离实验和FISH分析。circNEIL3主要定位于细胞质(图1J,K)。这些结果表明,circNEIL3在胶质瘤组织中显著上调,且在GBM中表达量最高,提示其参与了胶质瘤的发生和恶性进展。

图1:circRNA在胶质瘤中的表达谱及circNEIL3的鉴定
(2)circNEIL3在体外和体内均促进胶质瘤的发生
为了研究circNEIL3在胶质瘤进展中的潜在生物学作用,我们根据转录组测序数据,对与circNEIL3表达显著正相关的基因进行KEGG富集分析。为了探索这些不同circNEIL3表达样本之间的生物学行为,我们使用单样本GSEA (ssGSEA)算法来估计每个样本的通路富集分数。
由于circNEIL3可能参与细胞增殖、侵袭和迁移,我们进一步研究了circNEIL3在细胞行为中的功能。我们证实下调circNEIL3显著抑制细胞增殖、迁移和侵袭。过表达circNEIL3在体外显著促进了这些细胞行为(图2A-D)。体内实验表明,下调circNEIL3可显著抑制肿瘤生长和侵袭性,延长荷瘤小鼠的生存期,而过表达circNEIL3则具有相反的作用(图2E,F)。切除的肿瘤切片免疫组化(IHC)显示,circNEIL3敲除的肿瘤组织中Ki67(一种增殖标志物)和CD44(一种侵袭标志物)的表达低于载体组,而circNEIL3过表达则相反(图2G)。这些数据表明circNEIL3在调节肿瘤发生和胶质瘤进展中具有重要的功能。
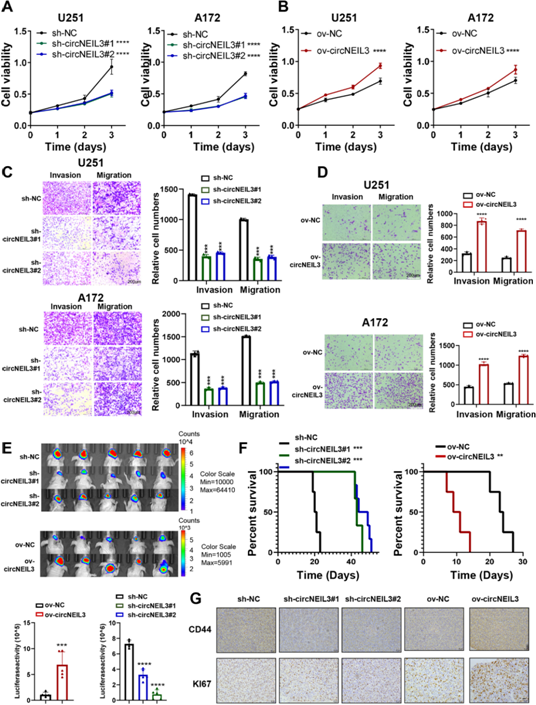
图2:circNEIL3在体内外促进GBM细胞增殖和转移
(3)EWSR1在胶质瘤中促进circNEIL3的生物发生
circRNAs的环化机制是由RNA结合蛋白(RBPs)结合到pre-mRNA的上游和下游区域来调控的。我们利用CircInteractome数据库预测了EWSR1在circNEIL3的上游和下游区域的三个结合位点,分别为序列1、序列2和序列3(图3A)。EWSR1的表达水平随着胶质瘤的分级而升高,高表达的患者预后比低表达的患者差(图3B)。我们验证了敲除EWSR1可以抑制GBM细胞的增殖、侵袭和迁移(图3C,D)。在我们自己的数据库中,circNEIL3与EWSR1正相关(图3E),并且在EWSR下调的U251和A172细胞中circNEIL3的表达明显死亡(图3F)。最近的一项研究表明,EWSR1在缺氧环境中可能更活跃。因此,我们将U251和A172细胞置于缺氧条件下0 h、6 h、12 h和24 h, EWSR1和circNEIL3的表达随着暴露时间的增加而上调(图3G,H)。RIP-qPCR检测证实EWSR1可与NEIL3 pre-mRNA序列1和序列3结合,且在缺氧条件下结合能力明显上调(图3I)。为了进一步证实观察到的EWSR1介导的表型是由circNEIL3表达失调促进的,我们进行了功能挽救实验。如图3J-L所示,EWSR1过表达可引起U251和A172细胞增殖、迁移和侵袭的增加,而下调circNEIL3可逆转这一趋势。这些数据表明,circNEIL3可以被EWSR1环化,并且这个过程在缺氧条件下更活跃。
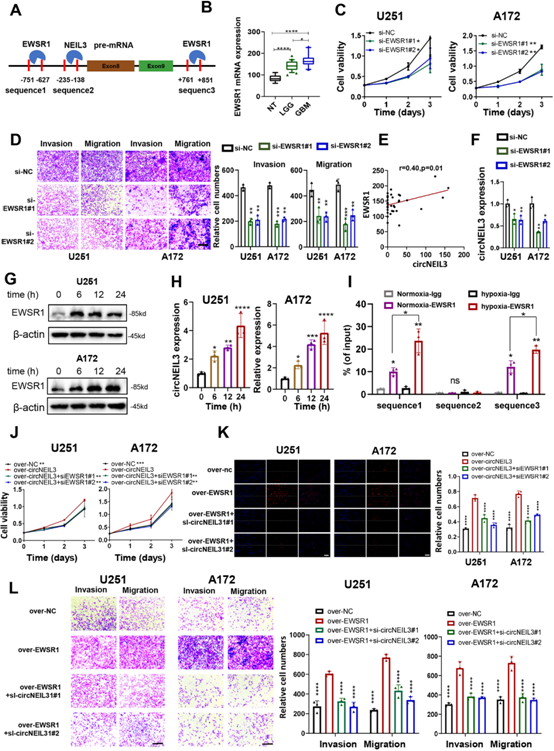
图3:EWSR1促进circNEIL3的生物发生
(4)circNEIL3与IGF2BP3物理相互作用,抑制泛素/蛋白酶体介导的IGF2BP3降解
为了探索circNEIL3诱导GBM细胞进展的分子机制,我们进行了RNA下拉实验和质谱实验探索与circNEIL3结合的潜在蛋白质。circNEIL3与IGF2BP3蛋白结合(图4A)。RNA下拉和RIP-qPCR证实了circNEIL3与IGF2BP3之间的相互作用(图4B,C)。RNA FISH-免疫荧光(FISH-IF)分析表明circNEIL3与IGF2BP3在细胞质中共定位(图4D)。我们建立了6个FLAG标记载体,并通过Western Blot检测哪些结构域与circNEIL3相互作用(图4E,F)。RIP-qPCR显示,circNEIL3主要结合在KH3-4区域,这表明KH3-4双结构域负责招募circNEIL3(图4G)。然后我们在circNEIL3中寻找IGF2BP3募集所必需的基序。我们设计了三个突变位点,IGF2BP3与circNEIL3的第三个位点结合(图4H)。这些结果表明circNEIL3在细胞质中与IGF2BP3发生物理相互作用。
circNEIL3没有显著改变IGF2BP3的mRNA水平(图4I),但显著促进了其蛋白表达及其下游靶点的表达,包括CDK4/6、CD44和c-MYC(图4J),这些靶点参与细胞增殖、侵袭和迁移的生物学功能。circNEIL3过表达增强了IGF2BP3蛋白的表达水平,延长了IGF2BP3的半衰期(图4K)。circNEIL3过表达降低了IGF2BP3的泛素化(图4L)。我们仅鉴定出一个位于IGF2BP3的KH3结构域的泛素化赖氨酸(K)残基(K450)(图4N)。使用uniport数据库预测IGF2BP3的K450位点在6个物种中高度保守(图4N)。我们预测了IGF2BP3的结构,并可视化K450泛素化位点(图4O)。免疫共淀(IP)显示,与WT IGF2BP3相比,K450突变显著降低了IGF2BP3的泛素化水平,并且在表达该突变体的细胞中,circNEIL3过表达导致的泛素化增强也被抑制(图4M),表明K450是IGF2BP3的主要泛素化位点。因此circNEIL3通过抑制泛素/蛋白酶体依赖性降解,增强了IGF2BP3蛋白的稳定性,从而促进胶质瘤的恶性进展。

图4:circNEIL3与IGF2BP3发生物理相互作用并抑制其泛素化
(5)circNEIL3通过阻止HECTD4介导的泛素化来稳定IGF2BP3蛋白
TRIM25在NSCLC中介导IGF2BPs的泛素化。然而目前尚无E3泛素连接酶介导胶质瘤IGF2BP3泛素化的报道。因此,我们试图鉴定E3连接酶参与胶质瘤中蛋白酶体介导的IGF2BP3降解。我们在体外验证了HECTD4可以抑制GBM细胞的增殖、侵袭和迁移(图5A,B)。我们进行了免疫荧光(IF)实验,证实IGF2BP3与HECTD4在细胞质中共定位(图5C)。在HECTD4敲低的GBM细胞中,IGF2BP3蛋白水平显著升高(图5D),而其泛素化水平明显降低(图5E),这表明在胶质瘤中,HECTD4作为E3泛素连接酶,通过泛素-蛋白酶体途径降解IGF2BP3。
对circNEIL3的质谱分析显示,circNEIL3没有与HECTD4结合,但过表达的circNEIL3可以阻断IGF2BP3与HECTD4的结合(图5F),这解释了circNEIL3如何稳定IGF2BP3。为了进一步证实circNEIL3可以抑制IGF2BP3与赫克特4的结合,我们进行了Co-IP实验,HECTD4与IGF2BP3的KH3-4结构域结合,这是circNEIL3与IGF2BP3相互作用的同一位点(图5G, 4G)。这些数据表明circNEIL3通过空间位阻阻断了IGF2BP3与HECTD4的结合,最终抑制了IGF2BP3的泛素化。总之,circNEIL3通过阻止HECTD4介导的泛素化来稳定IGF2BP3蛋白。
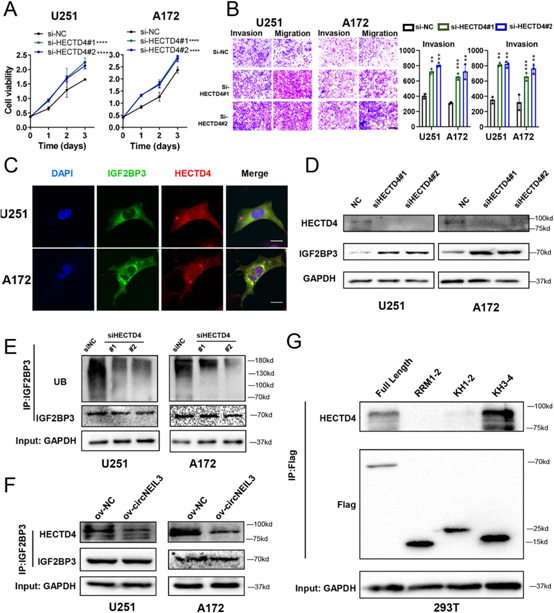
图5:circNEIL3阻断了IGF2BP3和HECTD4的结合
(6)circNEIL3促进胶质瘤巨噬细胞浸润
为了探讨circNEIL3表达不同的胶质瘤样本之间生物学行为的差异,我们根据circNEIL3的中位表达将胶质瘤样本分为高表达组和低表达组。采用Deseq2包进行差异表达分析,高表达组与circNEIL3低表达组共有801个基因存在差异表达;531个基因上调,270个基因下调。
为进一步了解circNEIL3在胶质瘤免疫表型中的确切作用,使用ESTIMATE算法评估了胶质瘤纯度、基质和免疫评分。如图6A所示,circNEIL3高表达组较circNEIL3低表达组细胞浸润TME较多,免疫和间质评分较高,肿瘤纯度较低。与低circNEIL3表达的胶质瘤相比,高circNEIL3表达的胶质瘤巨噬细胞浸润明显增加,巨噬细胞构成了胶质瘤TME中最丰富的细胞群。circNEIL3高表达胶质瘤中TAM BMDM(以下简称巨噬细胞)浸润明显增加,TAM MGs数量有所减少(图6A)。Transwell实验表明,与NC组相比,来自circNEIL3过表达的GBM细胞的条件培养基(CM)显著促进了THP1分化的巨噬细胞迁移(图6B),而来自circNEIL3低表达的GBM细胞的条件培养基(CM)显示相反的结果(图6C)。circNEIL3过表达的肿瘤细胞可以驱动巨噬细胞浸润到胶质瘤微环境中。
接下来,我们探讨了circNEIl3促进巨噬细胞募集的潜在调控机制。GSEA结果表明,与circNEIL3-low样本相比,高circNEIL3样本中YAP1信号信号基因签名高度富集(图6D)。对TCGA胶质瘤样本中IGF2BP3的评估也显示了相同的结果(图6E)。qRT-PCR验证了circNEIL3促进CCL2和LOX表达的结果(图6F),而这种由circNEIL3过表达引起的表达增强可以通过下调IGF2BP3来挽救(图6G)。circNEIL3可以增加GBM细胞中YAP1和LOX的蛋白表达(图6H)。circNEIL3过表达引起的表达增加也可以通过敲低IGF2BP3来消除(图6I)。总之,circNEIL3过表达的GBM细胞可能通过激活YAP1信号通路来驱动巨噬细胞浸润到肿瘤相关微环境中。
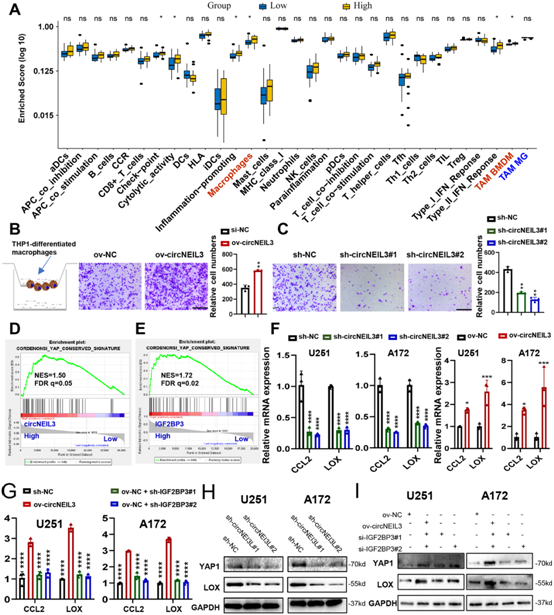
图6:circNEIL3在胶质瘤中促进巨噬细胞浸润
(7) circNEIL3可以被hnRNPA2B1包装成外泌体
circRNAs可以被包装成外泌体,并在肿瘤的进展中发挥重要作用。在中性鞘磷脂酶-2 (nSMase)药理抑制剂GW4869处理的细胞中,circNEIL3的表达下调,阻断了外泌体的形成(补充图未展示),从而证实了circNEIL3在外泌体中存在。这些结果表明circNEIL3可以被包装到外泌体中。
接下来,我们研究了circNEIL3被包装到外泌体中的机制。我们在GBM细胞中通过RIP和RNA下拉实验证实了circNEIL3和hnRNPA2B1之间的相互作用(图7A,B)。在hnRNPA2B1敲除的GBM细胞中,circNEIL3在细胞中表达上调,在外泌体中表达下调(图7C)。这些结果表明circNEIL3可以被hnRNPA2B1包装成外泌体。
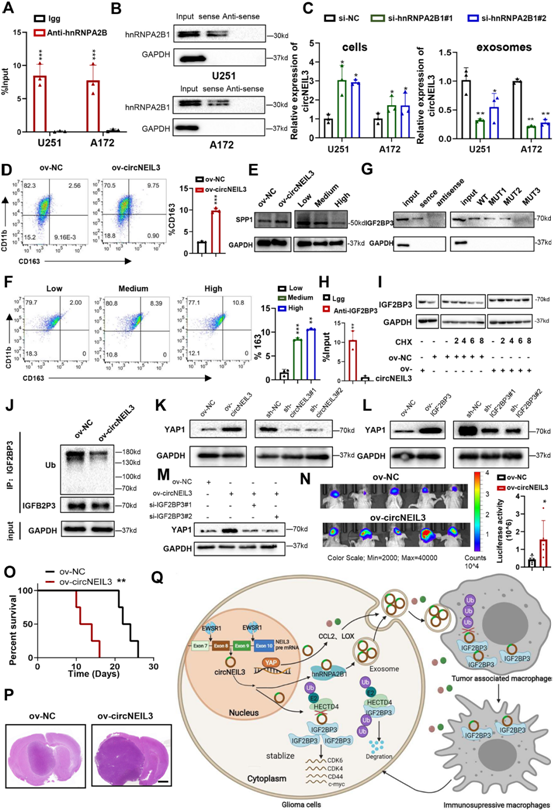
图7:外泌体可以将circNEIL3传递给TAMs,从而使它们获得血管生成和免疫抑制特性
(8)外泌体将circNEIL3传递给TAMs,从而使它们通过稳定IGF2BP3获得免疫抑制特性
流式细胞术结果显示circNEIL3过表达显著上调巨噬细胞活化标志物CD163(图7D)。circNEIL3过表达显著上调了维持胶质瘤细胞存活并刺激血管生成的SPP1蛋白表达。我们假设外泌体可以将circNEIL3传递到巨噬细胞,从而调节巨噬细胞的免疫抑制表型。随着circNEIL3在外泌体中的表达增加,巨噬细胞激活标志物、免疫抑制分子和SPP1显著上调(图7E,F)。这些结果表明,外泌体可以将circNEIL3传递给TAMs,从而使它们获得血管生成和免疫抑制特性。
为了阐明circNEIL3介导巨噬细胞免疫抑制特性的机制,进行了RNA下拉和RIP实验,在THP1分化的巨噬细胞中,circNEIL3与IGF2BP3结合的位置与肿瘤细胞中相同(图7G,H)。在肿瘤细胞中,circNEIL3增加了分化的THP1巨噬细胞中IGF2BP3蛋白的表达并抑制了IGF2BP3的泛素化(图7I,J)。Western Blot证实,在THP1分化的巨噬细胞中,过表达circNEIL3和IGF2BP3均能增强YAP1蛋白的表达,而敲除它们则相反(图7K,L)。过表达circNEIL3所引起的YAP1蛋白表达增强可被敲除IGFB2P3所消除(图7M),提示circNEIL3通过稳定IGF2BP3蛋白来增强YAP1的表达。这反过来促进了巨噬细胞的免疫抑制表型极化。
为进一步验证circNEIL3在体内对巨噬细胞免疫抑制极化的作用,将过表达cicrNEIL3的巨噬细胞或阴性对照载体与胶质瘤细胞原位共植入裸鼠大脑。与NC组相比,circNEIL3过表达组肿瘤生长升高,荷瘤小鼠生存期延长(图7N-P)。IGF2BP3可以作为circNEIL3在巨噬细胞中的下游效应子,使其获得免疫抑制特性,从而促进胶质瘤的进展。
结论:
一种新的环状RNAcircNEIL3在胶质瘤组织中上调。circNEIL3的表达随着胶质瘤分级的增加而增加,而circNEIL3可受EWSR1的调控。功能上,circNEIL3在体外和体内促进了胶质瘤的发生和进展。机制上,circNEIL3通过阻止HECTD4介导的泛素化来稳定IGF2BP3。过表达circNEIL3的胶质瘤细胞可促使巨噬细胞浸润TME。circNEIL3可以被hnRNPA2B1包装成外泌体并传递给浸润的TAMs,从而使它们通过稳定IGF2BP3获得免疫抑制特性,进而促进胶质瘤的发生和恶性进展。circNEIL3是一种新的预后生物标志物和有前途的胶质瘤治疗靶点。
参考文献:
Pan, Z., Zhao, R., Li, B., Qi, Y., Qiu, W., Guo, Q., Zhang, S., Zhao, S., Xu, H., Li, M., Gao, Z., Fan, Y., Xu, J., Wang, H., Wang, S., Qiu, J., Wang, Q., Guo, X., Deng, L., Zhang, P., … Li, G. (2022). EWSR1-induced circNEIL3 promotes glioma progression and exosome-mediated macrophage immunosuppressive polarization via stabilizing IGF2BP3. Molecular cancer, 21(1), 16. https://doi.org/10.1186/s12943-021-01485-6.






