开眼界了——肠道短链脂肪酸通过NLRP3缓解房颤
研究显示不良的肠道菌群(GM)和NLRP3炎症小体是心房颤动(AF)的促心律失常因素。其中,转基因膳食纤维发酵产生的短链脂肪酸(SCFA)是否可作为隐形介质尚不清楚。因此,本研究旨在确定SCFA缓解NLRP3信号介导的心房重构是否保护房颤的发展。作者基于GC-MS代谢组学的横断面研究在48个人中探索粪便SCFA水平和AF性状之间的关系,并最终证实由肠道共生菌发酵的膳食纤维衍生的SCFA可通过GPR43/NLRP3信号缓解房颤的发展。本研究于2022年6月发表在《International Journal of Biological Sciences》IF:10.750期刊上。
技术路线:

主要实验结果:
尽管根据之前的宏基因组分析,已经在AF患者中发现SCFA合成相关基因的中断,其特征是酶基因和隐藏物种的减少,但尚未获得AF患者中SCFA的实际水平。因此,本研究通过GC-MS定量测定了24名AF患者和24名匹配的健康人(CTR)的粪便中SCFA的水平。结果显示与CTR比较,AF患者粪便中SCFA的水平下降(图1B)。有趣的是,在进展型房颤中,从非房颤对照、阵发性房颤(PAF)、<12个月持续性房颤(psAF)和>12个月的psAF中观察到SCFA水平的持续下降趋势(图1C)。随后分析SCFA与左心房前后径(LAD)的相关性,结果显示为负相关(图1D)。以上结果表明SCFA缺失和AF进展紧密相关。
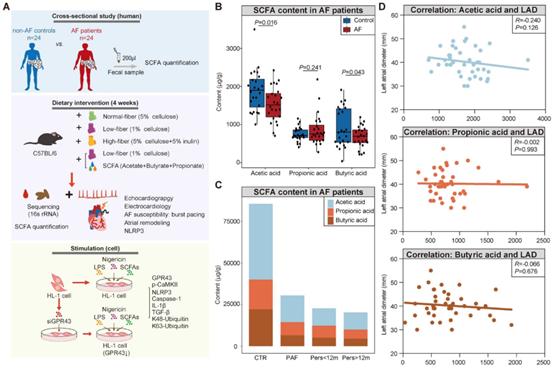
图1 房颤患者粪便中SCFA水平减少
为确定从肠道食物中提取的SCFA对房颤的影响,分别喂给小鼠正常(5%纤维素)、低(1%纤维素)和高(5%纤维素+5%菊粉)纤维素饲料4周,随后16S rRNA测序结果表明,低纤维素组的GM多样性显著高于另外两组(图2A),同时伴随着整体肠道菌群组成分类的改变(图2B-D)。此外,图2E量化了3组中粪便SCFA的水平结果显示在低纤维组中最低。这些结果表明膳食纤维改变了GM组成结构和SCFA的产生。
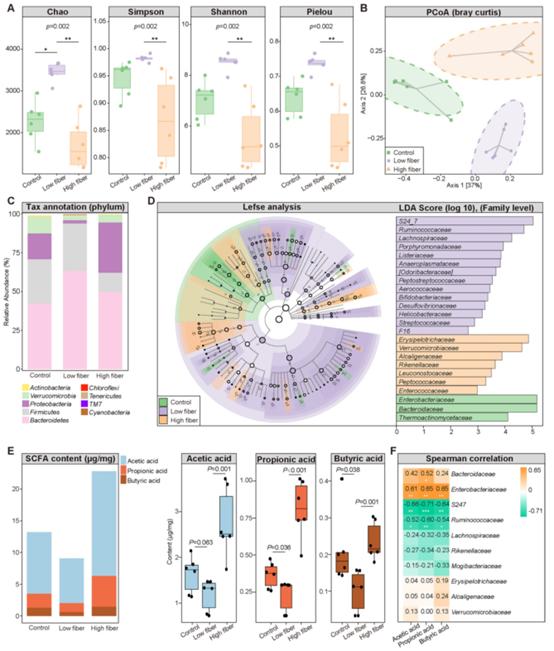
图2膳食纤维改变转基因结构和短链脂肪酸的生成
3、膳食纤维来源的SCFA的缺乏会改变左心房的生理指标
为检测膳食纤维来源的SCFA对心房电传导及心脏结构和功能的影响,分别对四组大鼠进行体表心电图(ECG)和经胸超声心动图检查。提取II号导联的波形(图3A),反映心房-心室结和左心室传导功能的心率、PR间期和QRS持续时间,结果表明这些指标在四组中相似(图3B)。值得注意的是,P波持续时间延长是无序和混乱心房电传导的有力指标,在低纤维饮食喂养的小鼠中被检测到,这种现象可以通过补充SCFA来逆转(图3B)。此外,P波持续时间与SCFA水平呈负相关(图3C)。超声心动图(图3D)显示低纤维饮食组左心房直径增加,射血分数受损,但在高纤维饮食或补充SCFA的小鼠中没有(图3E)。这些发现为膳食纤维衍生的SCFA可能参与心房重构提供了初步证据。
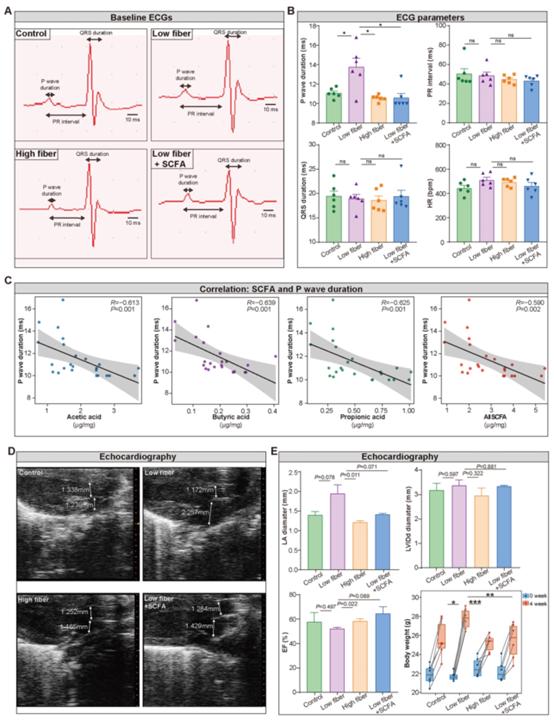
图3膳食纤维来源的SCFA的缺乏会改变左心房的生理指标
4、缺乏膳食纤维来源的SCFA会增加房颤的易感性
为评价喂养不同类型膳食纤维的小鼠的房颤诱发性和持续时间,采用经食管爆发性起搏实验。因此,在基线时,两组均未观察到房性心律失常发作,burst起搏后的代表性心电图如图4A、4B所示。Burst起搏诱发低纤维小鼠AF发生率为9/30(30.00%),高纤维小鼠AF发生率为2/30 (6.67%),SCFA补充小鼠AF发生率为1/30 (3.33%)(图4C)。总之,低纤维饮食小鼠的AF发生率高于对照组,远高于高纤维饮食组和SCFA补充组(图4D)。这些结果缺乏膳食纤维会增加房颤的易感性,而SCFA则发挥了部分保护作用。
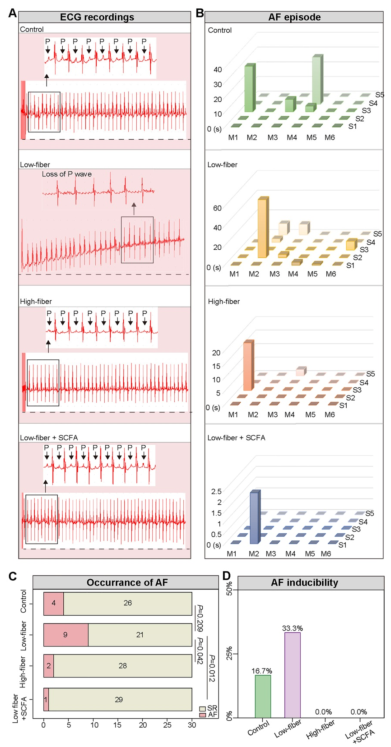
5、缺乏膳食纤维来源的SCFA会加剧心房传导紊乱
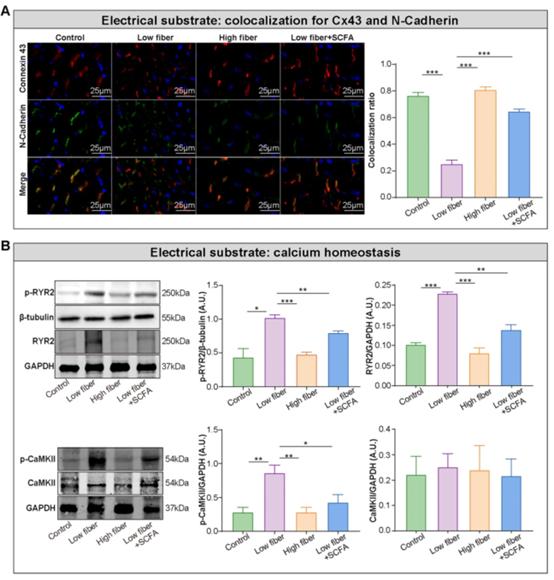
电重构促进了AF的电生理底物—易再入环境,这是由离子通道功能障碍、间隙连接分布中断,连接素半通道蛋白Cx43和N-cadherin的共定位丢失造成的。在正常和高纤维饲粮组中,Cx43和N-cadherin缝隙连接位于细胞末端,几乎没有左右连接(图5A)。相反,在低纤维组中,Cx43和N-cadherin的分布模式明显改变,而在SCFA补充组则有所改善介于两者之间(图5A)。此外,WB结果表明,补充SCFA可以防止膳食纤维缺乏介导的Ca2+处理中断,其特征是上调心房中磷酸化的CaMKII和CaMKII相关的RyR2的磷酸化表达水平(图5B)。这些结果表明,膳食纤维来源的SCFA对心房Cx43/N-cadherin定位和CaMKII介导的RyR2磷酸化具有保护作用,这可能与心房电底物的稳定性有关。
心房结构重构,主要包括组织纤维化,与传导异常相关,为房颤维持创造基质。Masson和天狼星红染色显示,低纤维饮食小鼠心房组织纤维化紊乱和胶原蛋白表达显著进展,补充SCFA可缓解纤维化和胶原蛋白表达紊乱(图6A)。这一现象与一些纤维化相关标志物的蛋白水平一致,如I型胶原、TGF-β和α-SMA(图6B)。综上所述,这些结果部分解释了膳食纤维来源的SCFA、异源性心房传导和房颤易感性之间的病理生理过程。
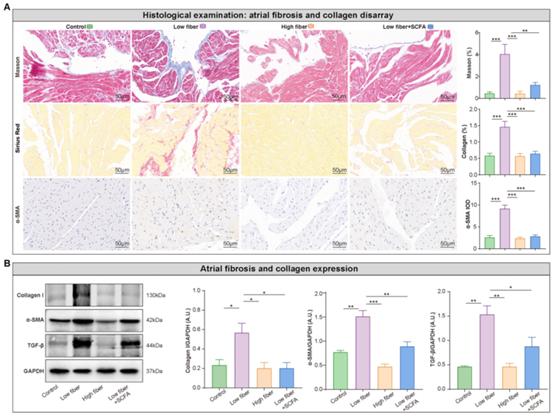
图6缺乏膳食纤维来源的SCFA会加重心房纤维化
6、SCFA可减轻低纤维饮食小鼠NLRP3的激活
近年来的研究通过SCFA在不同组织和细胞类型中的传感器GPR43对其抗炎特性进行了深入的研究。因此,作者假设SCFA对NLRP3炎症小体激活具有保护作用。首先,在低纤维组心房中检测到高水平的NLRP3、pro-caspase-1、cleaved caspase-1和IL-1β(图7A),表明低纤维饮食与NLRP3激活之间存在相关性,尽管其潜在机制尚未阐明。接下来,在高纤维组或SCFA补充组小鼠心房组织中发现自噬降解和失活指标K48-和k63-连接的泛素化增加,提示SCFA可能对NLRP3激活有缓解作用(图7B)。此外,在高纤维组和SCFA补充组中,观察到SCFA的天然传感器GPR43蛋白水平上调(图7A),这表明GPR43的调控作用需要进一步研究。总之,这些初步结果描述了膳食纤维衍生的SCFA通过K48和k63连接的泛素化自噬降解阻止通过GPR43激活NLRP3炎症小体的可能作用,从而对AF发挥保护作用。
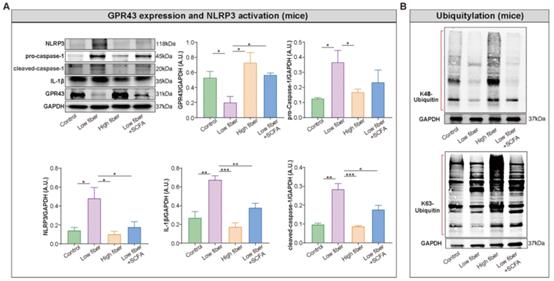
图7富含膳食纤维衍生的SCFA可通过GPR43信号减弱NLRP3的激活
7、在HL-1细胞中SCFA通过的GPR43信号通路减弱炎症小体激活和相关心房重构
为进一步探讨SCFA对NLRP3激活的抑制作用,在奈革霉素刺激前先用SCFA处理LPS介导的HL-1细胞,随后,测定HL-1细胞中NLRP3、pro-caspase-1、cleaved caspase-1和IL-1β的蛋白水平。结果发现SCFA抑制了LPS/nigicin诱导的IL-1β的产生和caspase-1的激活(图8A)。接下来,分析SCFA介导NLRP3抑制的机制。本研究中,先前发现SCFA促进了HL-1细胞中K48-和k63-连接泛素链的GPR43表达和泛素化。此外,在HL-1细胞中,当GPR43介导的NLRP3失活减弱炎症小体激活时,可以观察到CaMKII磷酸化的缓解(图8A)。然而,在LPS和奈日菌素刺激前,用siGPR43处理的细胞中,SCFA对炎症小体的这些作用减弱(图8B)。综上所述,这些数据表明SCFA通过GPR43和CaMKII调控NLRP3炎症小体的激活,初步揭示了SCFA介导NLRP3炎症小体衰减的潜在机制。
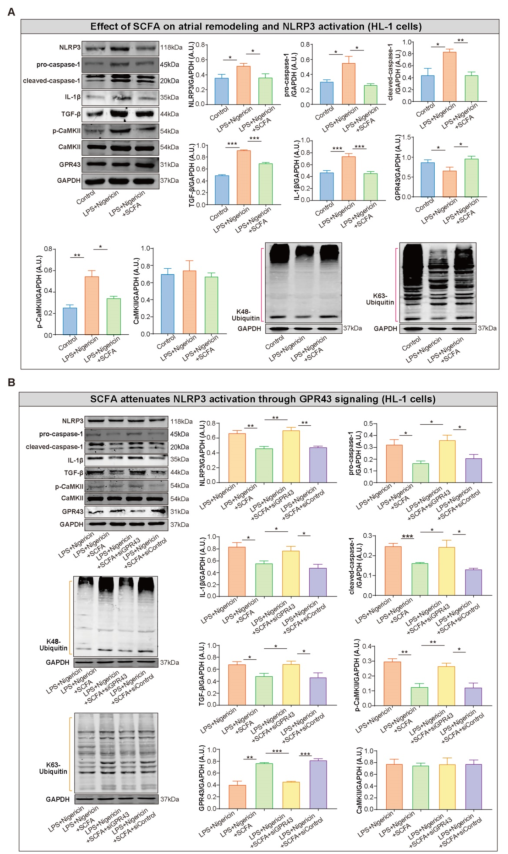
图8在HL-1细胞中SCFA通过GPR43信号通路减弱NLRP3激活
总之,本研究证实肠道共生微生物发酵膳食纤维产生的SCFA通过GPR43/NLRP3信号缓解房颤的发展。目前的研究结果证明,SCFA激活心房GPR43是一种有前途的房颤治疗策略。
参考文献:
Zuo Kun., Fang Chen., Liu Zheng., Fu Yuan., Liu Ye., Liu Lifeng., Wang Yuxing., Yin Xiandong., Liu Xiaoqing., Li Jing., ZhongJiuchang., Chen Mulei., Xu Li., Yang Xinchun.(2022). Commensal microbe-derived SCFA alleviates atrial fibrillation via GPR43/NLRP3 signaling. Int J BiolSci, 18(10), 4219-4232. doi:10.7150/ijbs.70644






