蛋白质组学比较分析鉴定了胰腺癌相关星状细胞小细胞外囊泡中差异表达的蛋白质
人胰腺星状细胞(HPSC)是胰腺导管腺癌(PDAC)进展的重要基质成分和介质。小细胞外囊泡(sEV)是参与细胞间通讯的膜封闭纳米颗粒,并从PDAC内的基质细胞释放。来自正常胰腺星状细胞(HPaStec)和PDAC相关星状细胞(HPSC)的sEV的详细比较仍然是研究者目前关于星状细胞和PDAC的知识中的一个空白。探索PDAC肿瘤周围活化HPSC的机制作用对于提高研究者对涉及基质和肿瘤细胞的细胞间通讯的理解至关重要。该研究发表于《Molecular & Cellular Proteomics》,IF:7.381。
研究路线:

图形摘要:

主要研究结果:
1. 星状细胞分泌的sEV的分离和物理表征
HPSCs类似于肝星状细胞,是肝纤维化中的重要效应细胞,对vimentin,desmin和α-SMA染色呈阳性。使用差分UC步骤从HPSC和HPaStec-CM中分离sEV并稍作修改(图1A)。然后对sEV的蛋白质含量进行定量。为了分析形状和尺寸分布,用戊二醛固定10 μgsEV,并用乙酸铀酰染色并使用TEM成像。HPSC和HPaStec sEV的透明,圆形或椭圆形颗粒的代表性电子显微照可见,并使用TEM捕获,如图1B所示。尽管这两个类别中的大多数sEV的尺寸范围都在50 nm至200 nm之间,但与HPaStec sEV相比,大多数较小尺寸的HPSC sEV在电子显微照片中被捕获(图1B)。
接下来,为了确认大小分布并确定两种细胞类型释放的sEV浓度,研究者使用NanoSight NS300对适当稀释的sEV样品进行了NTA。HPSC(六种独立制剂)和HPaStec sEV(五种独立制剂)的平均粒径分别为182.2至220.9 nm和154.4至191 nm(图1C)。

图1sEV的隔离和物理表征
为了进一步表征这些sEV的差异,研究者进行了蛋白质印迹分析以检测sEV中已建立的外泌体表面标志蛋白(Alix,CD63,TSG101,EGFR和CSE1L)和任何细胞骨架(肌动蛋白)或内质网(Calnexin)污染的表达。这些表面标志物存在于sEV中,并且提取物没有细胞骨架/内质网污染(图2A)。研究者使用与Java 1.8.0_172软件捆绑在一起的ImageJ对蛋白质印迹进行了定量分析(图2B)。与HPaStec sEV相比,HPSC sEV中大多数外泌体标志物的富集度显著更高(图2B)。接下来,在HPaStec(图2C)和HPSC-sEV(图2D)结合的磁珠中进行流式细胞术分析,以分析CD63的表达,CD63是四跨蛋白外泌体标志物之一。图2C和2D中具有适当同种型控制的代表性直方图和图2E中的平均条形图显示,HPSC中CD63的中位荧光强度明显比HPaStec sEV高2倍。
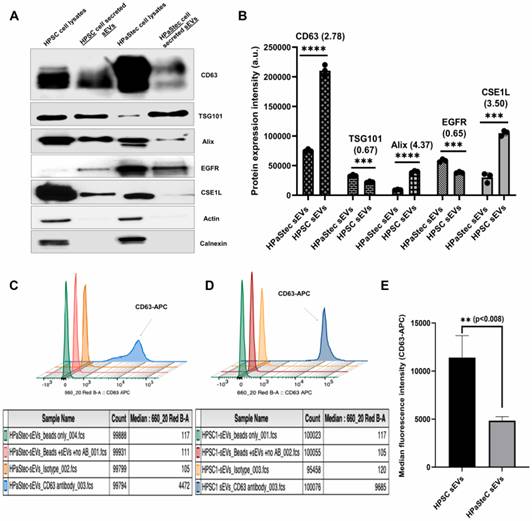
图2星状细胞分泌的sEV和外泌体标志物的表征和定量
2. sEV与正常HPaStec细胞共培养调节α-SMA表达
为了探索在HPSC和HPaStec sEV存在下正常星状细胞的活化,将两种sEV与正常HPaStecs以20μg/ml的浓度共培养72小时,然后进行α-SMA染色。有趣的是,根据研究者的数据,通过sEVs处理,两种类型的EV相对于通过免疫荧光和蛋白质印迹检测到的未处理对照显著降低了α-SMA表达(图3A-C)。

图3sEVs对正常星状细胞的影响以及正常上皮细胞和癌细胞对PKH-26标记的sEV的摄取
3. 正常上皮细胞和PDAC细胞系对sEV的摄取
接下来,为了研究正常和癌细胞系对HPSC和HPaStec sEV的摄取,研究者用红色荧光染料(PKH-26)标记sEV,该染料具有长脂肪族尾巴,并入脂质膜。接下来,将20μg/ml的PKH-26标记的sEV与正常上皮细胞,HPNE和PDAC细胞系Miapaca2和Panc1孵育24小时。用甲醇固定细胞并证明sEV的定位,用代表单个细胞的细胞骨架结构的β-微管蛋白染色细胞,DAPI对细胞核进行复染。使用共聚焦显微镜的免疫荧光成像确定了PKH-26标记的HPSC sEV在正常和胰腺癌细胞中的总体摄取(图3D和E)以及panc1和Miapaca2细胞中HPaStec sEV的摄取(图3H)。图像的更高放大倍率(1890X)显示大多数sEV积聚在细胞的细胞膜上(图3E和H)。细胞系之间的HPSC sEV摄取没有显著差异(图3F和G)。Panc1细胞对HPaStec sEV的摄取明显高于Miapaca2细胞(图3I)。
4. sEV上的膜蛋白对于正常细胞系和癌细胞系中更好地摄取sEV可能至关重要
为了确定富含膜蛋白的HPSC衍生的sEV对于正常或癌细胞更好地摄取sEV是否至关重要,未消化的PKH-27标记的HPSC sEV(20μg/ml)或100ng蛋白酶K消化的PKH-26标记的HPSC sEV被HPNE,Panc1和Miapaca2细胞处理6小时。活细胞对sEV的摄取通过EVOS FL自动显微镜的实时成像可视化(图3J)。与正常(HPNE)和癌细胞(Panc1和Miapaca2)对未消化的sEV的更高水平摄取相比,用蛋白酶K消化外泌体表面蛋白显著减少了sEVs进入HPNE,PANC1和Miapaca2细胞(图3J)。
5. 蛋白质组学确定了正常和癌症相关人胰腺星状细胞sEV之间的差异
PDAC相关的HPSC细胞比HPaStec分泌更多的外泌体sEV,并且含有完整膜蛋白的sEV更容易被癌细胞吸收。因此,为了测试HPSC和HPaStec细胞的sEV中的膜蛋白表达水平是否不同,将两种细胞以生物一式三份生长。使用LC-MS/MS蛋白质组学收获和分析sEV。使用MaxQuant处理后进行定量和质量控制,研究者鉴定了1481个蛋白质组进行进一步分析。与外泌体富集一致,ExoCarta数据库中列出了1239个蛋白质组和1088个ExoCarta蛋白在两种细胞类型的外泌体中鉴定(图4A)。分别在HPSC或HPaStec sEV中独家鉴定了60或91种ExoCarta蛋白(图4A)。

图4HPSC和HPastec sEVs的差异蛋白表达水平的维恩图和火山图
研究者进行了Welch的t检验,并使用Benjamini-Hochberg方法调整了p值来测试HPSC和HPaStec sEV之间的蛋白质含量差异。研究者确定了87个差异表达的蛋白质组(图4B和图4C)。在HPSC sEV中升高的前10种蛋白质中,CSE1L显著更高。
接下来,研究者使用Enrichr R包对87个差异表达的蛋白质组进行了途径富集分析。基于基因本体:生物过程(GO:BP)的顶级显著富集途径与外泌体富集一致,包括细胞外基质组织、多泡体组装和细胞-基质粘附。使用基因本体的顶级显著富集途径:细胞成分还包括细胞外或细胞膜途径,如局灶粘附,丝状肢和吞噬细胞囊泡。GO:BP通路分析显示,HPSC sEVs中转运(ESCRT)复合物拆卸和多泡体组织和组装所需的内体分选复合物,而HPaStec sEVs具有升高的细胞粘附和细胞外组织途径。ESCRT途径含有泛素化和促进多泡内体内sEV内化的膜蛋白。HPSC sEVs的GO:BP分析确定了与溶酶体相关的大量差异表达蛋白,溶酶体是细胞中蛋白质更新的主要部分。
通路富集的一个已知缺点是它不考虑通路成员之间的相互作用。因此,研究者假设基于交互的方法将捕获超越途径富集发现的其他关系。为了验证这一前提,研究者使用STRING蛋白-蛋白质相互作用数据库查询了87个差异表达的蛋白质组。如果存在多个蛋白质,研究者使用蛋白质组中的第一个蛋白质,并且研究者至少需要中等置信度的相互作用。所得网络的相互作用明显多于预期,由此,研究者发现69个蛋白质节点在一个大型子网中共享边缘(图5),ITGB1 具有最高的连接度数或连接数。这些结果表明差异表达的蛋白质组之间存在共性,并可能指向驱动HPSC-HPaStec差异的更深层次的生物学过程。

图5 STRING蛋白-蛋白相互作用
6. CSE1L在PDAC相关的胰腺星状细胞sEV中表达,与生存率低有关
研究者已经确定了在HPSC sEV中高度升高的特定蛋白质标记物,其中CSE1L是CSE1的人类同系物,是一种酵母染色体分离蛋白,优先在HPSC sEV中积累。CSE1L在HPSC sEV中显著增加。CSE1L/XPO2_HUMAN由肽AADEEAFEDNSEEYIRR鉴定,质量数测量精度为4.36 ppm。为了验证,使用完整肽同位素的提取离子色谱图进行相对定量以及每个样品中所有已鉴定的CSE1L蛋白肽的归一化信号强度之和显示,与HPaStec sEV相比,HPSC sEV的强度增加(图6A-C)。HPSC sEV组分中的CSE1L表达也显著高于HPaStec sEVs(图2A)通过蛋白质印迹分析。鉴于HPSC中CSE1L的急剧增加,研究者假设其发现可能与PDAC患者的结局有关。因此,研究者通过CSE1L基因表达测量和临床结局数据从癌症基因组图谱(TCGA)中确定了174例PDAC患者,并通过中位CSE1L表达对这些患者进行分层。Kaplan-Meier生存分析显示,较高的CSE1L表达与生存率显著降低有关。
7. HPSC sEVs处理后Panc1细胞中的CSE1L表达和ERK信号传导
接下来,为了研究HPSC sEVs和HPaStec sEVs对CSE1L表达的影响,在使用CSE1L,CD63和β-肌动蛋白进行蛋白质印迹分析之前,将HPSC sEVs(20μg/ ml)与Panc1或Miapaca2细胞共培养72小时。此外,为了确定sEVs对细胞的处理是否诱导细胞存活信号传导,研究者评估了sEVs处理后的磷酸化ERK信号传导。蛋白质印迹显示,在使用HPSC sEV处理后,Panc1细胞中的CSE1L表达升高和ERK信号传导增加(图6D),但在Miapaca2细胞中没有。相反,原代HPaStec sEV不调节任何癌细胞中CSE1L或ERK信号传导的表达(图6D)。

图6CSE1/XPO2的LC-MS/MS鉴定
结论:
该研究成功鉴定了从PDAC相关星状细胞分离的HPSC sEV和从正常胰腺分离的sEV中差异表达的蛋白质。该研究结果表明,HPSC sEVs在生物学上与HPaStec sEVs不同,可能为胰腺癌细胞提供有利的微环境,并可能成为将药物或其他生物材料安全输送到癌细胞的货运载体。需要进一步的研究来阐明癌症相关的星状细胞sEVs在PDAC进展中的作用,这将为针对肿瘤基质的治疗干预开辟道路。
参考文献:
Sarcar B, Fang B, Izumi V, O Nunez Lopez Y, Tassielli A, Pratley R, et al. A comparative Proteomics Analysis Identified Differentially Expressed Proteins in Pancreatic Cancer-Associated Stellate Cell Small Extracellular Vesicles. Mol Cell Proteomics. 2022 Dec;21(12):100438. doi: 10.1016/j.mcpro.2022.100438.






