PP4抑制通过STAT1激活和炎症信号增强卵巢癌对NK细胞介导的细胞毒作用的敏感性
T细胞在卵巢肿瘤中的浸润增加已被反复证明可以预测患者生存率的提高。然而,尽管有证据表明卵巢癌(ovarian cancer,OC)中存在主动免疫反应,但OC对免疫检查点阻断(ICB)治疗的反应频率远低于其他癌症类型。最近的研究强调,DNA损伤反应(DDR)的缺陷会导致基因组不稳定性和肿瘤免疫原性的增加,从而导致对ICB的反应增强。蛋白磷酸酶4(PP4)是DDR的关键调节因子。然而,其在抗肿瘤免疫中的潜在作用目前尚不清楚。本研究明确抑制PP4在促进炎症信号传导和增强免疫
细胞效应功能中的作用。这些发现为进一步研究PP4抑制剂增强OC的化学免疫治疗提供了支持。本研究于2022年12月发表于期刊《J Immunother Cancer》上,IF:12.469。
技术路线:
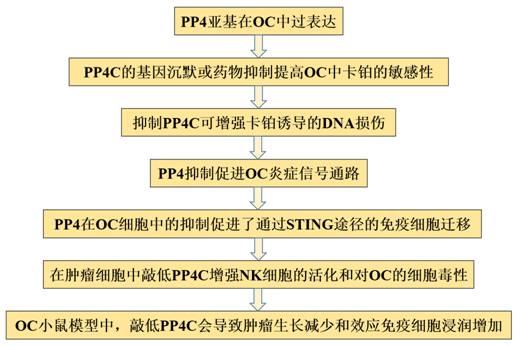
主要研究结果:
为更好的研究理解PP4在敖正中的作用,作者利用TCGA数据库研究PPP4C, PPP4R3A, PPP4R3B, PPP4R2亚基的基因组水平变化,发现PP4亚基基因在大约6%的OC肿瘤中主要扩增(图1A)。类似于OC,浸润性乳腺癌,膀胱尿路上皮癌和景园细胞刘也显示PP4亚单位基因显著扩增(图1A)。此外,还观察到信使之间有显著的一致性和泛癌TCGA数据库中PPP4C的RNA水平(图1B)。为评估在OC中靶向PP4复合物的效用,作者接下来评估OC TCGA数据集中PP4亚基的表达水平。利用RNA-seq数据,发现与正常卵巢和输卵管组织相比,PPP4C在OC中显著过表达(图1C),而调节亚基的表达水平是可变的。PPP4R3B和PPP4R2 mRNA表达增加。相比之下,PPP4R3A在正常组织中含量更高(图1C)。在蛋白质水平上,PP4C被发现在代表性的高级别浆液性卵巢癌(HGSOC)细胞系中稳定表达(图1D)。作者注意到PPP4R3β调节亚基在OC细胞系中的表达变化,其中HTYK-nu和59M的表达变化最小(图1D)。类似的结论在PPP4R3α和PPP4R2中也可以观察到(图1D)。总之,上述数据表明PP4C在OC中表阿达上调。
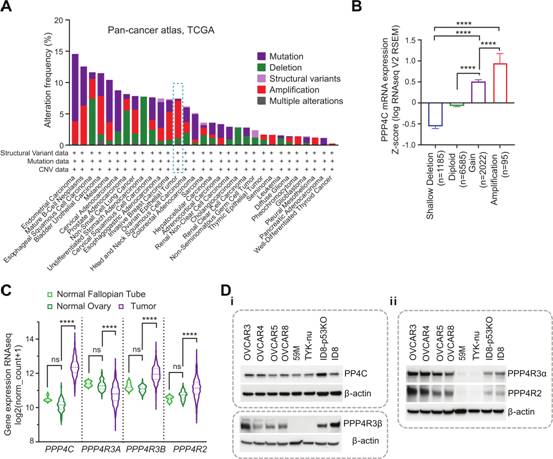
图1 PP4亚基在卵巢癌中扩增
作者使用CRISPR生成p53敲除ID8细胞系模型。在ID8-p53WT和ID8-p53KO中,用siRNA敲低PPP4C表明,PP4C表达的缺失导致这两种细胞系对卡铂的敏感性增加(图2A)。WB证实转染siRNA后PP4C的表达(图2A)。作者通过正交试验获得了PP4C稳定敲除的ID8-p53 KO细胞。与siRNA结果一致,与载体对照或亲代细胞相比,低PP4C表达的ID8-p53KO细胞对卡铂处理越来越敏感(图2B)。WB证实抗生素选择后PP4C的表达(图2B)。同样,在ID8小鼠细胞系中,以纳摩尔水平使用PP4的药理抑制剂fostriecin治疗也导致对卡铂的敏感性增强(图2C)。与卡铂单独处理相比,fostriecin和卡铂联合处理ID8-p53KO和人OC细胞系OVCAR3和OVCAR8的集结肠形成能力下降(图2D-E)。这些发现表明抑制PP4活性可导致OC卡铂敏感性增加。细胞热位移实验(CETSA)表明fostriecin处理提高PP4C蛋白的热稳定性,这证实PP4C是fostriecin在OC细胞系中的直接靶点(图2F)。
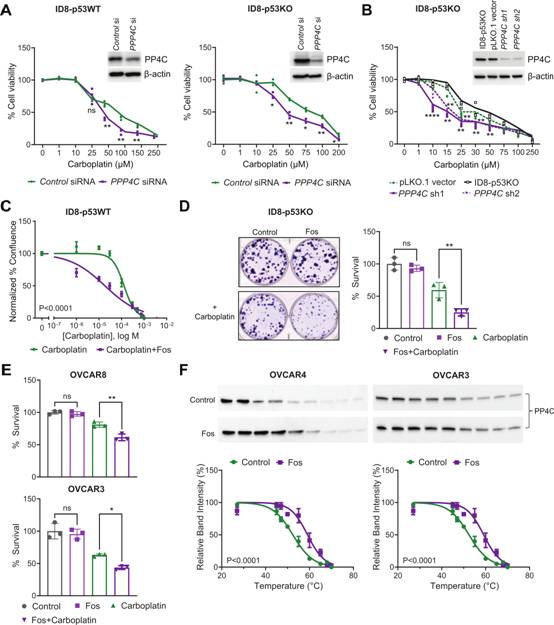
图2 PP4抑制或敲除使卵巢癌细胞系对卡铂敏感
3、抑制PP4C可增强卡铂诱导的DNA损伤
作者发现,fostriecin联合卡铂抑制PP4导致多个OC细胞系微核形成增加(图3A)。作者试图确定fostriecin处理是否影响H2AX(S139)磷酸化(γ-H2AX),结果表明,fostriecin与卡铂联合治疗可增加γ-H2AX病灶的数量(图3B),γ-H2AX焦点强度,以及OC细胞整体γ-H2AX水平。由于已知卡铂可以诱导链间交联(interstrand crosslinks,ICLs),作者接下来研究是否FANCD2焦点,ICLs的关键传感器,被PP4抑制改变。与文献报道一致,作者发现卡铂治疗后FANCD2焦点增加。然而,fostriecin处理并没有增加每个细胞中FANCD2焦点的数量(图3B)。用RAD51抑制剂处理的细胞,B-02,作为阳性对照。通过siRNA或fostriecin处理PPP4C可以抑制DR-GFP细胞系的HR(图3C)。这些数据表明,抑制PP4导致增加卡铂治疗后OC细胞系DNA损伤和基因组不稳定性标记。
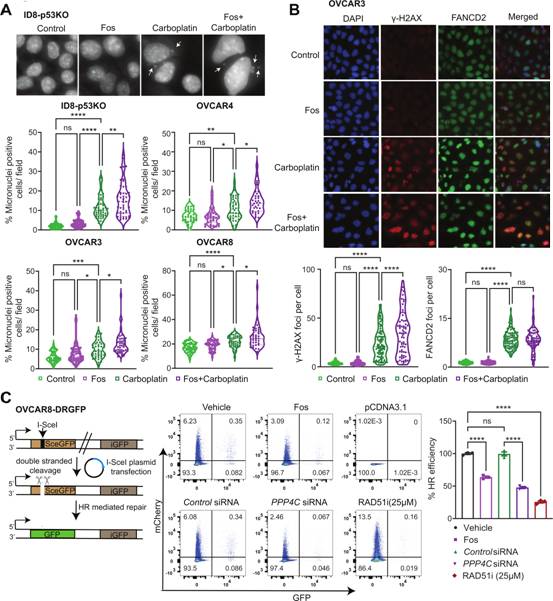
图3 PP4的药理抑制增强卡铂诱导的DNA损伤
4、PP4抑制促进OC炎症信号通路
由于抑制PP4后观察到的微核增加(图3A),作者推测在PP4活性丧失的情况下,OC细胞中炎症信号会增加。STAT1的完全转录激活需要额外的S727磷酸化。作者发现,与卡铂单独处理相比,fostriecin和卡铂联合处理导致OC细胞系中STAT1(Y701)磷酸化增加(图4A)。与fostriecin治疗相似,PPP4C联合卡铂也导致OC细胞系中STAT1激活增加(图4B)。作者在OVCAR3和OVCAR8细胞中观察到磷酸化p65在福司曲星和卡铂作用下显著上调(图4C)。siRNA联合卡铂处理敲低PPP4C表达后,经典的NF-kB(p65)也被激活(图4D)。在mRNA水平,发现卡铂与fostriecin或PPP4C siRNA联合处理后,IFNB1、CCL5、CXCL10和IL - 6增加(图4E)。而且,作者还观察到PP4C敲低后,额外的衰老相关分泌表型(SASP)相关细胞因子IL - 8、CCL2、TNF - α和CXCL9表达增加(图4F)。总之,这些数据表明抑制PP4增强卡铂诱导的OC细胞系中的炎症信号。
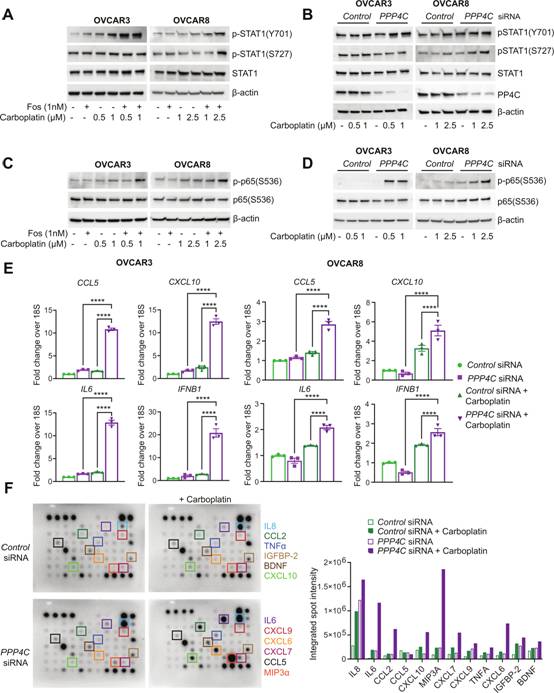
图4 PP4活性的缺失增强了DNA损伤诱导的炎症信号
5、PP4在OC细胞中的抑制促进了通过STING途径的免疫细胞迁移
将小鼠OT - I CD8 T细胞或NK - 92细胞分别置于含有小鼠或人OC条件培养基的Boyden小室中(图5A)。当小鼠CD8 T细胞和NK - 92细胞暴露于fostriecin和卡铂联合处理的OC细胞的条件培养基时,表现出增强的迁移能力(图5A)。与文献报道的Rac信号在趋化因子诱导的细胞迁移中的作用一致,作者观察到在Rac抑制剂存在的情况下,CD8 T和NK细胞的迁移显著减少(图5B)。然而,作者观察到MEK和STAT3抑制剂的细胞类型特异性反应。STAT3抑制剂Stattic抑制CD8 T细胞迁移,但增加NK - 92细胞迁移(图5B)。与STAT3信号类似,MEK抑制也导致CD8 T和NK细胞的不同细胞反应。有趣的是,MEK抑制剂抑制NK细胞迁移,而CD8 T细胞迁移不受影响(图5B)。为确定c GAS - STING信号是否在观察到的T和NK细胞迁移增加中发挥作用,作者通过实验发现STING1敲低的OVCAR8细胞条件培养基抑制PP4后不能刺激人CD8 T细胞迁移(图5C)。这些数据表明,在OC细胞中,PP4抑制刺激的促炎信号是通过STING激活介导的。
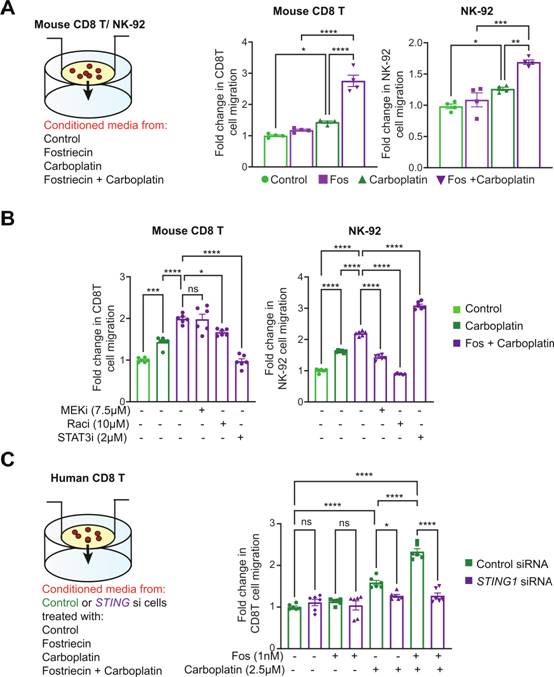
图5蛋白磷酸酶4在卵巢癌细胞中的下调增强了效应免疫细胞的迁移
6、在肿瘤细胞中敲低PP4C增强NK细胞的活化和对OC的细胞毒性
作者发现,与对照组相比,PPP4C或PPP4R3B敲低后IFN - γ + NK细胞显著增加,而卡铂进一步增加了IFN - γ + NK细胞(图6A-B)。作者接下来评估NK - 92细胞与转染对照、PPP4C或PPP4R3B siRNA的OVCAR8细胞共培养3小时后NK细胞脱颗粒情况,发现CD107a + NK - 92细胞对PPP4C或PPP4R3B的敲低反应显著增加。作者还观察到与卡铂处理的细胞共培养时CD107a + NK - 92细胞群显著增加(图6C)。为进一步确定PP4缺失介导的NK细胞活化和脱颗粒的增加是否有助于NK细胞介导的OC细胞杀伤的增加,作者将转染对照、PPP4C或PPP4R3B siRNA的OC细胞系与NK - 92细胞共培养。作者的结果表明,在OC中PPP4C或PPP4R3B的表达缺失增强NK细胞介导的OC细胞杀伤(图6D)。卡铂处理导致OVCAR8细胞的杀伤显著增加,在PP4C和PPP4R3β敲低的细胞中进一步增加(图6D)。因此,PP4的缺失促进NK细胞活化和NK细胞定向的卵巢癌杀伤。
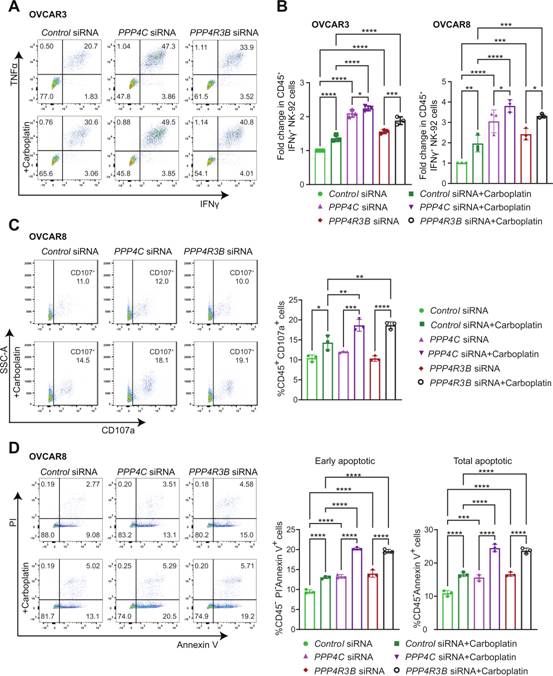
7、在一个同基因的、具有免疫功能的OC小鼠模型中,敲低PP4C会导致肿瘤生长减少和效应免疫细胞浸润增加
接下来,作者试图评估PP4C敲低对OC肿瘤生长的影响。研究构建了PP4C表达降低的ID8 - p53KO细胞(图2B)。在体内,PP4C敲低导致整体肿瘤生长显著降低(图7A-B)。此外,与对照组相比,PP4C敲低的肿瘤中腹水形成显著减少(图7C)。接下来,作者测定了肿瘤、脾脏、腹腔淋巴结和腹水中的细胞变化,观察到,与对照组相比,PP4C shRNA肿瘤中NK细胞( CD3-CD161 + )和NK T细胞( CD3 + CD161 + )浸润均显著增加(图7D-I),而卡铂治疗后没有额外增加(图7D-E)。与浸润增加一致,作者在PP4C shRNA肿瘤中也发现IFN - γ+ NK细胞( CD3-CD161 + )增加(图7F)。此外,作者观察到PP4C shRNA肿瘤内CD4 + T细胞数量显著增加,且不受卡铂处理的影响(图7G)。有趣的是,在PP4C shRNA肿瘤中,卡铂治疗显著增加了肿瘤内CD8 + T细胞的数量,而在对照组中没有观察到(图7H)。此外,作者发现作为调节性T细胞代表的CD4 + CD25 + T细胞群在所有组别中保持不变(图7I)。这些数据表明抑制PP4C降低肿瘤负担,增强免疫效应细胞肿瘤浸润。
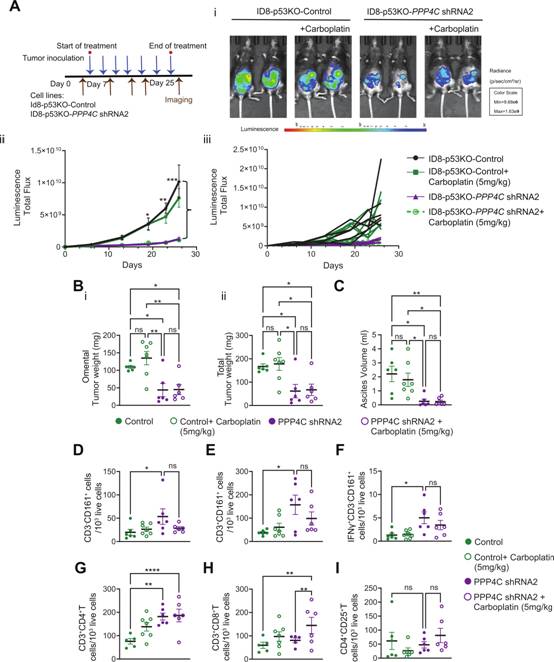
图7抑制PP4C增强免疫细胞浸润
结论:
综上所述,本研究突出了PP4在抗肿瘤免疫中的作用以及需要特异性抑制剂进行有效的临床转译。据作者所知,这是第一份证明在癌细胞中敲除或抑制PP4会增强免疫效应细胞的迁移、功能和肿瘤浸润的报告。根据这些发现,作者认为PP4是OC中一个有吸引力的治疗靶点,值得进一步研究。
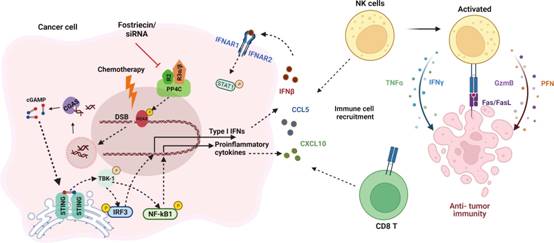
图8 PP4C参与抗免疫抑制的机制图
参考文献:
Raja R, Wu C, Bassoy EY, Rubino TE Jr, Utagawa EC, Magtibay PM, Butler KA, Curtis M. (2022) PP4 inhibition sensitizes ovarian cancer to NK cell-mediated cytotoxicity via STAT1 activation and inflammatory signaling. J Immunother Cancer. 10(12):e005026. doi: 10.1136/jitc-2022-005026. PMID: 36564125






