METTL3通过介导乳腺癌中LATS1的m6A甲基化来调节肿瘤发生和糖酵解
肿瘤相关因子的转录后修饰在乳腺癌进展中起着关键作用。然而,潜在的机制仍然未知。癌细胞中的m6A修饰是动态和可逆的,并已发现通过各种机制影响肿瘤的发生和进展。本研究探讨了Hippo通路中m6A甲基化对乳腺癌细胞增殖和代谢的调控机制。我们通过Hippo通路因子LATS1证明m6A调控在乳腺癌的增殖和糖酵解代谢中发挥重要作用。METTL3被鉴定为m6A的writer,YTHDF2被鉴定为LATS1 mRNA的阅读蛋白,在乳腺癌的肿瘤发生和糖酵解中都有积极的促进作用。METTL3在LATS1 mRNA中诱导了高水平的m6A修饰。YTHDF2识别了LATS1 mRNA中的m6A位点,降低了其稳定性。敲除METTL3或YTHDF2蛋白表达,通过激活Hippo通路中的YAP/TAZ,增加LATS1 mRNA的表达,抑制乳腺癌的肿瘤发生。综上所述,我们发现METTL3-LATS1-YTHDF2通路通过激活Hippo通路中的YAP/TAZ在乳腺癌的进展中发挥重要作用。本文于2023年1月发表于“Journal of Experimental & Clinical Cancer Research”(IF=12.658)上。
技术路线

结果:
1)乳腺癌中m6A修饰的mRNA的异常表达与Hippo通路有关
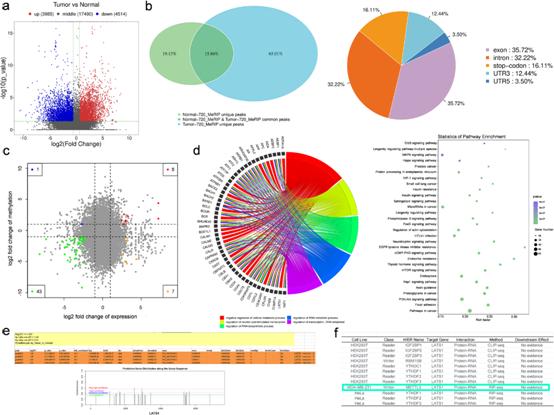
为了研究乳腺癌组织样本中m6A修饰水平,对配对的乳腺导管癌组织和相邻的正常乳腺组织样本进行MeRIP-seq。通过分析测序数据,我们发现癌组织中存在大量差异甲基化或修饰的mRNAs(图1a)。每一对的差异富集峰显示,肿瘤组织中超过一半的m6A特异性位点富集,并出现在经典的mRNA修饰区域附近,即外显子、3 ' UTR和终止密码子(图1b)。图1c显示了差异表达的m6A mRNA与差异表达基因的联合分析结果。对这些差异表达基因的功能富集分析(图1d)进一步揭示m6A修饰在调控多种癌症和信号通路中发挥重要作用,如MAPK,Hippo和PI3K-Akt信号通路。值得注意的是,Hippo途径中的基因被发现在乳腺癌组织中有差异的修饰和表达(图1d)。Hippo通路是参与癌症发展的重要增殖调节通路。结果表明,肿瘤抑制因子LATS1的m6A修饰可能参与mRNA表达下调和细胞代谢过程的负调控。MeRIP-seq结果显示,LATS1 mRNA的m6A修饰水平在两个以上位点显著上调(图1e)。为了确定乳腺癌中LATS1中m6A修饰的机制,我们使用SRAMP预测LATS1 mRNA中的m6A位点(图1e)。如图1f所示, METTL3被预测为MDAMB-231乳腺癌细胞m6A修饰过程中LATS1 mRNA的结合蛋白。
2)乳腺癌组织和细胞中METTL3的表达
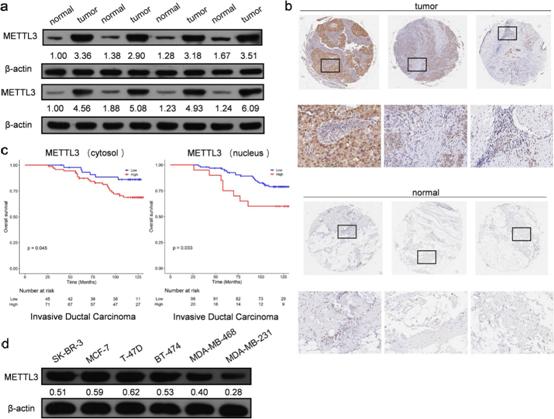
为了研究METTL3在乳腺癌中的表达,我们检测了其在乳腺癌组织和配对的正常组织中的蛋白水平。如图2a所示,METTL3在乳腺导管癌组织中高表达。对乳腺癌组织微阵列进行免疫组化(IHC)结果显示,METTL3主要表达在癌组织的细胞质和细胞核中,少量表达在细胞膜上(图2b)。Kaplan-Meier生存分析显示,METTL3蛋白高表达与浸润性导管癌和腔内乳腺癌组织不良预后显著相关(图2c)。此外,我们在六种不同的乳腺癌细胞类型中检测了METTL3的蛋白水平。结果如图2d所示。METTL3在T47D细胞中表达量最高,MCF-7细胞次之,MDA-MB-231细胞中表达量最低。
3)METTL3在体外和体内均促进乳腺癌细胞的肿瘤发生
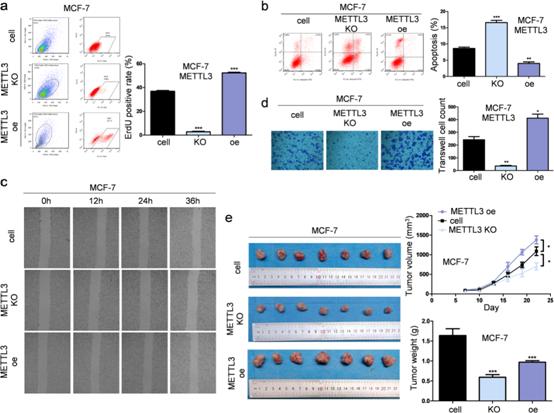
我们通过在MCF-7和T47D细胞中敲除或过表达METTL3来检测METTL3在乳腺肿瘤发生中的作用。缺失METTL3后,T细胞增殖和存活明显受到抑制(图3a-b)。Transwell实验显示,缺失METTL3抑制MCF-7和T47D细胞的迁移和侵袭(图3d)。在免疫缺陷小鼠中,敲除MCF-7和T47D细胞中的METTL3可以抑制相应细胞形成肿瘤的生长,而过表达METTL3则可以显著促进移植瘤的生长(图3e)。基于这些数据,我们证实了METTL3在乳腺癌发生中的重要作用。
4)METTL3影响乳腺癌细胞的Hippo途径和糖酵解
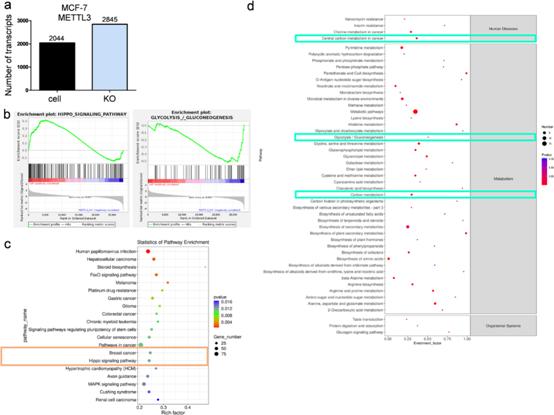
RNA-seq检测METTL3对MCF-7细胞转录组表达的影响。METTL3的表达显著增加了2845个转录本,减少了2044个转录本的表达(图4a)。KEGG分析显示,Hippo途径和糖酵解与METTL3表达显著相关(图4b)。此外,对差异表达基因的途径富集分析表明,METTL3与乳腺癌和Hippo途径显著相关(图4c)。由于RNA-seq揭示METTL3可能与乳腺肿瘤细胞的糖酵解有关,我们对METTL3 KO MCF-7乳腺癌细胞进行了代谢组学分析。差异代谢产物KEGG分析进一步证明METTL3的表达参与了癌症的中枢碳代谢,尤其是糖酵解和糖异生作用(图4d)。
5)METTL3促进乳腺癌细胞的糖酵解和集落形成能力
为了了解METTL3促进乳腺癌糖酵解的机制,我们评估了METTL3对MCF-7和T47D细胞糖酵解的影响。值得注意的是,我们发现METTL3的缺失降低了乳腺癌细胞系的糖酵解活性(图5a-b)。由于Hippo通路参与癌症发展是众所周知的,我们预测METTL3可能介导LATS1的m6A修饰,并进一步影响Hippo通路。通过RNA下拉实验和western blotting,我们证实了LATS1 mRNA和METTL3之间的相互作用(图5c)。MeRIP-qPCR结果显示METTL3的存在直接增加了LATS1 mRNA的m6A水平(图5d)。为了确定LATS1 mRNA与METTL3相互作用的区域,我们检测了METTL3和LATS1 mRNA之间的相互作用。突变位点基于MeRIP-seq和SRAMP预测结果。MeRIP-qPCR结果进一步证实METTL3的调控介导了LATS1 mRNA的m6A甲基化(图5e)。为了研究m6A调控对乳腺癌细胞增殖和酵解的影响,我们进行了集落形成实验,结果显示METTL3敲除后抑制LATS1可以挽救乳腺癌细胞的增殖(图5f)。此外,海马实验显示,在乳腺癌细胞中,敲低METTL3表达后,抑制LATS1表达,糖酵解上调(图5g)。
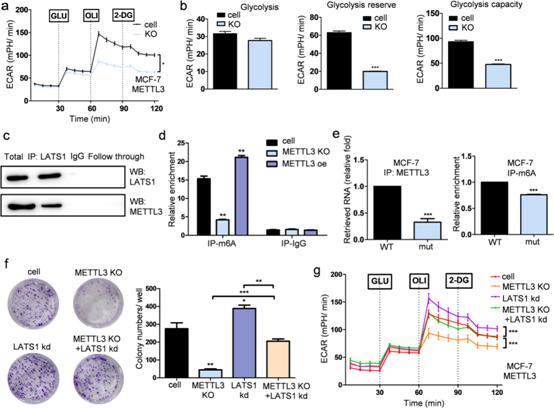
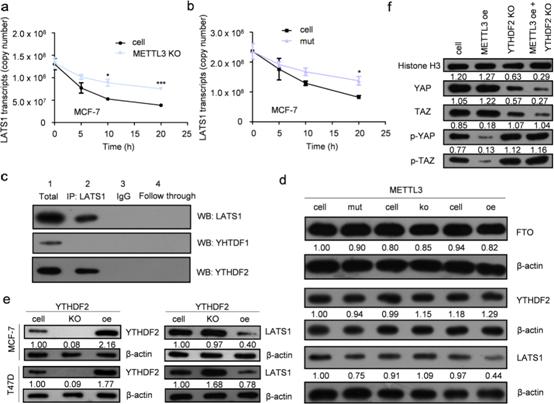
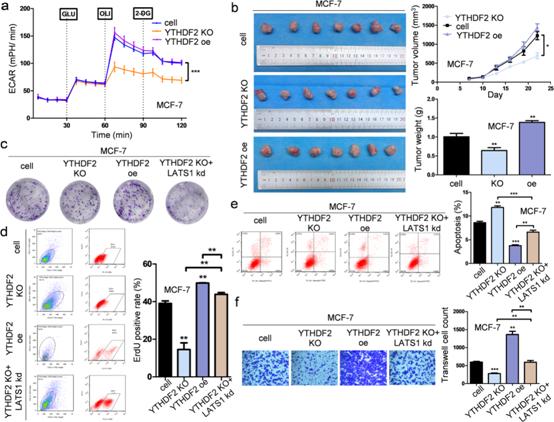
由于MeRIP-seq检测发现LATS1 mRNA有较高的m6A修饰水平,我们的目的是确定哪些m6A阅读器可以直接识别m6A修饰位点并调节乳腺癌细胞中LATS1的表达。LATS1 mRNA的稳定性实验表明,缺失METTL3促进了mRNA的稳定性(图6a),而突变LATS1 mRNA中的m6A位点也增强了这种稳定性(图6b)。使用RNA下拉实验和western blotting,我们发现YTHDF2是LATS1 mRNA的m6A阅读器(图6c)。我们发现METTL3的表达对FTO和YTHDF2的表达没有影响(图6d)。而LATS1蛋白水平与YTHDF2在乳腺癌细胞中的表达呈负相关(图6e)。为了确定YTHDF2在乳腺癌细胞中的影响,并了解其在肿瘤发生和糖酵解过程中LATS1 mRNA m6A甲基化中的作用,我们改变了YTHDF2在乳腺癌细胞中的表达(图6e)。我们发现LATS1的m6A甲基化下调了乳腺癌细胞中LATS1的表达(图5d, 6e),并通过抑制其磷酸化激活YAP/TAZ(图6f)。在诱导METTL3表达后,乳腺癌细胞核中发现了高水平的YAP/TAZ,而敲低YTHDF2的表达可以纠正细胞核中的这种偏移表达(图6f)。海马实验显示YTHDF2对乳腺癌细胞的糖酵解有积极作用(图7a)。YTHDF2在乳腺癌细胞中的表达在体外和体内都促进了肿瘤的发生(图7b-c)。由于YTHDF2通过读取LATS1中的m6A甲基化使LATS1 mRNA失稳,我们预测敲低YTHDF2的表达可以促进LATS1的抑瘤作用。与这一假设相一致的是,YTHDF2的缺失抑制了肿瘤的增殖、生存和侵袭,而这种抑制肿瘤的作用通过抑制LATS1的表达得以恢复(图7c-f)。
结论:
我们发现了LATS1 mRNA的负向调控机制,即METTL3介导LATS1 mRNA中某些位点的m6A修饰,而这种修饰被YTHDF2识别。因此,乳腺癌中LATS1的表达和Hippo通路蛋白的磷酸化被抑制,最终导致糖酵解和肿瘤的发展。
参考文献:
Xu Y, Song M, Hong Z, Chen W, Zhang Q, Zhou J, Yang C, He Z, Yu J, Peng X, Zhu Q, Li S, Ji K, Liu M, Zuo Q. The N6-methyladenosine METTL3 regulates tumorigenesis and glycolysis by mediating m6A methylation of the tumor suppressor LATS1 in breast cancer. J ExpClin Cancer Res. 2023 Jan 7;42(1):10. doi: 10.1186/s13046-022-02581-1.






