C/D box小核仁RNA SNORD104通过调节PARP1的2'O-甲基化促进子宫内膜癌
子宫内膜癌(EC)是发达国家绝经期和绝经后妇女最常见的恶性肿瘤之一,其发病率在全球范围内呈上升趋势。尽管手术、化疗和放疗取得了令人满意的结局,但由于肿瘤细胞有复发和转移的趋势,EC患者的生存率仍然很低。因此,阐明EC起始、进展和转移的分子机制对于确定个性化治疗的潜在治疗靶点至关重要。小核仁RNA(snoRNA)是一类具有保守结构元件的小非编码RNA(ncRNA),广泛分布在真核细胞的核仁中,大致分为C/D box snoRNA(SNORD)和H/ACA box snoRNA。它们通常由编码基因或非编码基因的内含子区域编码,并且由于宿主基因的转录和加工而变得复杂,只有少数由独立的基因组位置编码。最近的研究表明,snoRNA通过互补碱基配对介导rRNA、tRNA、mRNA、snRNA和其他RNA的2'-O-甲基化和假尿苷化,并通过与核糖核仁蛋白(RNP)形成snoRNP复合物来调节基因表达。该研究发表于《Journal of Translational Medicine》,IF:8.44。
研究路线:
主要研究结果:
1. SNORD104在EC组织中上调
作者分析了来自TCGA数据集的548个EC组织样本和35个正常子宫内膜组织样本的转录组谱(图1A),并发现 SNORD104 在 EC 样品中上调。为了验证这些结果,作者分析了广州医科大学附属第三医院收集的术后EC组织中SNORD104的表达,并分析了SNORD104表达与临床病理特征之间的相关性。与I/II期疾病患者(n = 46)相比,III/IV期疾病患者(n = 13)的SNORD104表达更高(图1B)。此外,SNORD104在低分化(n = 15)与中分化或高分化(n = 44)肿瘤中上调(图1C)。与浅肌层浸润患者(n = 33)相比,深部肌层浸润(n = 26)患者的SNORD104表达更高(图1D),以及淋巴结转移患者(n = 26)相对于没有淋巴结转移的患者(n = 33)的SNORD104表达也更高(图1E)。相比之下,SNORD104表达与血管浸润之间没有显著相关性(图1F)。因此,作者假设SNORD104在EC中作为癌基因起作用。
图1SNORD104在EC组织中上调,并与临床病理特征相关
2. 敲低SNORD104在体外抑制EC细胞的恶性电位
基因组序列分析表明,SNORD104是从SNHG25基因(小核仁RNA宿主基因25,位于17q21.3)的初级转录本的第一内含子区域加工而来的(图1G),成熟的SNHG25 RNA是从外显子转录而来的。作者发现SNHG25在EC组织中也上调。此外,与永生化子宫内膜细胞相比,SNORD104在EC细胞系中上调。SNORD104和SNHG25在石川细胞中均高表达,但在HEC1B和HEC1A细胞中表达水平相对较低(图2A)。先前的研究表明,snoRNA的宿主基因调节其各自的snoRNA并在肿瘤发展中发挥作用。为了确定SNORD104和SNHG25在EC细胞中的作用,作者分别用SNHG25特异性小干扰RNA(siRNA)转染石川细胞,用SNHG25过表达质粒转染HEC1B细胞,并在HEC1B细胞中转染靶向SNORD104的反义寡核苷酸序列(ASO)。通过qRT-PCR验证了敲低效率(图2B)。SNORD104敲低显著降低了石川细胞的生存能力、增殖(图2C,D)、克隆容量(图2E)、迁移和入侵(图2G),并增加了细胞凋亡率(图2F)。相比之下,敲低或过表达SNHG25对子宫内膜癌细胞的增殖和凋亡几乎没有影响。
图2 SNORD104敲低在体外抑制EC生长
3. SNORD104促进体外和体内EC进展
用SNORD104质粒稳定转染的HEC1B细胞(图3A)表现出高增殖能力(图3B-D),以及入侵和迁移速率的增加(图3E)。此外,SNORD104过表达降低了HEC1B细胞的凋亡率(图3F)。与体外结果一致,与接种空载体的对照细胞相比,稳定表达SNORD104的HEC1B细胞在裸鼠中形成明显更大的肿瘤(图3G)。综上所述,SNORD104的过表达显著增强了体外EC细胞的增殖、侵袭和迁移,促进了体内肿瘤的生长。
图3 SNORD104过表达促进体外和体内EC生长
4. SNORD0104通过促进2'O-甲基化上调和稳定PARP1
SNORDs和H/ACA box snoRNA分别通过2'O-甲基化和假尿苷化调节基因表达。因此,作者假设SNORD104可能参与FBL介导的2'O-甲基化。事实上,使用抗FBL抗体对来自SNORD104过表达HEC1B细胞的裂解物的RIP测定显示,免疫沉淀物中SNORD104显著富集(图4A)。然而,SNORD104过表达不影响FBL蛋白水平(图4B)。
为了鉴定由SNORD104介导的2'O-甲基化调控的潜在靶基因,作者在对照和SNORD104过表达细胞中进行了NM-seq。如图4C所示,2ʹ-O-甲基化在928个甲基化位点(671个RNA)上调(倍数变化≥2)。据报道,小核仁RNA通常通过互补碱基配对来指导靶RNA的修饰。因此,作者将具有上调的 2'O-甲基化水平的 RNA 和具有 SNORD104 互补碱基配对片段的 RNA 相交。接下来,作者对这些高甲基化RNA进行了KEGG途径富集分析。结果显示,细胞凋亡相关通路排名第一。此外,作者分析了细胞凋亡途径中的富集RNA,CPTAC数据库显示其编码蛋白在子宫内膜癌组织中上调,包括ITPR3,LMNB1,PARP1,PARP4和TUBA1C。接下来,作者使用RIP测定来检测FBL蛋白是否与这5个RNA结合,并使用蛋白质印迹来检测由这5个RNA编码的蛋白质是否发生变化。结果表明,只有PARP1 mRNA与FBL蛋白结合(图4D),只有PARP1 mRNA和蛋白质水平发生变化(图4E,F)。因此,作者接下来分析了术后EC组织中PARP1的表达,并观察到SNORD104和PARP1表达水平之间存在正相关(图4G)。PARP1主要位于细胞核中,参与DNA损伤修复和核糖体生物发生。与此一致,SNORD104过表达增加了核级分中的PARP1蛋白水平。此外,SNORD104过表达异种移植物也显示出PARP1蛋白水平增加(图4I,J)。
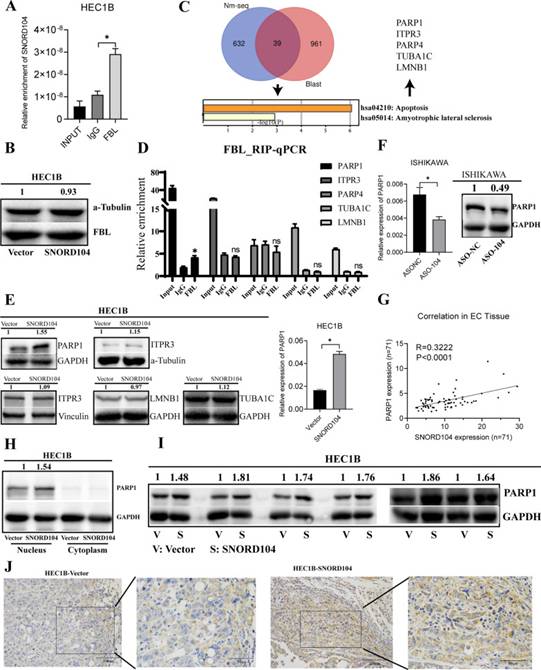
图4 SNORD104在体外和体内上调PARP1表达
接下来进行RTL-P测定以检测PARP1 mRNA中的2'-O-甲基化水平(图5A)。敲低和过表达SNORD104分别降低和增加PARP1 mRNA的2'-O-甲基化水平(图5B,C)。此外,SNORD104过表达HEC1B细胞中的FBL敲低降低了2'-O甲基化的PARP1 mRNA和PARP1蛋白水平(图5D,F)。核糖2'-O-甲基化在mRNA中的生物学作用尚不清楚,尽管有报道称它可以提高核酸对碱性或酶水解的稳定性,最有可能通过改变其物理和化学性质。为了验证这一假设,作者用转录抑制剂放线菌素D处理SNORD104过表达或敲低细胞。与对照组相比,SNORD104过表达细胞具有显著更高的PARP1 mRNA稳定性(图5G),而敲低SNORD104或FBL降低了PARP1 mRNA的稳定性(图5H,I)。
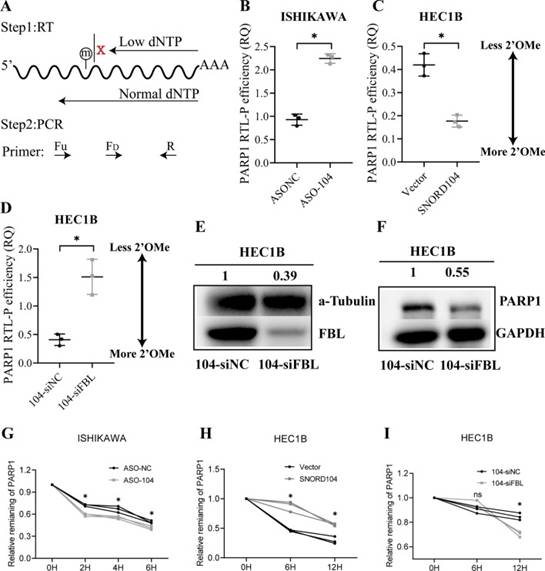
图5 SNORD104通过2'O-甲基化稳定PARP1 mRNA
5. SNORD104通过调节PARP1促进EC生长
PARP1在各种癌症中作为癌基因起作用。对TCGA和CPTAC数据集的搜索显示,EC组织中的PARP1 RNA和蛋白质水平显著增加(图6A)。此外,Kaplan-Meier分析显示PARP1的高表达与不良的总生存期相关(图6B)。验证SNORD104是否通过调节过表达SNORD104的HEC1B细胞中的PARP1、敲低FBL或PARP1发挥其致癌作用(图6C)。正如预期的那样,FBL或PARP1沉默逆转了SNORD104对增殖(图6D,E)、菌落形成(图6F)和EC细胞的凋亡(图6G)的影响。
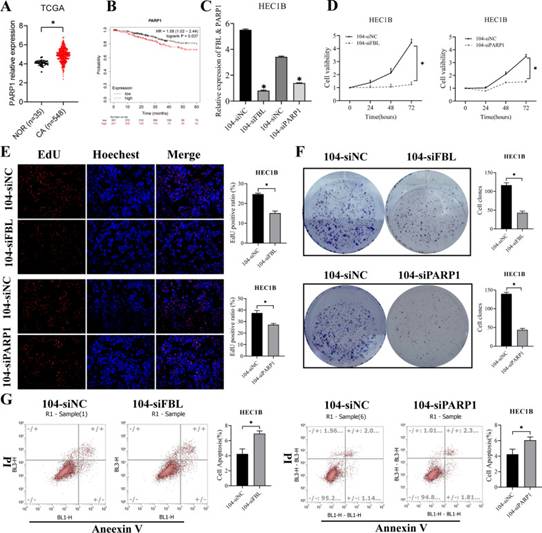
图6 敲低FBL或PARP1逆转了SNORD104的致癌作用
结论:
SNORD104在EC中上调,并通过诱导PARP1的2'O-甲基化来促进肿瘤生长,从而增强后者的表达和生物学功能。该研究结果为EC发生和进展的机制提供了新的见解,并为个体化治疗确定了新的治疗靶点。
参考文献:
Lu B, Chen X, Liu X, Chen J, Qin H, Chen S, Zhao Y. C/D box small nucleolar RNA SNORD104 promotes endometrial cancer by regulating the 2'-O-methylation of PARP1. J Transl Med. 2022 Dec 24;20(1):618. doi: 10.1186/s12967-022-03802-z.






