circCsnk1g3和circAnkib1调控的干扰素反应在肉瘤中通过塑造免疫微环境促进肿瘤发生
外显子环状RNA(circRNAs)主要产生非编码RNA,最近已在许多肿瘤中被发现。然而,它们对癌症进展的功能贡献仍然知之甚少。在这里,作者鉴定了在软组织肉瘤细胞中表达的circRNA,并探索circRNA如何在体内调节肉瘤的生长。作者发现circCsnk1g3和circAnkib1通过形成促肿瘤微环境来促进肿瘤生长,这可能是由于它们能够调节肿瘤细胞外部的促肿瘤因子。因此,circCsnk1g3和circAnkib1可以控制肉瘤细胞中干扰素相关基因和促炎因子的表达,从而引导免疫细胞募集到肿瘤块中,从而激活它们。在机制上,circRNA可能通过缓冲RIG-I介导的通路激活来抑制促炎因子,RIG-I是细胞质病毒RNA传感器。目前的研究结果表明,靶向特定的circRNA可以增强肿瘤的疗效和对主流疗法的免疫应答。本研究于2022年11月25日发表于《nature communication》,IF:17.694。
技术路线:
主要研究结果:
1、CircAnkib1和circCsnk1g3促进肉瘤在体内生长
为确认circRNAs在肉瘤中的表达和功能作用,作者使用了一个同基因肉瘤小鼠模型,通过对间充质干细胞中Trp53和Ccne1基因的遗传操作,作者产生了p53KOCcne1+细胞,并使用荧光蛋白标记示踪(dsRED)。随后,将产生的p53KOCcne1+细胞接种在生物惰性的3D支架上,并移植到同系受体小鼠的皮下(图1a)。为确保从RNA - seq中鉴定的circRNAs在肉瘤细胞中表达,而不是在肿瘤微环境的细胞中表达。作者从生长的肿瘤中分离dsRED标记的肉瘤细胞,并通过体外RT-qPCR来评估circRNAs的表达(附图1b)。确定12个候选circRNAs在肉瘤细胞中的特异性表达后,作者评估了这些候选circRNA在恶性细胞(p53KOCcne1+)中的表达是否高于类似的非致瘤细胞(p53KO间充质细胞)。虽然12个circRNAs在肉瘤细胞中的平均表达量均高于非恶性间质细胞,但其中6个circRNAs(circCamsap1、circRad23b、circBnc2、circRere、circAnkib1和circCsnk1g3)在肉瘤中显著上调(附图1c)。而且,这6个circRNAs具有标准circRNA的特征。经RT-qPCR分析,作者选择了三个顶级circRNA(circAnkib1、circCsnk1g3和circBnc2)。circAnkib1、circCsnk1g3和circBnc2在小鼠模型中进行功能研究(图1b)。重要的是,这3个circRNAs的人类类似物不仅在UPS中被检测到,而且在其他亚型的软组织肉瘤中也被检测到(图1c)。
针对每一个circRNA,作者设计了表达靶向circRNA绳头插接连接处的shRNA的慢病毒载体来敲除它们。重要的是,这些shCircRNAs是专门设计的,只与绳头插接连接的序列杂交,而使线性转录本不受影响(图1d,左)。shCircRNA vs shSCR肉瘤细胞(图1d,右)的qPCR证实circRNA的特异性和高效敲低,表明shCircRNA细胞中环状而非线状RNA表达减少。由于这些circRNAs在恶性细胞中显著上调,作者推测它们可能影响肿瘤的发生过程。为评估这种体内效果,将p53KOCcne1+肉瘤细胞(其中circAnkib1、circCsnk1g3和circBnc2的表达被沉默)移植到同基因免疫功能正常小鼠皮下或肺中生成肉瘤。对照组皮下肿瘤长至约1 cm3,20 d后取肺组织。值得注意的是,当circCsnk1g3和circAnkib1在肉瘤细胞中被沉默时,与对照组相比,皮下肿瘤的体积显著减小(图1e),肿瘤内dsRED+肿瘤细胞的比例降低(图1F)。此外,当同样的circCsnk1g3和circAnkib1沉默的肉瘤细胞静脉注射到尾静脉时,它们在肺中均表现出明显减少的肿瘤细胞和肿瘤灶数量(图1g-h)。circBnc2的沉默仅轻微影响皮下肉瘤细胞的生长(图1e),并不影响肺内肿瘤负荷(图1g)。虽然circAnkib1和circCsnk1g3的沉默对体内肿瘤生长有显著影响,但使用针对线性异构体的shRNA沉默线性Ankib1和Csnk1g3转录本并不影响肿瘤生长(图1i-j)。这些结果说明,来自同一基因的线性和环状转录本(共享部分核苷酸序列)在癌症中可以独立发挥作用。此外,这些数据表明CircAnkib1和circCsnk1g3可以促进肉瘤在体内生长。
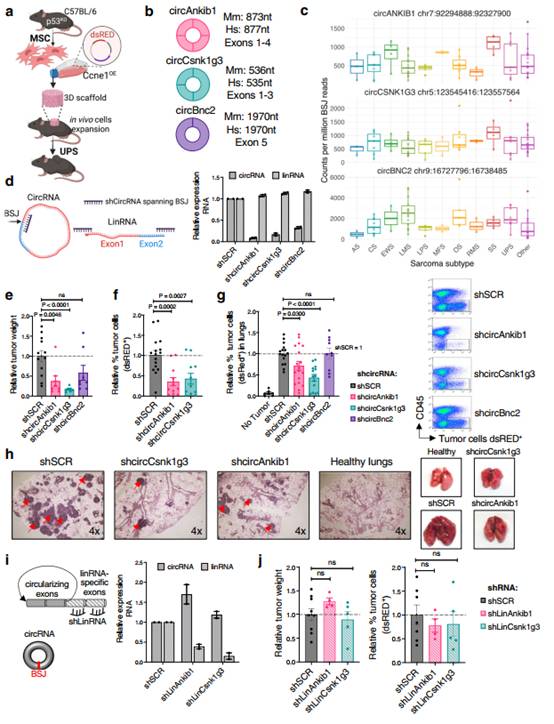
图1CircAnkib1和circCsnk1g3促进肉瘤在体内生长
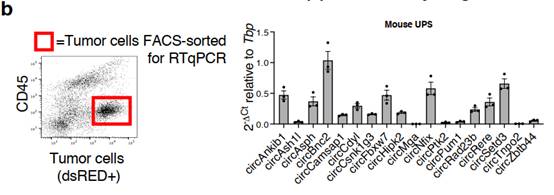
附图1b
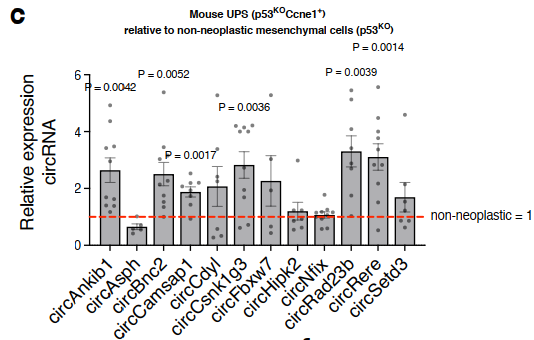
附图1c
2、circRNAs在肿瘤细胞中调节干扰素信号和促炎细胞因子的表达
为探究circCsnk1g3和circAnkib1如何促进肉瘤生长,作者研究这些circRNA在肉瘤细胞中调控的肿瘤相关通路。基因集富集分析显示,敲低circAnkib1和circCsnk1g3后,I型和II型干扰素的产生和应答相关的信号通路上调(图2a)。与此一致,作者对筛选出的基因进行RT-qPCR发现沉默circAnkib1和circCsnk1g3后,肿瘤细胞中干扰素相关基因(如Ifit3、Isg15、Ifih1、Oasl2、Irf7等)和促炎细胞因子(如Cxcl10、Cxcl9、Ccl3和Ccl5)的表达增加(图2b)。为验证这些观察结果是否可以在蛋白水平得到证实,作者在circCsnk1g3沉默的细胞上使用了反相蛋白质芯片(RPPA)。随后进行WB验证,发现在circCsnk1g3沉默的肉瘤细胞中,与对照组相比,RPPA上调了NF κB、干扰素调节因子(IRFs)和胰岛素受体底物(IRSs)的表达,这些因子通过干扰素信号通路发挥作用(图2c)。有趣的是,尽管表达这些炎症因子,沉默circCsnk1g3的细胞表达的STAT1比对照细胞少。这表明circCsnk1g3沉默细胞中炎症机制的激活可能来源于细胞内信号;有趣的是,通路分析显示细胞内病毒RNA感应机制上调(图2a)。同时,对照细胞表达更多的STAT3和STAT5,其中STAT3是IL - 10和IL - 6诱导信号的主要中介,而STAT5与抑制抗肿瘤免疫和减少肿瘤对IFNα刺激的反应有关。此外,WB结果显示,在circCsnk1g3和circAnkib1沉默的肿瘤细胞中,干扰素和炎性细胞因子转录的关键信号元件IRF1和pTBK的表达增强,与RNA水平的数据一致(图2d)。重要的是,促炎通路的表达增加是由circRNA沉默所特有的,而线性转录本的敲低并没有表现出这种效应,甚至有相反的趋势。
接下来,作者旨在研究这些circRNA在肉瘤细胞中调控干扰素和促炎信号的分子机制。circAnkib1和circCsnk1g3都具有抗炎能力,因此,作者推测circAnkib1和circCsnk1g3可以与dsRNA(模式识别受体和抗病毒免疫介质的双链RNA)结合蛋白相互作用,如PKR、MDA5和RIG - I。由于这些病毒RNA感应机制主要是细胞质,作者首先采用细胞核/细胞质分离的方法,确定circAnkib1和circCsnk1g3也优先定位于细胞质(图2f)。RNA靶向荧光原位杂交(一种用来区分圆形和线性RNA异构体的特别技术,circFISH)确认细胞质定位(图2g-h)。通过RNase - R处理线性RNA降解来验证circFISH信号的环状和线性特异性(图2i)。
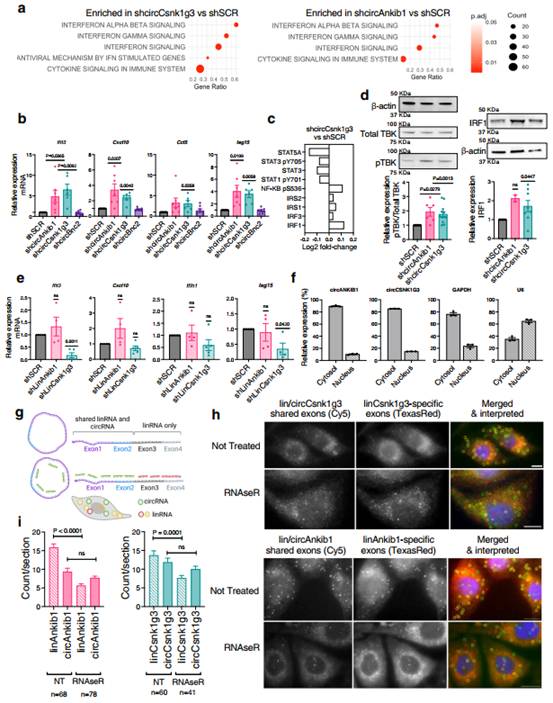
图2 circRNAs在肿瘤细胞中调节干扰素信号和促炎细胞因子的表达
3、circRNA通过RIG-I调控干扰素基因的表达
除PKR外,其他几种蛋白(MDA5、RIG - I)具有与病毒RNA结合并触发干扰素和炎症反应的能力。因此,作者研究MDA5和RIG - I是否也能感应内源性circRNA。首先,作者通过检测MDA5和RIG - I沉默后的干扰素信号来评估这些蛋白在肉瘤细胞中的活化状态。Ddx58(编码RIG - I)的敲低显著降低肿瘤细胞中干扰素信号和促炎细胞因子的表达(图3a)。相反,Ifih1(编码MDA5)的沉默仅轻微改变这些元件的表达(图3b)。因此,作者进一步研究circRNAs抑制炎症信号的能力是否依赖于RIG - I。作者构建RIG - I shRNA沉默(RIG-I KD)的肉瘤细胞,与RIG - I野生型(RIG - I WT)细胞相比,作者检测circRNAs在RIGI KD细胞中调节炎症信号的能力。当分别沉默circCsnk1g3或circAnkib1后,RIG-I WT细胞中干扰素相关基因和促炎因子均增加,与预期一致(图3c)。然而,这种增加在RIG - I KD条件下被显著抑制(图3c)。
由于RIG - I可以直接结合病毒RNA,作者接下来试图确定circRNA是否也可以与RIG - I发生物理相互作用。采用反向下拉评估RIG-I和circRNA的相互作用
RIG - I免疫沉淀后,对下拉材料进行RT-qPCR检测,发现circCsnk1g3和circAnkib1富集(图3d)。RIG - I与circRNAs的相互作用也由间歇拉片反向评估,采用改编形式的CRISPR - assisted RNA-protein interaction detection(CARPID)。简而言之,在肉瘤细胞中表达与生物素连接酶BASU融合的催化死亡Cas Rx蛋白( BASU-dCasRx ),同时靶向circRNA的剪接连接处的sgRNAs引导BASU-dCasRx在circCsnk1g3和circAnkib1附近的蛋白质上添加生物素残基(图3e)。当生物素下拉时,可以在与circCsnk1g3和circAnkib1相互作用的生物素化蛋白中可以检测到RIG – I(图3f)。
为进一步验证RIG – I是肉瘤细胞干扰素信号和炎症因子表达的主要启动子,且内源性circRNA可能降低其激活,作者研究了在p53KOCcne1+肉瘤细胞中存在内源性dsRNA,它们触发炎症活动,以及内源性circAnkib1和circCsnk1g3限制病毒模拟反应的可能性(图3g)。与这些假设一致,dsRNA在稳态的肉瘤细胞中检测到(用J2抗体)(图3h),并且在abemaciclib(CDK4/6抑制剂)处理后进一步升高(图3i)。此外,abemaciclib处理除了增加dsRNA表达外,还增加肉瘤细胞中干扰素和促炎因子的表达(图3j)。最后,在abemaciclib处理的肉瘤细胞中,circCsnk1g3的沉默进一步增加这些基因的表达(图3k),表明靶向circRNAs可以增强abemaciclib对肉瘤细胞病毒模拟反应的影响,并可能对抗肿瘤免疫产生影响。因此,circAnkib1和circCsnk1g3通过RIG - I介导的途径调节肉瘤细胞中干扰素和促炎信号的表达。

图3circRNA通过RIG-I调控干扰素基因的表达
为验证circCsnk1g3和circAnkib1通过影响肿瘤微环境中的整体免疫景观来调节肿瘤生长的可能性,作者对circCsnk1g3表达或沉默的p53KOCcne1+细胞产生的肉瘤TME进行比较分析。首先,流式细胞术检测肿瘤与免疫细胞的比例。与对照组相比,circCsnk1g3沉默的肿瘤细胞与T细胞(CD4+和CD8+)的比例显著降低(图4a)。然后,为更好地确定这些肿瘤中浸润的免疫细胞的亚型,并表征circCsnk1g3在肿瘤细胞中敲低后的转录变化,作者对肿瘤细胞进行单细胞RNA测序(scRNA-seq),用Chromium平台(10X Genomics)解离并捕获皮下肉瘤(shSCR和shCircCsnk1g3,每组n = 4只小鼠)。(图4b)。通过硅质控制去除死细胞和双胞体,作者鉴定出9个跨条件检测到的高水平簇,代表肿瘤细胞和TME的主要细胞群(图4c)。根据之前发表的标记对主要的免疫TME亚群进行注释后,作者通过单独的亚聚类将NK和T淋巴细胞作为重点(图4d)。
作者比较了每种条件下每种细胞类型的相对丰度和不同条件下每种细胞类型的表达谱的变化。区分4个CD4+ T细胞群,包括表达Foxp3、Il2ra、Ikzf2、Tnfrsf4和Ctla4的调节性T细胞(Treg)和表达Ramp3、Rora和Odc1的CD4+辅助性T细胞(Th)。作者鉴定了两群表达Foxp1和Lef1以及Ccr7或Tcf7的幼稚型CD4+ T细胞。同时检测表达Gzmk、Cxcr6、Ccl5、Grap2或NK受体Klra6、Klra7、Klrk1、Klrd1的细胞毒性CD8+细胞。此外,单独的CD8+ T细胞群表现出耗竭标志物Lag3和Pdcd1。通过比较这些细胞类型在不同条件下的相对丰度,作者发现沉默circCsnk1g3与Treg和耗竭性CD8+ T细胞的减少趋势相关;相反,细胞毒性CD8+ T细胞则呈现相反的趋势(图4e)。检测不同条件下的差异表达基因,作者发现在沉默circCsnk1g3的肿瘤中,与对照肿瘤相比,CD4+ T细胞平均表达更低水平的Treg相关基因,包括Tnfrsf9、Tnfrsf4、Ikzf2、Il2ra和Ctla4(图4f)。更重要的是,免疫荧光染色证实,circRNA-KD肿瘤内肿瘤实质中CD3+ T细胞浸润增加,而对照肿瘤中T细胞主要聚集在肿瘤边缘(图4g-h)。这些观察结果证实circRNA沉默可以增强抗肿瘤T细胞反应。接下来,为进一步证实T细胞参与circRNA介导的功能,作者比较WT和circRNA沉默的肉瘤细胞在不携带T淋巴细胞的免疫缺陷裸鼠体内的生长情况。在免疫正常小鼠中,circCsnk1g3和circAnkib1的沉默降低肿瘤的生长(图1),而在免疫缺陷小鼠品系中,circRNAs的沉默不影响肿瘤的生长(图4i),表明包括T细胞在内的完整功能的免疫系统是这些circRNAs发挥促肿瘤作用是必要的。
这些数据表明,在肉瘤细胞中沉默circCsnk1g3显著改变整个TME免疫景观,从细胞群体的相对数量、它们的转录活性和T细胞在肿瘤边界以外的浸润到更低的肿瘤允许条件,这可能有助于观察到的肿瘤生长减少。
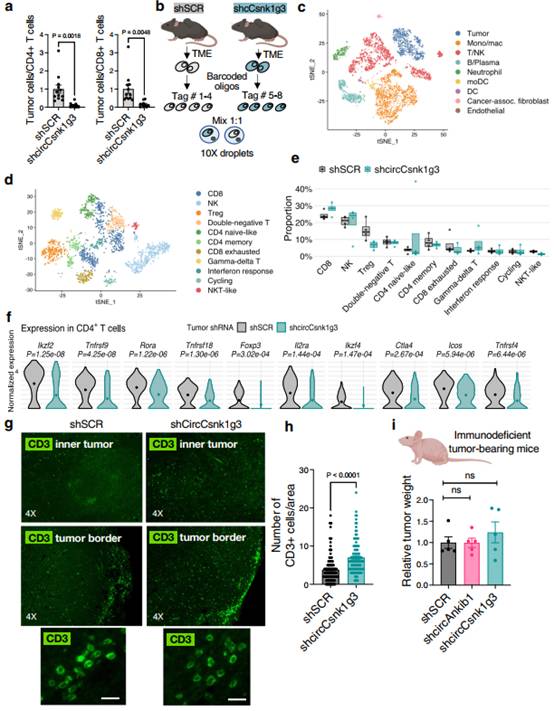
图4靶向肿瘤细胞中的circRNAs重塑肿瘤微环境
结论:
circCsnk1g3和circAnkib1通过限制肿瘤细胞中干扰素和促炎镜子的表达来促进肉瘤的生长。这一作用阻碍肿瘤块内免疫细胞的招募和激活,从而促进肿瘤微环境的形成。
参考文献:
Piras R, KO EY, Barrett C, De Simone M, Lin X, Broz MT, Tessaro FHG, Castillo-Martin M, Cordon-Cardo C, Goodridge HS, Di Vizio D, Batish M, Lawrenson K, Chen YG, Chan KS, Guarnerio J(2022). circCsnk1g3- and circAnkib1-regulated interferon responses in sarcoma promote tumorigenesis by shaping the immune microenvironment. Nat Commun. 2022;13(1):7243. doi: 10.1038/s41467-022-34872-8.






