Rab31通过Twist1介导的EMT促进胃腺癌转移和顺铂耐药
胃腺癌(STAD)是全球癌症相关死亡的主要原因之一。转移和耐药是目前化疗失败的两个主要原因。在这里,我们发现Rab31在人类STAD组织中表达上调,Rab31的高表达与低生存率密切相关。此外,我们发现Rab31促进人类STAD细胞的顺铂耐药和转移。降低Rab31表达诱导STAD细胞凋亡,增加顺铂敏感性;Rab31过表达的结果相反。Rab31的沉默阻止了STAD细胞的迁移,而Rab31的过表达增加了转移潜力。进一步的研究表明Rab31通过上皮-间充质转化(EMT)途径介导顺铂耐药和转移。此外,我们发现Rab31过表达和顺铂处理都会导致Twist1表达增加。Twist1的缺失增强了STAD细胞对顺铂的敏感性,这不能通过Rab31的过表达完全逆转。Rab31通过激活Stat3和抑制MUC-1激活Twist1。本研究还表明,敲除Rab31可抑制STAD模型小鼠的肿瘤生长。这些结果表明Rab31是一种新的、有前景的生物标志物和潜在的治疗靶点,可用于STAD的诊断、治疗和预后预测。我们的数据不仅发现了一种新的Rab31/Stat3/MUC-1/Twist1/EMT通路在STAD转移和耐药中的作用,而且为未来探索预测和治疗STAD的新策略提供了方向。本文于2023年2月发表于“Cell Death and Disease”(IF=9.685)上。
技术路线
结果
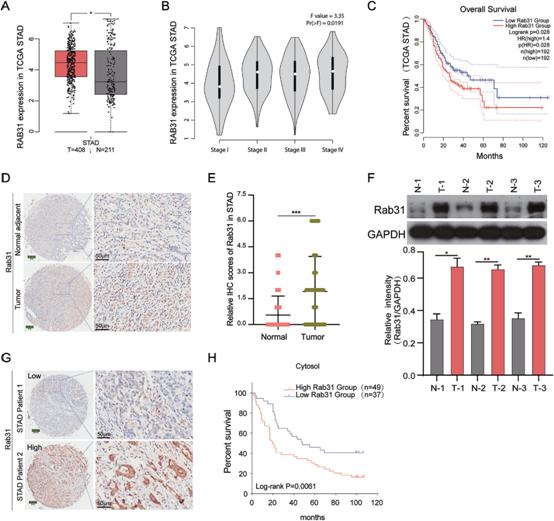
1)Rab31高表达与STAD患者预后不良相关
我们通过分析TCGA数据库中408个STAD组织和211个正常组织的RNA-Seq数据来评估Rab31的mRNA水平。与正常组织相比,STAD肿瘤组织中Rab31的表达明显升高(图1A),并且随着STAD从I期到IV期的进展,Rab31的表达增加,在IV期Rab31的表达最高(图1B)。此外,Rab31水平高的STAD患者OS较差(图1C)。为了进一步评估Rab31在STAD中的表达,我们采用免疫组化方法检测了人STAD组织芯片中Rab31的蛋白水平。与邻近正常组织相比,肿瘤组织中Rab31明显上调(图1D, E)。我们还通过western blot检测了临床收集的组织中Rab31蛋白的水平,证实在STAD组织中Rab31明显高于相应的正常组织(图1F)。Rab31水平高的患者10年生存率为43%,Rab31水平低的患者10年生存率为57%,进一步证实了Rab31水平高与STAD患者生存率差密切相关(图1G-H)。这些数据表明,Rab31在STAD组织中表达上调,其高表达与STAD患者预后不良相关。
2)Rab31促进人STAD细胞的细胞迁移和调节顺铂敏感性
鉴于对顺铂耐药是STAD预后不良的一个主要原因,我们试图确定Rab31是否参与了STAD的顺铂耐药。我们利用了三种人STAD细胞系:MGC-803、BGC-823和AGS。Rab31在MGC-803细胞中表达最低,AGS细胞中表达最高(图2A)。顺铂治疗后,所有三种人STAD细胞的细胞活力均呈剂量依赖性下降(图2B,左)。有趣的是,AGS细胞对顺铂的耐药性最高(图2B,右)。IC50与Rab31表达水平呈显著正相关(图2C)。这些结果提示Rab31的表达可能会限制顺铂在STAD细胞中的抗肿瘤活性。为了测试Rab31是否抑制顺铂的有效性,我们首先检测了Rab31在顺铂处理的细胞中的表达是如何改变的。western blot结果显示,在顺铂处理的三种人STAD细胞系中,Rab31蛋白水平均显著升高(图2D)。在三种STAD细胞中,过表达Rab31的细胞(Rab31OE)均显示Rab31蛋白水平显著升高,Rab31 siRNA显著降低Rab31的表达(图2E, F,下)。Rab31过表达导致顺铂处理的所有三种STAD细胞系的剂量-反应曲线向上移位,这表明Rab31的增加增强了顺铂处理的STAD细胞的细胞活力(图2E,上)。此外,三种STAD细胞系Rab31表达的降低导致顺铂治疗剂量-反应曲线向下移位,表明Rab31低表达可增加顺铂敏感性(图2F,上)。通过Annexin V/PI染色检测细胞凋亡,进一步检测Rab31表达对顺铂耐药的影响。在IC50浓度顺铂作用48 h后,所有STAD细胞均发生早期和晚期凋亡(图2G)。Rab31下调显著增加顺铂诱导的凋亡。有趣的是,这种效应在内源性Rab31水平较高的AGS细胞中最为明显(图2H)。此外,过表达Rab31在这三种细胞系中都减少了顺铂诱导的凋亡。接下来,我们通过集落形成法和transwell法研究Rab31对STAD细胞长期增殖能力和转移的影响。Rab31的下调抑制了所有三种STAD细胞系的集落形成,而Rab31的过表达则促进了肿瘤集落的形成(图2I-2L,上)。在transwell试验中,Rab31的沉默阻止了STAD细胞的迁移,而Rab31的过表达增加了转移潜力(图2I-2L,下)。结果表明Rab31可能促进人STAD细胞的克隆性生长和转移。

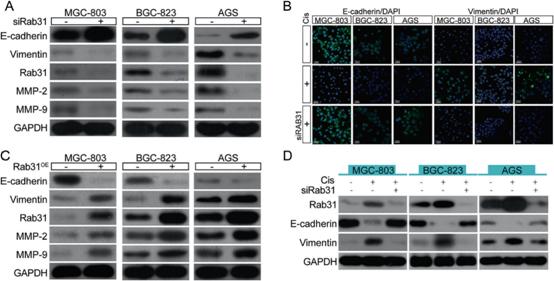
3)Rab31通过EMT促进转移和顺铂耐药
在人类癌症中,EMT是一个与肿瘤进展、转移和治疗耐药性相关的关键细胞过程。为了确定EMT是否参与了Rab31诱导的STAD转移和顺铂耐药,我们在人类STAD细胞系中检测了Rab31表达改变时上皮细胞标志物和间充质细胞标志物的表达。如图3A所示,在所有三种STAD细胞系中,Rab31的下调导致上皮标志物E-cadherin蛋白表达水平升高,间充质标志物(vimentin, MMP-2和MMP-9)表达降低。相反,Rab31过表达导致EMT表现为vimentin、MMP-2和MMP-9表达增加,E-cadherin表达缺失(图3C)。然后我们探讨了顺铂治疗如何影响EMT。IC50浓度的顺铂作用于人STAD细胞24小时后,E-cadherin表达降低,vimentin表达增加,提示顺铂诱导EMT(图3B,D), Rab31 siRNA逆转顺铂诱导的EMT过程。这些结果表明,顺铂治疗期间Rab31表达增加可能促进EMT,从而增强STAD细胞的迁移和转移能力,导致顺铂耐药。
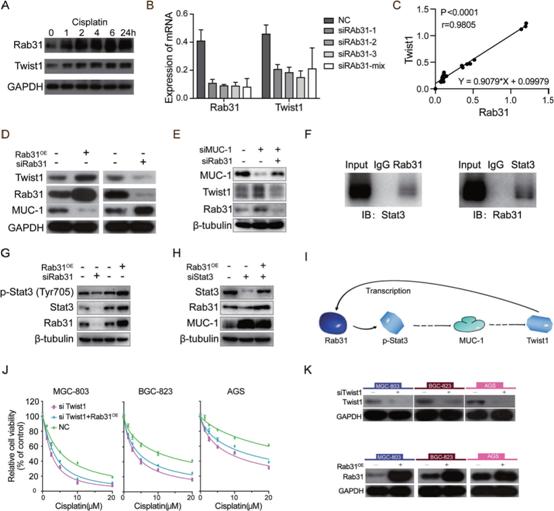
4)Rab31通过靶向MUC-1促进twist1介导的EMT
为确定可能参与Rab31介导的STAD顺铂耐药的EMT-TFs,利用GEPIA在线工具计算EMT-TFs表达与Rab31的相关性。结果显示,EMT-TFs (TWIST1, SNAI1, SNAI2, ZEB1, ZEB2)与Rab31呈正相关(补充图)。大量研究报道,与非癌性组织相比,Twist1在STAD中过表达,且Twist1高表达与进展不良相关。然后,我们检测Twist1是否是连接Rab31与EMT和顺铂耐药的关键因子。Western Blot结果显示,顺铂作用于AGS细胞后,Rab31和Twist1的表达呈时间依赖性增加(图4a)。此外,敲低Rab31可降低AGS细胞中Twist1 mRNA的表达(图4B), Twist1与Rab31的表达水平呈正相关(图4C)。有研究表明沉默MUC1-C可以抑制Twist1,从而逆转三阴性乳腺癌中的紫杉醇耐药。在这里,我们研究了STAD细胞中MUC-1是否参与Rab31-Twist1信号轴。过表达Rab31导致AGS细胞中Twist1蛋白水平上调,MUC-1蛋白水平下调,而敲低Rab31则降低Twist1蛋白水平,MUC-1蛋白水平升高(图4D)。此外,通过western blot检测,MUC-1的敲除增加了AGS细胞中Twist1和Rab31的表达,而MUC-1/Rab31的双敲除逆转了这些变化(图4E)。这些数据表明Rab31可能通过抑制MUC-1激活Twist1(图4I)。然而,共免疫沉淀显示Rab31在AGS细胞中不直接与Twist1或MUC-1相互作用(补充图)。先前的研究报道MUC-1可以通过Stat3起作用。我们的数据显示Rab31直接与Stat3相互作用(图4F)。此外,Rab31敲低导致Stat3和p-Stat3蛋白水平下调,而过表达Rab31则增加了AGS细胞中Stat3和p-Stat3蛋白的表达(图4G)。通过western blot检测,Stat3敲低能够下调Stat3水平,增加AGS细胞中MUC-1的表达,而过表达Rab31则逆转了这些变化(图4H)。我们的结果表明MUC-1是Stat3的下游靶点。接下来,我们研究了Rab31/Stat3/MUC-1/Twist1信号通路与STAD顺铂耐药的关系。Twist1沉默增强了STAD细胞顺铂诱导的死亡(图4J, K)。Rab31过表达仅轻微逆转了Twist1敲低的作用。
5)Rab31沉默在体内抑制肿瘤生长
最后,我们探究了Rab31表达水平对体内肿瘤生长的影响。动物实验流程如图5A所示。与对照组相比,敲低Rab31抑制肿瘤生长的效果与顺铂治疗相当(图5B, E)。顺铂联合Rab31 siRNA治疗对肿瘤生长的抑制作用最强(图5B, C)。不同治疗组之间体重无差异,说明肿瘤大小的变化不是由于体重的变化(图5D)。肿瘤组织HE染色和Ki67染色检测肿瘤细胞增殖情况。同时使用顺铂和Rab31敲低治疗可以显著减少肿瘤细胞的增殖(图5F, G),提示Rab31是一个潜在的治疗靶点,可以与顺铂联合治疗STAD。

结论:
Rab31通过Stat3/MUC-1/Twist1介导的EMT促进STAD细胞的转移和对顺铂治疗的耐药性。我们的数据不仅确定了STAD转移和耐药性的新途径,而且还指导我们探索未来预测和治疗STAD的新策略。
参考文献:
Chen K, Xu J, Tong YL, Yan JF, Pan Y, Wang WJ, Zheng L, Zheng XX, Hu C, Hu X, Shen X, Chen W. Rab31 promotes metastasis and cisplatin resistance in stomach adenocarcinoma through Twist1-mediated EMT. Cell Death Dis. 2023 Feb 13;14(2):115. doi: 10.1038/s41419-023-05596-4.






