外泌体circTUBGCP4通过激活Akt信号通路促进血管内皮细胞生成和结直肠癌转移
结直肠癌是我国发病率和死亡率最高的恶性肿瘤之一。转移是结直肠癌患者高死亡率的主要原因。新生血管形成和血管生成是生理系统中转运营养物质的稳态过程。然而,稳态在肿瘤组织中被破坏。瘤内血管过度生长形成紊乱和不稳定的血管网,加速了肿瘤的生长、侵袭和转移。近年来,越来越多的研究报道外泌体可以作为细胞间通讯的良好媒介,改变肿瘤微环境,导致肿瘤转移。此外,来自癌细胞或其他细胞外泌体中的非编码RNA在血管生成和肿瘤转移中发挥重要作用。据报道,circRNA在外泌体中富集且稳定,可能是一种有前景的癌症诊断生物标志物。然而,外泌体circRNA在肿瘤血管生成和转移中的作用尚不清楚。该研究发表在《Journal of Experimental & Clinical Cancer Research》,IF:12.658。
研究路线:

主要研究结果:
1. CRC-CDEs促进HUVECs的迁移、管腔形成和丝状伪足形成
为了研究CRC-CDEs在血管生成中的作用,作者首先进行了外泌体的分离和鉴定。差速离心法分离HCT116细胞和SW480细胞上清液来源的外泌体(图1a)。 蛋白质印迹法检测未裂解的HCT116-Exo和SW480-Exo中外泌体生物标志物(CD9、CD63、TSG-101)(图1b)。透射电镜结果显示,HCT116和SW480的囊泡呈球状,呈典型的杯状。此外,HCT116-Exo比SW480-Exo大(图1c)。NTA结果显示HCT116-Exo的平均大小也高于SW480-Exo(图1d)。然后,将1×107个HCT116细胞PKH67标记的外泌体加入HUVECs(图1e)。共聚焦成像显示HCT116-Exo和SW480-Exo在细胞质中聚集,提示外泌体在3h时被HUVECs摄取(图1f)。为确保HCT116-Exo和SW480-Exo的作用,分别用10μg和30μg外泌体孵育HUVECs。48h后,transwell实验显示,与PBS处理相比,不同浓度的HCT116-Exo和SW480-Exo处理显著增强HUVECs的迁移和管腔形成(图1g-i)。在SW480-Exo处理组中显示了类似的趋势(图1h-i)。为了确定外泌体对HUVECs迁移的影响是否是由于HUVECs形态的改变,作者使用鬼笔环肽标记HUVECs中的F-肌动蛋白。有趣的是,共聚焦成像显示HUVECs吸收HCT116-Exo和SW480-Exo后出现丝状伪足(黄色点标记)(图1j)。这些结果表明,CRC细胞来源的外泌体增强HUVECs的迁移和管形成能力,提示CRC-CDEs可以重塑受体细胞。

图1CRC-CDEs促进HUVECs的迁移、管腔形成和丝状伪足形成
2. CRC-CDEs促进HUVECs尖端细胞的形成
基于CRC-CDEs改变HUVECs形态的结果,作者推测CRC-CDEs可能诱导芽孢形成和尖端细胞分化。据报道,整合素β1和VEGFA参与血管的生长和成熟,对有效的内皮芽形成是必需的。作者发现,与PBS处理相比,高HCT116-Exo和SW480-Exo处理导致高整合素β1和VEGFA表达(图2a)。CD34是一种公认的尖端细胞标记物,显示出丝状伪足延伸以促进血管生成芽。因此,作者通过免疫荧光和蛋白质印迹法检测CRC-CDEs处理后CD34的表达。蛋白质印迹结果显示,与PBS处理相比,HCT116-Exo和SW480-Exo处理后CD34高表达(图2a)。免疫荧光图像显示,HCT116-Exo组和SW480-Exo组的CD34强度高于PBS组(图2b)。为了确保CD34在CRC样本中的表达,作者使用GEO数据集进行分析。结果显示,与正常组织相比,CD34在CRC组织中显著高表达(图2c)。此外,作者发现CD34在GSE39582中的表达在N1、N2和N3组中逐渐升高。与M0组相比,M1组的CD34表达也较高,并且显示出较差的总生存期和无复发生存期(图2d和e)。这些数据表明,CRC-CDEs通过上调VEGFA,整合素β1和CD34的表达促进尖端细胞形成,并预测CRC转移和CRC患者的不良预后。

图2CRC-CDEs促进HUVECs尖端细胞的形成
3. circTUBGCP4的上调与结直肠癌的血管生成和转移相关
为了研究CRC-CDEs来源的circRNA在促进血管生成驱动肿瘤转移中的作用,作者比较了转移和非转移CRC患者血清外泌体中circRNA的表达水平。与非转移组相比,转移组血清外泌体中有70个circRNA表达上调,59个circRNA表达下调(图3c)。利用人血外泌体中circRNA、lncRNA和mRNA数据库exoRBase筛选的circRNA。然后通过HCT116-Exo、exoRBase和血清-exo中表达量最高的前20个circRNA的3个数据集选择外显子hsa_circRNA_101501和has_circRNA_104109(图3d)。与HUVECs相比,HCT116和SW480中circ101501表达量的变化倍数高于circ104109(图3e)。因此,作者选择了circ101501,并将其更名为circTUBGCP4,其父基因为TUBGCP4。
首先,作者通过sanger测序鉴定了circTUBGCP4的环状结构,通过发散引物(divergent primer, DP)和收敛引物(convergent primer, CP)进行了验证,并通过放线菌素D实验进行了验证。sanger序列结果表明,PCR产物包含使用DP的反剪接序列(图3f)。以cDNA为PCR模板时,DP可以扩增产物,而以gDNA为PCR模板时,DP不能扩增产物(图3g)。放线菌素D实验表明,circTUBGCP4比TUBGCP4更稳定(图3h)。这些结果证明了circTUBGCP4是一个环状结构。为了探索circTUBGCP4在CRC中的表达及其与血管生成和转移的关系,作者使用GEO数据集和临床队列(n=20对)进行分析。GSE126094数据显示,与邻近正常组织(AN)相比,circTUBGCP4在原发肿瘤中显著上调(图3i)。在GSE147597中,与非肝转移相比,circTUBGCP4在肝转移中被发现高表达(图3j)。此外,临床队列的ISH结果显示,有淋巴结转移的原发肿瘤中的circTUBGCP4高于邻近正常组织(图3k)。此外,作者发现与低circTUBGCP4组相比,高circTUBGCP4组中CD31和CD34的表达较高(图3l)。circTUBGCP4高表达可能与肿瘤血管生成和转移有关。

图3CRC-CDEs中的CircTUBGCP4与CRC的血管生成和转移相关
4. 沉默外泌体circTUBGCP4可抑制尖端细胞形成、血管生成和肿瘤转移
为了探究外泌体circTUBGCP4在HUVECs中的生物学功能,作者首先要确保外泌体circTUBGCP4能够被HUVECs吸收。作者分离出HCT116-Exo和SW480-Exo来孵育HUVECs 6h和12h。作者发现,与没有外泌体处理的组相比,circTUBGCP4在HCT116-Exo-6h组和SW480-Exo-6h组中上调(图4a)。这些结果验证了肿瘤细胞来源的circTUBGCP4可能通过组装成外泌体进入HUVECs。在HCT116和SW480中构建circTUBGCP4敲低的稳定细胞株。结果显示,与shNC组相比,circTUBGCP4-01和shcircTUBGCP4-02组中circTUBGCP4显著下调,而其亲本基因无变化(图4b)。然后,作者从稳定细胞系中提取外泌体,研究其对HUVECs的生物学效应。管形成实验表明,敲低exo-circTUBGCP4显著降低了HUVECs中的节点数量(图4c)。Transwell实验显示,下调exo-circTUBGCP4可降低细胞迁移能力(图4d)。细胞划痕实验显示,与shNC组相比,shcircTUBGCP4-01和shTUBGCP4-02组的愈合速度较慢(图4e-f)。蛋白质印迹结果显示,在shcircTUBGCP4-Exo处理的HUVECs中,CD34、整合素β1和VEGFA的表达下调(图4f)。此外,免疫荧光结果显示,来自HCT116和SW480的Exo-ShCirc-01和ShCirc-01组中CD34低表达(图4g)。为了评估外泌体circTUBGCP4对体内血管生成和肿瘤转移的潜在贡献,作者首先注射HCT116细胞,两周后通过尾静脉注射来自Sh-NC和Sh-Circ-02组的外泌体(图5a)。结果表明,与PBS和HCT116Exo-Sh-Circ-02相比,HCT116Exo-Sh-NC导致肺结节增加(图5b-c)。此外,HCT116Exo-Sh-NC组肺结节内血管数量增加,HCT116Exo-Sh-Circ-02组肺结节内血管数量减少(图5d-e)。这些结果证明外泌体circTUBGCP4可诱导尖端细胞形成、血管生成和肿瘤转移。

图4外泌体circTUBGCP4促进HUVECs尖端细胞形成、迁移和管腔形成

图5过表达circTUBGCP4促进血管生成和肿瘤转移
5. 过表达circTUBGCP4促进尖端细胞形成、血管生成和肿瘤转移
为了在体外和体内评估circTUBGCP4效应的潜在贡献,作者首先构建了circTUBGCP4的过表达质粒和慢病毒。接下来,作者验证了稳定细胞株的过表达效率,并构建了尾静脉模型(图5f、g)。体内荧光成像结果显示,30d后LV-CircTUBGCP4组小鼠肺内荧光强于LV-NC组(图5h)。LV-CircTUBGCP4组肺转移结节数量多于LV-NC组(图5i)。此外,HE结果和IHC结果显示LV-CircTUBGCP4组比LV-NC组有更多的血管和微血管(图5j-l)。有趣的是,与LV-NC组相比,LV-CircTUBGCP4组的肺转移结节中CD31+和CD34+均较高(图5k-1)。这些结果表明,过表达的circRNA可通过增强血管生成促进肿瘤转移。
6. HUVECs中CircTUBGCP4通过靶向miR-146b-3p/PDK2轴激活Akt信号通路
为了探索外泌体circTUBGCP4的潜在调控,作者考虑了circTUBGCP4是否作为海绵吸附miRNAs。首先,作者使用了癌症特异性circRNAs数据库在circTUBGCP4中发现了8个AGO2结合位点。此外,AGO2-RIP验证了circTBUGCP4可以结合AGO2蛋白,这提示了circTUBGCP4结合miRNA的潜力(图6a)。然后,作者从作者的环状RNA阵列分析和CIRCinteractiome的交集中选择了miR-146b-3p和miR-873-5p(图6b)。作者设计了靶向反向剪接连接的circTUBGCP4生物素探针,并在转染过表达circTUBGCP4的HUVECs中验证了良好的下拉效率(图6c)。circRNA pull-down结果显示,在HUVEC裂解缓冲液中,circTUBGCP4探针可以显著结合miR-146b-3p,而不是miR-873-5p(图6d)。此外,当HUVECs过表达circTUBGCP4时,circTUBGCP4探针可以拉出更多的miR-146b-3p(图6e)。接下来,作者发现circTUBGCP4有两个位点来海绵化miR-146b-3p(图6f)。基于两个结合位点,作者构建了circTUBGCP4的全突变质粒。结果表明,circTUBGCP4可以基于293 T中的两个位点与miR-146b-3p结合(图6g)。
有研究报道癌细胞与HUVECs共培养可以通过激活PI3K/Akt信号通路增加内皮细胞的管腔形成和存活。因此,作者想知道外泌体circTUBGCP4是否通过激活Akt通路促进内皮细胞管的形成。Western blot结果显示,HCT116-Exo和SW480-Exo处理的HUVECs中p-AKT表达上调,而shcircTUBGCP4-01-Exo和shcircTUBGCP4-02-Exo处理的HUVECs中p-AKT表达下调(图6h和i)。因此,作者筛选了与PI3K/Akt信号通路相关的miR-146b-3p靶点。巧合的是,在Targetscan和miRDB数据库中筛选出的141个靶基因中,与PI3K/Akt信号通路相关的基因是PDK2(图6j)。此外,作者还筛选了与PI3K/Akt信号通路直接相关的其他初级基因(图6j)。然后,与NC相比,PDK2是HUVECs过表达miR-146b-3p中唯一下调的靶点(图6k)。此外,PDK2可以被circTUBGCP4上调,而被HCT116和SW480的Exo-Sh-Circ-01和Exo-Sh-Circ-02下调(图6l)。为了证明miR-146b-3p靶向PDK2-3'UTR,作者设计了miR-146b-3p生物素探针来下调PDK2。结果显示,miR-146b-3p探针可以显著富集PDK2(图6m)。然后,作者构建了携带双荧光素酶报告基因的PDK2-3'UTR质粒,并预测了其在293 T细胞中PDK2-3'UTR的结合位点(图6n)。结果显示,在293 T细胞中,PDK2-3'UTR可以被miR-146b-3p结合(图6o)。为了证实circTUBGCP4通过miR-146b-3p激活Akt信号通路,作者在过表达circTUBGCP4和过表达miR-146b-3p时对HUVECs进行转染。结果显示,PDK2在过表达circTUBGCP4的HUVECs中mRNA水平和蛋白水平均升高。在HUVECs中,miR-146b-3p模拟物抑制miR-146b-3p的增加(图6p)。综上所述,这些结果表明circTUBGCP4可以通过海绵miR-146b-3p促进PDK2来激活Akt信号。
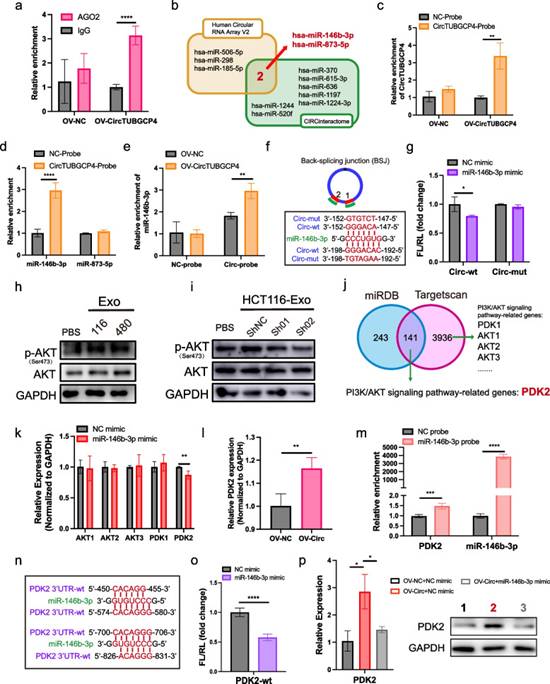
图6 CircTUBGCP4海绵miR-146b-3p上调PDK2激活HUVECs中Akt信号通路
7. MiR-146b-3p抑制HUVECs迁移、管腔形成和尖端细胞形成
接下来,基于上述发现,作者检测HCT116-Exo和SW480-Exo处理HUVECs 6h、12h、24h后miR-146b-3p的表达。如图7a-b所示,HCT116-Exo和SW480-Exo处理HUVECs后miR-146b-3p的表达逐渐降低。Transwell迁移实验显示,过表达miR-146b-3p显著抑制HUVECs迁移(图7c)。此外,划痕实验也显示,与NC模拟物组相比,miR-146b-3p模拟物组HUVECs的伤口闭合速度较慢(图7d)。此外,过表达miR-146b-3p显著抑制HUVECs在4h和6h后的节点形成(图7e)。然后,根据蛋白质印迹结果,作者发现miR-146b-3p可以显著抑制CD34的表达,也可以抑制PDK2的表达和AKT的激活(图7f)。

图7miR-146b-3p在HUVECs中的作用,以及外泌体circTUBGCP4在miR-146b-3p调控的HUVECs功能障碍中的作用。
8. 外泌体circTUBGCP4通过抑制miR-146b-3p增强HUVECs迁移、管状细胞形成和尖端细胞形成
为了探究miR-146b-3p对circTUBGCP4调控HUVECs功能的潜在作用,作者使用HCT116-LV-CircTUBGCP4来源的外泌体孵育HUVECs,随后转染miR-146b-3p模拟物。然后,transwell迁移实验显示,与HCT116和SW480的Exo-LVNC相比,Exo-LVcircTUBGCP4处理的HUVECs迁移能力增强,然后miR-146b mimic抑制这种增加的趋势(图7g)。管形成实验的类似结果表明,与HCT116和SW480的Exo-LVNC相比,Exo-LVcircTUBGCP4处理的HUVECs具有更多的节点,然后被miR-146b模拟物抑制(图7h)。激光共聚焦图像显示,Exo-LVcircTUBGCP4处理的HUVECs比Exo-LVNC处理的HUVECs有更多的丝状伪足和更高的CD34表达。然而,miR-146b-3p抑制了这一上升趋势(图7i-j)。这些结果表明,外泌体circTUBGCP4通过吸附miR-146b-3p增强HUVECs的细胞迁移、管状细胞形成和尖端细胞形成。
外泌体circTUBGCP4在血管生成和肿瘤转移中的功能示意图模型

结论:
该研究结果证明CRC-CDEs诱导更多的丝状伪足和血管内皮尖细胞形成,从而促进细胞迁移和管状形成。此外,该研究鉴定了CRC-CDEs中的circTUBGCP4,它可以被转运到血管内皮细胞中,从而促进细胞迁移、管状细胞形成和尖端细胞形成。机制上,该研究发现circTUBGCP4可以靶向miR-146b-3p触发血管内皮细胞中的Akt信号通路。该研究阐明了一种新的肿瘤诱导血管生成机制,可能为结直肠癌的抗血管生成治疗提供新的途径。
参考文献:
Chen C, Liu Y, Liu L, Si C, Xu Y, Wu X, et al. Exosomal circTUBGCP4 promotes vascular endothelial cell tipping and colorectal cancer metastasis by activating Akt signaling pathway. J ExpClin Cancer Res. 2023 Feb 15;42(1):46. doi: 10.1186/s13046-023-02619-y.






