去泛素化酶UCHL3通过Hippo信号通路促进间变性甲状腺癌的进展和转移
YAP是Hippo通路的主要关键效应因子之一,YAP在间变性甲状腺癌(ATC)中异常表达的机制尚不明确。在这里,我们鉴定了UCHL3是ATC中真正的YAP去泛素化酶。UCHL3以去泛素化活性依赖的方式稳定YAP。UCHL3缺失显著降低ATC进展、干细胞样和转移,并增加细胞对化疗的敏感性。UCHL3缺失降低ATC中YAP蛋白水平和YAP/TEAD靶基因表达。UCHL3启动子分析显示,TEAD4通过结合UCHL3启动子激活UCHL3转录。总的来说,我们的研究结果表明,UCHL3在稳定YAP中起着关键作用,进而促进ATC的肿瘤发生,这表明UCHL3可能是治疗ATC的潜在靶点。本文于2023年2月发表于“Cell Death & Differentiation”(IF=12.067)上。
技术路线:

结果:
1)UCHL3通过去泛素化活性稳定YAP
我们之前报道过YAP促进ATC细胞增殖。我们利用siRNA筛选文库来鉴定ATC中负责YAP去泛素化和稳定的去泛素化酶。每种DUBs特异性的四种非重叠siRNA混合物被转染到CAL-62细胞中。研究发现,沉默UCHL3显著降低了YAP(图1A)。我们检测了UCHL3在10种甲状腺癌细胞系(TPC-1、B-cpap、IHH4、FTC133、TT、CAL-62、8505c、KHM-5M、8305c、BHT-101)和永久化正常甲状腺上皮细胞系(Nthy-ori3-1)中的表达,我们观察到ATC细胞系中UCHL3的表达有上调趋势,尤其是在CAL-62和KHM-5M细胞中(补充图)。然后,我们在CAL-62和KHM5M细胞中敲低UCHL3,进一步验证UCHL3在调节YAP蛋白水平方面的功能(图1B)。一致地,UCHL3的异位表达以剂量依赖的方式深刻上调YAP。而催化失活的突变体C95A (UCHL3C95A)失去了上调YAP的能力,提示UCHL3对YAP的调控依赖于DUB活性(图1C)。RT-PCR分析表明,UCHL3没有改变YAP mRNA的丰度(图1D)。荧光素酶报告基因实验结果表明,UCHL3的缺失降低了CAL-62细胞中YAP/TEAD-荧光素酶报告基因的活性(图1E)。我们检测了UCHL3参与YAP去泛素化的可能性,并发现UCHL3缺失会降低YAP蛋白水平,这种影响可以通过添加蛋白酶体抑制剂MG132或过表达UCHL3-WT来逆转,但其催化失活突变体UCHL3C95A不能逆转(图1F, G)。然后,我们用蛋白质合成抑制剂环己亚胺处理细胞,以确定UCHL3是否会影响YAP的稳定性。我们发现,在UCHL3缺失的细胞中,YAP的稳定性降低(图1H)。在过表达UCHL3- WT而非UCHL3C95A的细胞中,YAP的半衰期延长(图1I)。此外,我们观察到UCHL3和YAP蛋白水平在人甲状腺癌样品中呈正相关(图1J)。综上所述,UCHL3通过稳定YAP调控Hippo信号通路。然后我们进行免疫荧光检测评估UCHL3和YAP的细胞定位。免疫染色结果表明,YAP和UCHL3同时存在于ATC细胞的核和细胞质中(图1K)。我们的免疫共沉淀(CoIP)实验表明,内源性UCHL3可以与内源性YAP免疫共沉淀(图1L)。GST-pulldown实验表明,UCHL3在体外与YAP相互作用,其相互作用方式不依赖于其DUB活性(图1M)。此外,缺失分析表明,UCHL3的C端与YAP的WW结构域存在物理相互作用(图1N-P)。这些发现表明UCHL3与YAP相互作用。

2)UCHL3去泛素化YAP
由于UCHL3是一种去泛素化酶,我们继续研究UCHL3去泛素化YAP的可能性。UCHL3的缺失显著增加了泛素化-YAP的水平(图2A)。然后我们进行了内源性泛素化试验,并检测了YAP上的内源性泛素。如图2B所示,UCHL3过表达降低了YAP上的内源性泛素。一致地,UCHL3-WT的异位表达,而不是UCHL3C95A,在体内和体外都显著降低了细胞中YAP的泛素化(图2C, D)。然后,我们用UCHL3的小分子抑制剂TCID处理CAL-62细胞,发现与UCHL3 siRNA类似,TCID抑制UCHL3以剂量依赖的方式增强了YAP的泛素化(图2E)。此外,UCHL3降低了E3连接酶SHARPIN诱导的YAP泛素化(图2F)。体内去泛素化实验也显示,UCHL3以时间和剂量依赖的方式去除YAP的泛素链(图2G)。我们进一步对一系列泛素突变体进行泛素化实验,以研究UCHL3对YAP的哪一种泛素链进行了去泛素化。结果发现,UCHL3有效地去除了YAP上的K11和K48连接的泛素链(图2H)。综上所述,UCHL3被证明是一种特异性去泛素化酶,其去多泛素化并稳定YAP。

3)UCHL3缺失抑制ATC细胞增殖和迁移
接下来,我们研究了UCHL3在调节ATC进展中的作用。我们的研究结果表明,UCHL3的缺失显著降低了细胞的增殖和迁移。UCHL3的缺失降低了细胞增殖,增加了G1期的细胞数量,表明UCHL3可能调节ATC细胞从G1到S的转变(图3A, B)。克隆形成实验结果显示,UCHL3缺失显著降低了CAL-62和KHM-5M细胞的克隆形成能力(图3C)。同样,EdU掺入实验表明,UCHL3 siRNA处理的CAL-62和KHM-5M细胞的DNA合成受到抑制(图3D, E)。此外,伤口愈合和transwell实验显示,UCHL3缺失显著降低了细胞迁移能力(图3F-H)。
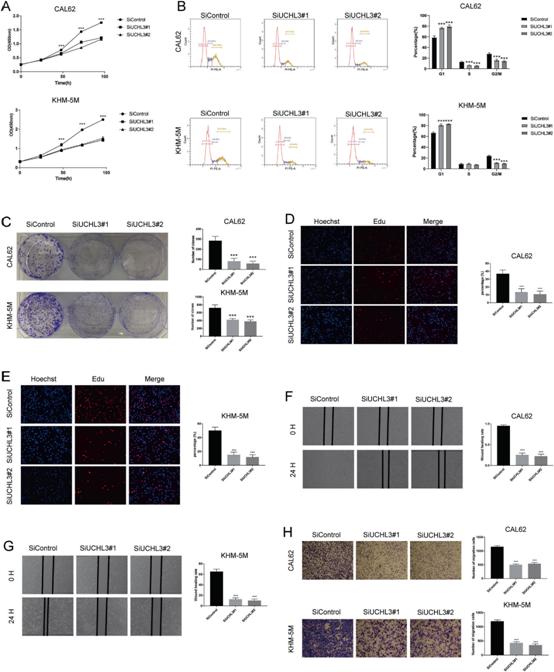
4)UCHL3增强间变性甲状腺癌干细胞的致瘤能力
由于ATC是一种未分化癌,我们随后研究了UCHL3在间变性甲状腺癌干性特征中的作用。研究发现,UCHL3缺失显著减少了CAL-62和KHM-5M细胞球的形成(图4A, B)。值得注意的是,与对照细胞相比,UCHL3的缺失显著降低了多能转录因子Sox2、Nanog、KLF4和Oct4的表达(图4C),并降低了ATC细胞的ALDH活性(图4D)。此外,与对照细胞相比,表达shUCHL3的CAL-62细胞在NOD-SCID小鼠中显示出较弱的肿瘤启动能力(图4E)。总的来说,UCHL3的沉默消除了间变甲状腺癌干细胞的致瘤能力。
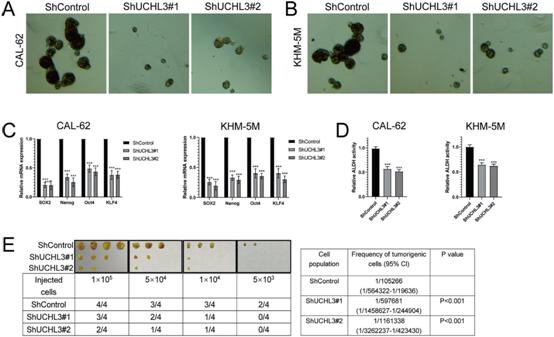
5)增加YAP表达可以恢复UCHL3缺失的影响
为了确定UCHL3通过稳定YAP调节ATC细胞增殖和迁移的机制,我们在UCHL3敲除的CAL-62细胞中进行异位表达YAP或UCHL3C95A的拯救实验。CCK8实验表明,过表达YAP在很大程度上恢复了CAL-62细胞的增殖速度(图5A)。YAP表达的增加逆转了CAL-62细胞的克隆形成能力(图5B)。同样,过表达YAP也促进了UCHL3缺失的CAL-62细胞的DNA合成(图5C)。伤口愈合和transwell实验表明,过表达YAP在很大程度上逆转了UCHL3缺失诱导的抑制功能(图5D, E)。但UCHL3C95A失去了促进增殖和迁移的能力。UCHL3的下调显著抑制了体内肿瘤的生长,而YAP表达的恢复则消除了UCHL3缺失引起的抑制(图5F-H)。我们进一步使用尾静脉注射小鼠模型进行体内转移评估。UCHL3缺失可显著抑制小鼠的肺转移,过表达YAP可缓解这一效应(图5H, I)。综上所述,这些结果表明UCHL3通过YAP促进ATC进展。
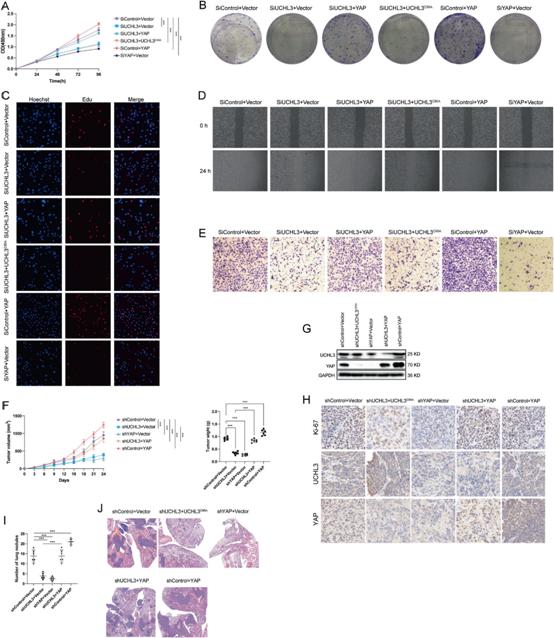
6)TCID抑制ATC细胞的生长和转移
我们还研究了UCHL3抑制剂TCID (0,5,10 μM)对间变甲状腺癌细胞增殖和迁移的影响。TCID抑制UCHL3对ATC细胞的生长和转移具有剂量依赖性抑制作用(图6A-E)。此外,我们在体内研究了TCID是否影响ATC的生长和转移,发现TCID治疗后裸鼠的肿瘤生长和转移明显降低(图6F-H)。为了进一步确定TCID的抗肿瘤和抗转移作用是否由UCHL3和YAP介导,我们构建了UCHL3和YAP敲除细胞。结果发现TCID对UCHL3和YAP敲除细胞的生长和转移影响极小(补充图)。符合我们之前的实验,TCID抑制UCHL3显著降低ATC细胞中YAP蛋白质水平(图6I)。环己酰亚胺和TCID的联合更快地减少内源性YAP水平(图6J)。TCID对YAP的作用主要依赖于UCHL3,TCID对UCHL3敲除细胞中的YAP蛋白水平没有影响,UCHL1的缺失不影响YAP蛋白水平(图6K,6L)。
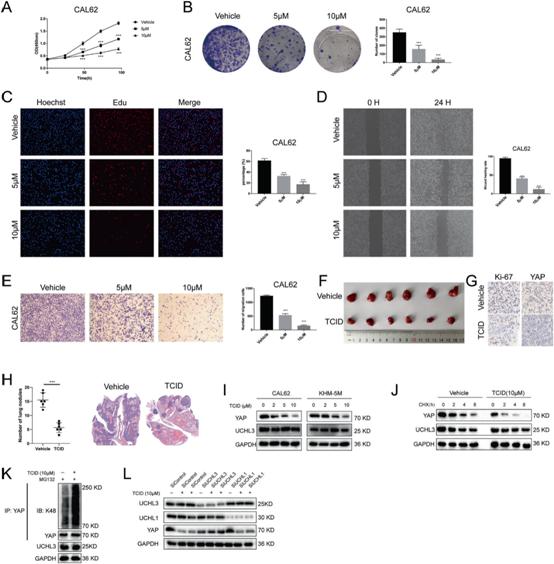
7)UCHL3通过YAP降低ATC细胞对化疗的反应
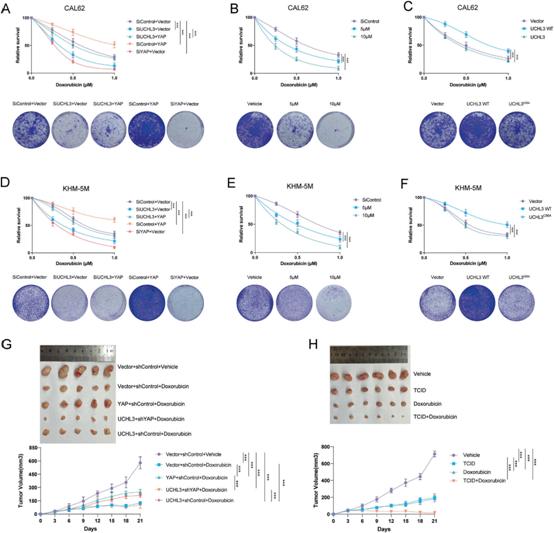
阿霉素是ATC最常用的化疗药物。YAP活化已被证明在卵巢癌、乳腺癌和肝细胞癌等多种恶性肿瘤的化疗耐药中发挥作用。我们检查了抑制UCHL3是否影响细胞对阿霉素的反应。如图7所示,siRNA或TCID对UCHL3的抑制使CAL-62细胞对化疗药物的治疗敏感(图7A, B),而UCHL3缺失所引起的作用可以通过YAP重建来消除(图7A)。一致地,过表达WT UCHL3的CAL-62细胞对阿霉素治疗产生耐药性,而过表达催化失活的突变体UCHL3的细胞则没有这种效果(图7C)。在KHM-5M细胞中观察到同样的结果(图7G,F)。为了在体内证实UCHL3的抗化疗功能,将过表达空载体、UCHL3、YAP或靶向YAP的shRNA的CAL-62细胞移植到裸鼠体内。我们发现,在阿霉素处理后,对照组CAL-62细胞的肿瘤生长显著降低,而过表达UCHL3或YAP的肿瘤细胞比阿霉素处理的对照组细胞生长更快,YAP的缺失消除了过表达UCHL3引起的化疗耐药效应(图7G)。TCID和阿霉素联合应用比TCID或阿霉素单独应用在体内显著抑制肿瘤生长(图7H)。
结论:
我们证明了UCHL3是一种YAP去泛素化酶,通过其去泛素化活性稳定YAP,促进肿瘤生长、转移和肿瘤干性。我们的研究结果为UCHL3在Hippo信号通路中的作用提供了新的见解,并提示UCHL3可能被证明是治疗ATC的潜在靶点。
参考文献:
Tang J, Yang Q, Mao C, Xiao D, Liu S, Xiao L, Zhou L, Wu G, Tao Y. The deubiquitinating enzyme UCHL3 promotes anaplastic thyroid cancer progression and metastasis through Hippo signaling pathway. Cell Death Differ. 2023 Feb 22. doi: 10.1038/s41418-023-01134-z.






