RNA去甲基化酶ALKBH5通过ITPA m6A修饰促进t(8;21)急性髓系白血病的发生
染色体平衡易位t(8;21)是急性髓系白血病(AML)最常见的遗传畸变之一。即使t(8;21)患者被认为是低危AML,但仍有40~50%的患者接受单独化疗后不可避免地复发。KIT基因突变似乎是t(8;21)患者最常见的附加基因事件,预后较差。同种异体造血干细胞移植似乎是KIT突变患者的治疗方法,然而即使在接受治疗后,2年累积复发率也可接近32%,2年无白血病生存率仅为55%,这表明迫切需要开发更有效的治疗方法来改善患者的预后。该研究发表于《Biomarker Research》,IF:8.633。
技术路线:

主要研究结果:
1. ALKBH5在T(8;21)AML患者中过表达,是 Kasunmi-1细胞生长所必需的
与正常MNC相比,ALKBH5在mRNA水平上在t(8;21)AML患者中高表达(图1A)。作者的蛋白质印迹数据显示,ALKBH5在t(8;21)AML患者中的表达明显更高(图1B)。同样,与MNCs相比,Kasumi-5细胞中的ALKBH1蛋白水平更高(图1C)。此外,基于TCGA-LAML队列的ALKBH5升高与AML患者的总生存期缩短有关(图1D)。
为了研究ALKBH5在t(8;21)AML中的作用,在Kasumi-5细胞中构建了敲低ALKBH1细胞模型(图1E-F)。敲低ALKBH5能实质性抑制增殖(图1G-H)和显著诱导细胞凋亡(图1I和L)。敲低ALKBH5也显著抑制了人原发性AML细胞的生长(图1J),并促进人大块AML细胞的凋亡(图1K和M)。作者进一步检测了全局m6A水平并观察到ALKBH5敲低诱导Kasumi-1细胞和原代细胞中的水平显著增加(图1N)。
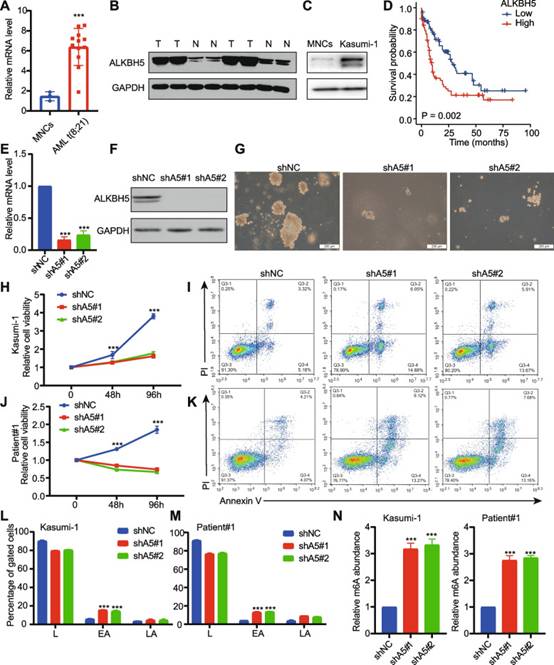
图1 ALKBH5是t(8;21)AML细胞生长所必需的
2. 敲低ALKBH5损害(8;21)AML维持
首先,RUNX1-RUNX1T1和套件N822Kmut共表达小鼠用作T(8;21)白血病小鼠模型。为了确定(5;8)AML维持是否需要ALKBH21,作者将ALKBH5 shRNA或对照shRNA转导到从 t(8;21)只白血病小鼠收集的t(8;21)白血病BM细胞中,并建立了BMT模型(图2A)。敲低ALKBH5显著抑制了体外菌落形成/重铺试验检测到的菌落数(图2B)。敲低ALKBH5显著损害了RUNX1-RUNX1T1和KIT的进展。N822Kmut-在受体小鼠中诱导t(8;21)AML(图2C)。作者观察到敲低ALKBH5显著抑制了转化供体细胞在外周血和BM中的植入(图2D-E),并减少脾脏和肝脏中白血病细胞的浸润(图2F-G)。接下来,作者使用异种移植模型(CDX和PDX)进一步评估ALKBH5在维持人类AML细胞中的潜在作用。正如预期的那样,敲低ALKBH5显著延长了异种移植受体小鼠的存活期,并抑制了BM中白血病细胞的植入(图2H-K)。
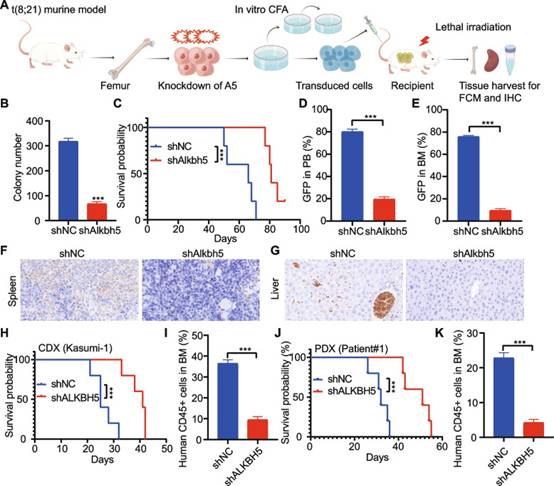
图2 敲低ALKBH5影响小鼠和人类AML的维持
3. 识别t(5;8)AML中ALKBH21的潜在靶标
为了探索 t(5;8)AML中ALKBH21功能的潜在机制,作者对Kasumi-5细胞中的 ALKBH1 敲低进行了转录组测序。在2326个shALKBH3和5个shNC样品中鉴定出3个差异表达基因(DEG),包括1533个下调基因和793个上调基因(图3A)。通过GO和KEGG通路富集分析,作者确定了包含凋亡信号通路的前10个GO术语和前5个KEGG术语(图3B-C),这与作者的发现一致,即敲低ALKBH5增加了Kasumi-1细胞的凋亡。然后,作者使用全局信号转导网络分析确定了关键的DEG(图3D)。
敲低ALKBH5显著降低了人AML细胞系、原代AML细胞和鼠RR/KIT AML细胞在两个转录处的ITPA水平(图4A)和蛋白质水平(图4B)。为了研究ITPA作为ALKBH5靶标的功能重要性,作者在操纵ALKBH5和ITPA表达时进行了细胞增殖和克隆形成实验(图4C),发现敲低ALKBH5对细胞生长的抑制作用在很大程度上可以通过ITPA的强制表达来挽救(图4D-E)。
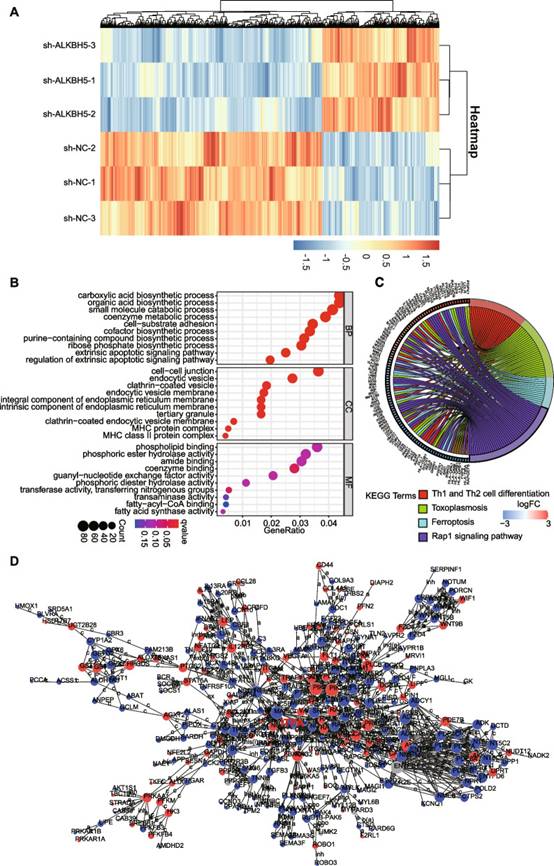
图3 Kasumi-1细胞中ALKBH5的潜在靶点鉴定
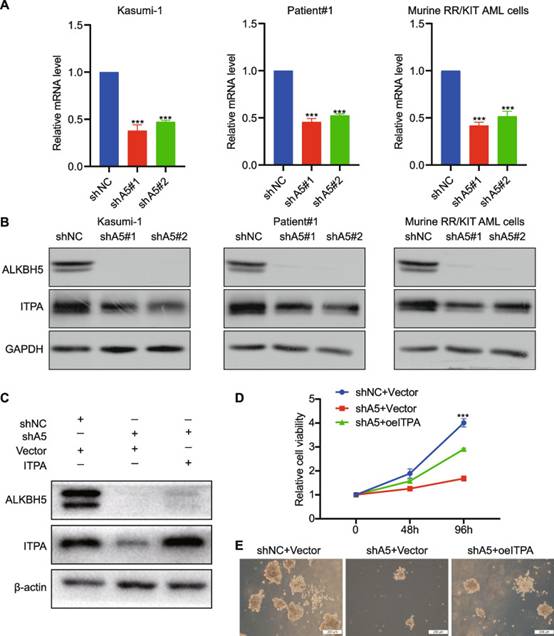
图4 ITPA是ALKBH5功能重要的靶点
4. ALKBH5通过改变m6A修饰调控ITPA mRNA的稳定性
由于ITPA是ALKBH5的阳性靶标,也是增殖能力改变的驱动因素,作者接下来研究了ALKBH5对ITPA表达的调控机制。敲低ALKBH5可能会影响mRNA输出和RNA代谢,因此作者评估了ITPA mRNA的稳定性和亚细胞定位。敲低ALKBH5显著降低了Kasumi-1细胞中ITPA mRNA的半衰期(图5A),而似乎不影响ITPA RNA的核保留或输出(图5B)。此外,敲低ALKBH5不影响使用荧光素酶报告基因测定测定的ITPA启动子活性(图5C)。
为了确定ITPA mRNA是否是ALKBH5的底物,作者使用RNA免疫沉淀(RIP)结合qPCR测定。结果表明,与抗IgG抗体相比,抗ALKBH5抗体可以显著富集ITPA转录本(图5D)。此外,作者使用甲基化RNA免疫沉淀(MeRIP)结合qPCR来确定ITPA m6A ALKBH5敲低后的甲基化水平。与对照组相比,敲低ALKBH5增加了ITPA mRNA的水平(图5E)。野生型ALKBH5的过表达,但未报道的催化无活性突变体ALKBH5 H204A的过表达能够恢复ITPA表达(图5F),表明ALKBH5主要通过其去甲基化活性影响ITPA表达。总体而言,作者的RIP-qPCR和基因特异性m6A-qPCR证实ITPA与ALKBH5的强结合,并且与ALKBH6敲低后AML细胞的m5A丰度显著增加和预期表达水平变化相关。
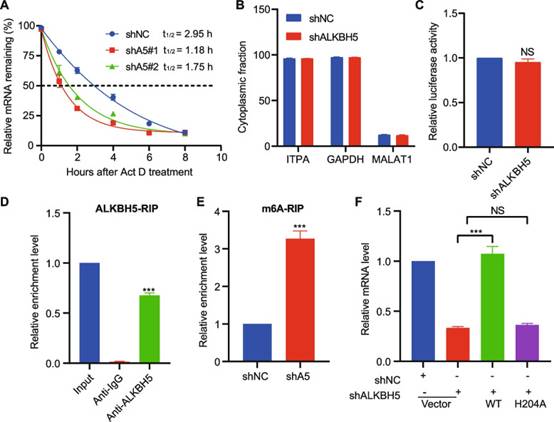
图5 ALKBH5通过影响ITPA mRNA的稳定性来调控其表达
5. TCF15通过提高其启动子活性来调节ALKBH5表达
为了研究为什么ALKBH5在AML中高表达,作者专注于富含ALKBH5启动子的转录因子。作者从NCBI数据库中获得了ALKBH5启动子区,然后通过UCSC跟踪JASPAR分析鉴定了600个转录因子(图6A)。根据TCGA-LAML数据集,作者通过Pearson分析发现TCF15和NRF1与ALKBH5显著相关。作为一种已知的转录因子,TCF15对于多能性退出、造血干细胞(HSC)静止和HSC长期自我更新至关重要。然而,TCF15在AML中的作用尚不清楚。在AML患者中,耐药和复发与LSC/LIC的存在有关。由于Tcf15表达对HSC具有特异性,并且是HSC长期自我更新所必需的,作者推测TCF15是LSC/LIC自我更新所必需的。TCF15在CD34 LSC / LICs中表达,而不是CD34+−散装AML细胞(图6B)。此外,与CD5相比,ALKBH34在CD34 LSC / LICs中高表达+−散装AML细胞(图6C)。为了确定TCF15是否直接调控ALKBH5,作者进行了荧光素酶报告基因测定。潜在结合位点的缺失突变消除了TCF5过表达对ALHBH15启动子的反式活化(图6D-E)。TCF15敲低显著降低了LSC中ALKBH5和ITPA在转录和蛋白质水平上的表达(图6F-G)。
基于TCGA-LAML队列,TCF15表达较高的AML患者与较短的OS相关(图6H)。6ALKBH5敲低显著抑制了人类LSC/LICs的集落形成能力(图6I)。此外,TCF15敲低对细胞生长的抑制作用在很大程度上可以通过ALKBH5的强制表达来挽救(图6J)。总体而言,TCF15/ALKBH5/ITPA轴在t(8;21)AML的进展中起着至关重要的作用(图6K)。
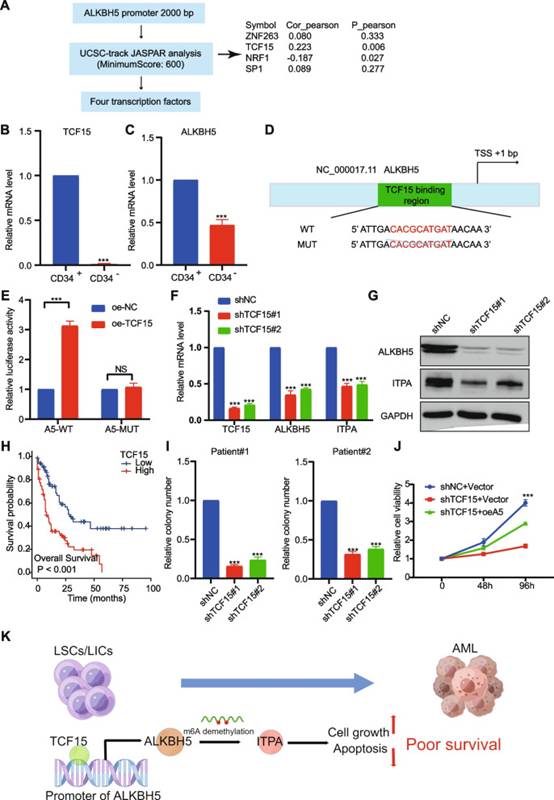
图6 TCF15通过提高ALKBH5的启动子活性来调节其表达
结论:
该研究发现TCF15 / ALKBH5 / ITPA轴在AML发病机制和LSC / LIC维持中起着至关重要的作用。AML伴 t(8;21)预后良好,大多数患者进入缓解期,然而,大约一半患者复发,只有60%患者在诊断后存活超过5年。未来,通过靶向TCF15 / ALKBH5 / ITPA来消除LSC / LICs代表了治疗t(8;21)AML患者的有前途的治疗策略。
参考文献:
Li R, Wu X, Xue K, Feng D, Li J, Li J. RNA demethylase ALKBH5 promotes tumorigenesis of t (8;21) acute myeloid leukemia via ITPA m6A modification. Biomark Res. 2023 Mar 10;11(1):30. doi: 10.1186/s40364-023-00464-x.






