LncRNA-BC069792靶向KCNQ4抑制乳腺癌肿瘤进展
在本研究中,作者探索乳腺癌中lncRNA BC069792的角色,并建立了小鼠模型,开展高通量测序、WB、免疫组化、拯救和突变等实验。结果发现LncRNA BC069792在乳腺癌组织中低水平表达,在乳腺癌病理分级高、淋巴结转移和Ki-67指数高的组均显著降低。而且BC069792抑制体内体外乳腺癌细胞增殖、侵袭和代谢。机制上,BC069792作为分子海绵,吸引hsa-miR-658和hsa-miR-4739,上调Potassium Voltage-Gated Channel Q4(KCNQ4)的表达,抑制JAK2和p-AKT活性,在抑制乳腺癌生长中扮演着重要作用。LncRNA BC069792担任乳腺癌中的肿瘤抑制因子,是乳腺癌的一种新的诊断指标和治疗靶点。本研究于2023年3月1日发表于《Molecular cancer》,IF:36.3
技术路线:
主要研究结果:
研究采集98例乳腺癌病理,其类型均为原发性浸润癌和非特异性乳腺癌。作者首先采用RT-qPCR检测BC069792在98对乳腺癌组织和正常乳腺组织中的表达。结果显示BC069792在乳腺癌组织中的表达水平显著低于在正常癌组织中的水平,表达量差异约为4.87倍(图1a)。ROC曲线分析结果显示,BC069792的表达能够区分乳腺癌组织与正常乳腺组织,曲线下面积为0.9191(图1b)。这提示BC069792可作为乳腺癌的分子标志物。
2、BC069792的定位和稳定性
以GAPDH为细胞质内参,以U6为细胞核内参的RT-qPCR检测结果显示,MDA-MB-231细胞系中BC069792约27.6%位于细胞质中。在MDA-MB-468细胞系中,约26.4%的BC069792在细胞质中表达,73.6%的BC069792在细胞核中表达,说明BC069792在细胞核和细胞质中都有作用(图1c)。此外,RNA-FISH实验也显示BC069792分布在细胞核和细胞质中(图1d)。
为检测BC069792的稳定性,作者在MDA-MB-231和MDA-MB-468细胞中进行放线菌素D给药实验。BC069792的内容在细胞检测到RT-qPCR给药后 0 h, 0.5 h, 1 h, 4 h, 8 h和12小时。结果表明,与C-MYC相比,BC069792在MDAMB-231和MDA-MB-468细胞中稳定存在较长时间(图1e)。
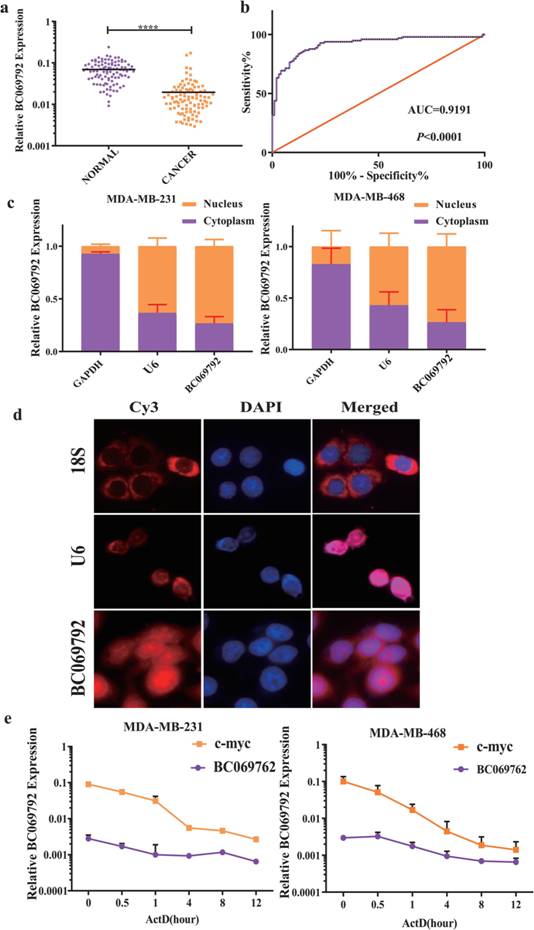
图1 BC069792在乳腺癌组织中的表达
3、BC069792在体外抑制乳腺癌细胞增殖、迁移和侵袭能力
BC069792与临床病理参数的关系提示BC069792在乳腺癌中发挥抑癌基因的作用。为阐明BC069792在乳腺癌中的特异功能,作者在体外进行一系列实验。CCK-8和EdU实验表明,与对照组相比,过表达BC069792能显著抑制MDA-MB-231和MDA-MB-468细胞的增殖(图2a-b)。Transwell实验结果显示,与对照组相比,BC069792过表达细胞穿过基底膜的数量显著减少(图2c),BC069792过表达显著抑制MDA-MB-231和MDA-MB-468的迁移和侵袭能力。
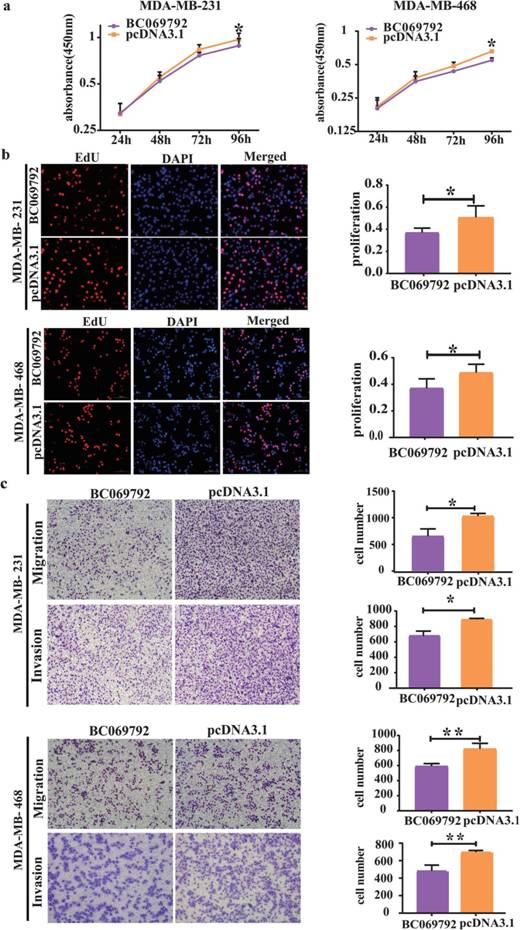
图2 BC069792抑制乳腺癌细胞增殖能力
4、BC069792抑制体内乳腺癌细胞的增殖、侵袭和转移能力
通过皮下注射慢病毒LV-BC069792和LV-NC感染MDAMB-231细胞,建立裸鼠皮下肿瘤模型。5周后,LV-BC069792组的6只裸鼠中有5只检测到肿瘤,LV-NC组的6只裸鼠全部发现肿瘤(图3a)。肿瘤生长曲线显示,LV-NC组的肿瘤生长速度明显高于LV-BC069792组(图3b),且LV-BC069792组小鼠的肿瘤大小明显小于LV-NC组(图3c)。从裸鼠肿瘤组织中提取RNA,进行RT-qPCR实验,证实BC069792在LV-BC069792组的表达水平明显高于LV-NC组(图3d)。LV-BC069792组Ki-67指数明显低于LV-NC组(图3e)。上述结果表明,BC069792过表达可抑制乳腺癌细胞增殖。
将慢病毒感染的MDA-MB-231细胞通过尾静脉注射到裸鼠体内,建立远处转移模型。结果显示,LV-BC069792组有3只裸鼠发生肺部转移。裸鼠肺中位转移瘤数为2个,大小较小。LV - NC组有6只裸鼠出现肺部转移灶,裸鼠肺部转移灶中位数为13个,肿瘤体积较大。RT - PCR结果显示,与LV - NC组相比,LV - BC069792组中BC069792的表达明显升高(图3f)。LV - NC组可见肿瘤侵犯肺脏,其中1只裸鼠肝脏粘连于膈肌,膈肌内可见乳腺癌转移灶。LV - BC069792组除肺外未发现其他转移灶。皮下移植瘤模型中,LV - NC组肿瘤浸润脂肪、横纹肌和皮肤附属器,而LV - BC069792组肿瘤边界更清晰,形成假包膜,无明显侵袭(图3i)。裸鼠皮下成瘤和远处转移模型证实BC069792有效抑制乳腺癌细胞的迁移和侵袭。
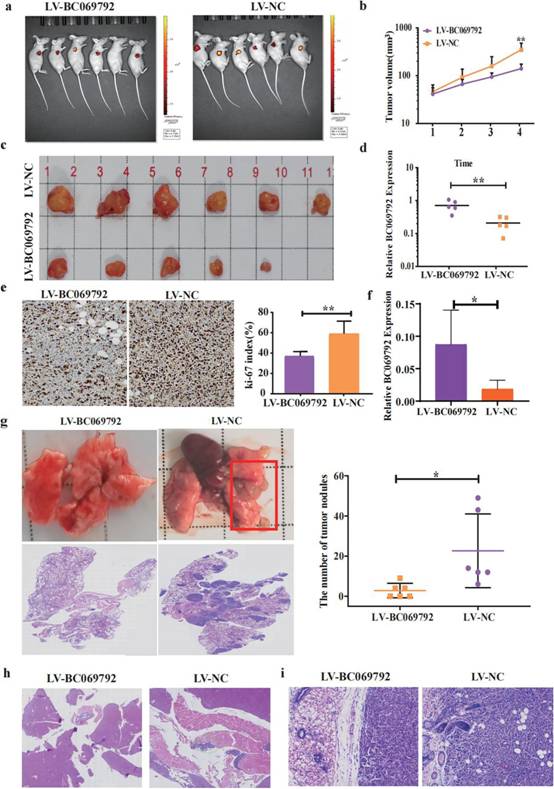
图3 BC069792抑制体内乳腺癌细胞增殖和侵袭。
5、RNA-Seq分析揭示KCNQ4是BC069792重要的下游靶基因
根据mRNA表达水平,测序结果中log2差异倍数大于2倍且p< 0.05,从测序结果中筛选出30个基因进行验证。RT-qPCR结果显示,在30个基因中,KCNQ4在BC069792过表达组与对照组的表达差异最大,在MDA-MB-231细胞中表达量最高(图4a)。过表达BC069792后,KCNQ4蛋白的表达量也增加(图4b)。KCNQ4在正常乳腺组织中的mRNA和蛋白表达明显高于乳腺癌组织(图4c-d)。腋窝肿瘤和肺转移,KCNQ4蛋白和mRNA的表达,LV-BC069792组显著高于对照组LV-NC组(图4e-h)。BC069792的表达与KCNQ4呈正相关(图4i-j)。BC069792可以促进KCNQ4 RNA稳定性(图4k)。上述结果表明,BC069792在乳腺癌中调控KCNQ4 mRNA和蛋白的表达,提示BC069792可能通过促进KCNQ4的表达来抑制乳腺癌的进展。
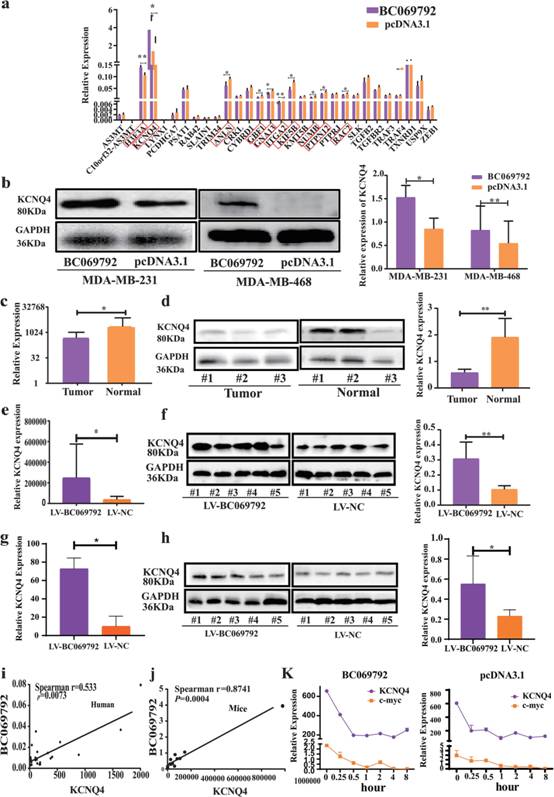
图4 KCNQ4是BC069792的下游靶基因。
5、BC069792作为内源性竞争RNA(ceRNA),通过吸附miR-658和miR-4739上调靶基因KCNQ4的表达
作者用IgG作为对照进行RIP实验。结果显示,内源性BC069792和KCNQ4-3'UTR被Ago2抗体特异性富集(图5a),提示BC069792和KCNQ4可以与细胞质中的特异性miRNA结合。通过miRWalk、RegRNA2.0等网站和ENCORI数据库预测能够与BC069792和KCNQ4结合的靶miRNA,TCGA数据库筛选出乳腺癌和正常乳腺组织中差异表达的miRNA。在3组交集中发现3个促癌miRNA,分别是miR-658、miR-632和miR-4739(图5b)。将mirGLOBC069792 / pmirGLO– NCmimics或mimics NC与3种miRNAs共转染至MDA - MB - 231和MDA - MB - 468细胞株,48 h后用酶标仪检测细胞中荧光素的含量。与对照组相比,miR - 658和miR - 4739显著抑制pmirGLO - BC069792荧光素酶的活性(图5c),而miR - 632无明显作用。最后,将miR - 658和miR - 4739的mimics与pmir GLO-KCNQ4 3 ' UTR质粒共转染MDA - MB - 231和MDA - MB - 468细胞,48 h后用酶标仪检测细胞内荧光。miR - 658和miR - 4739均能降低pmir GLO-KCNQ4 3 ' UTR双荧光素酶活性(图5d)。为证明miR-658或miR-4739与BC069792结合的特异性KCNQ4,作者在突变结合位点后再次进行上述实验。结果显示,miR-658和miR-4739在结合位点突变后,不再能够降低pmirGLO-BC069792和pmirGLO-KCNQ4 3’UTR的荧光素酶活性(图5e-f)。在小鼠腋窝肿瘤和肺转移中,LV-BC069792组miR-658和miR-4739的表达低于LV-NC组(图5g-j)。上述结果表明miR-658和miR-4739能够特异性结合BC069792和KCNQ4的3'UTR。当BC069792和KCNQ4 3'UTR突变删除miR-658和miR-4739结合位点时,它们不能与miR-658和miR-4739结合。上述结果表明,BC069792像海绵一样吸附miR-658和miR-4739,解除其对靶基因KCNQ4的抑制,从而上调KCNQ4的表达。
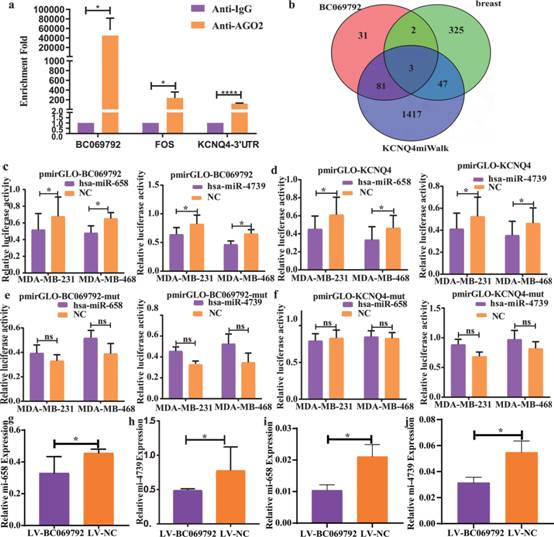
图5 BC069792通过结合miR-658和miR-4739上调KCNQ4
6、BC069792上调KCNQ4,从而抑制JAK2和AKT磷酸化,抑制乳腺癌进展
根据作者的RNA - Seq数据,胆碱能突触上的BC069792(hsa04725)增加KCNQ4、PIK3R3和AKT的表达。众所周知,PI3K / AKT是经典的肿瘤信号转导通路,在肿瘤的增殖、侵袭和转移中起着至关重要的作用。KCNQ4的mRNA表达与BC069792呈正相关,与JAK2呈负相关;BC069792的蛋白表达与KCNQ4呈正相关,与JAK2呈负相关(图6a-b)。在MDA - MB - 231细胞系中,过表达BC069792显著降低p - AKT的表达(图6c)。同组样本中KCNQ4的蛋白表达量明显高于p - AKT(图6d)。结合BC069792过表达组和对照组中KCNQ4和p – AKT WB检测结果,进行spearman相关性检验,发现KCNQ4与p - AKT呈负相关(图6e)。与LV - NC组相比,LV - BC069792组p - AKT表达明显降低(图6f)。上述结果表明BC069792通过上调KCNQ4抑制JAK2蛋白的表达和AKT蛋白的磷酸化,降低p-AKT的表达,进而抑制乳腺癌的进展。
为进一步验证BC069792是否通过竞争吸附hsamiR-658和hsa-miR-4739发挥生物学功能,作者进行拯救实验。结果显示,过表达BC069792的乳腺癌细胞增殖能力降低,迁移能力减弱,KCNQ4蛋白表达水平升高。当BC069792与hsa - miR - 658或hsa - miR - 4739同时过表达时,BC069792对乳腺癌细胞增殖和迁移的抑制作用被逆转(图7a-b),升高的KCNQ4蛋白表达水平降低(图7c),降低的p - AKT蛋白水平升高(图7d)。Spearman相关性检验显示KCNQ4与p-AKT的负相关性恢复(图7e)。综和上述结果,BC069792通过与miRNA结合发挥其生物学功能,可作为分子海绵吸附hsa-miR-658或hsa-miR-4739,上调靶基因KCNQ4蛋白表达,抑制p-AKT活性,进而发挥抑制乳腺癌的作用。
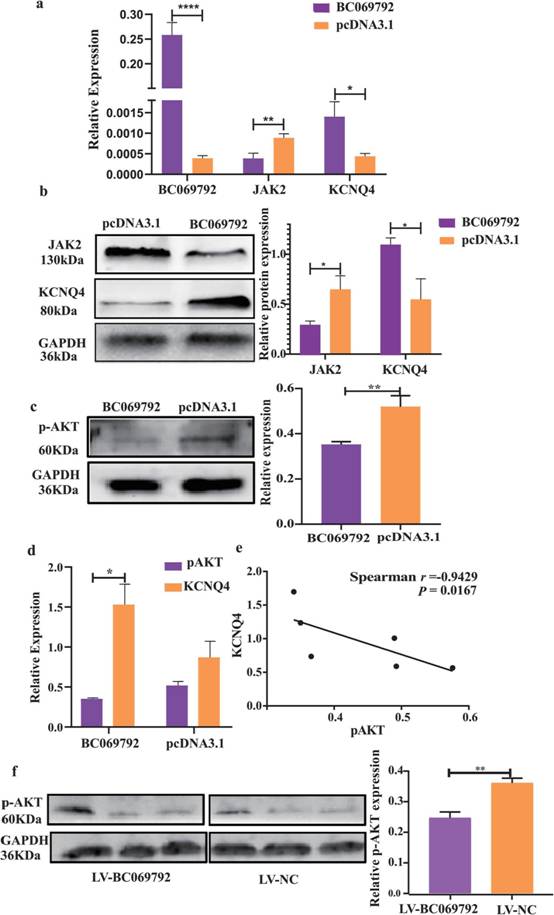
图6 KCNQ4调控的下游效应分子为JAK2/p-AKT。
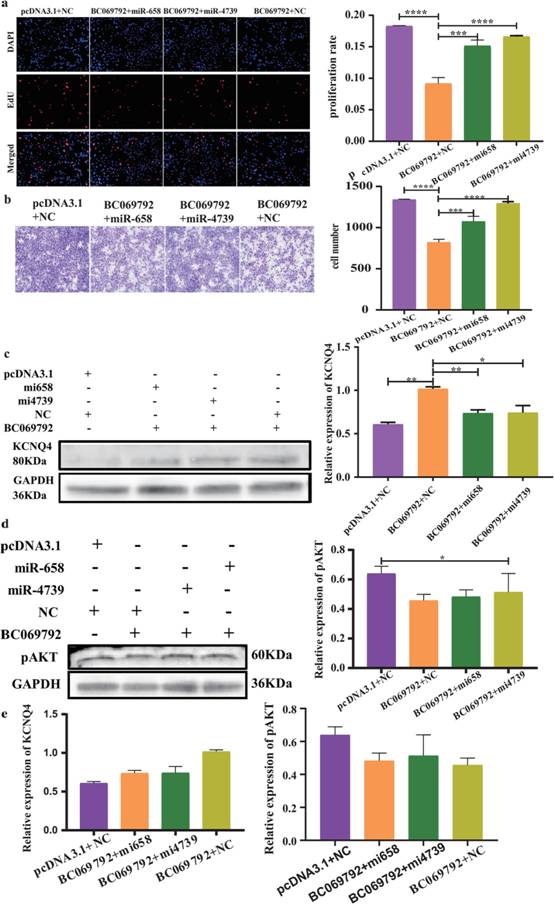
图7挽救实验
结论
LncRNA BC069792在乳腺癌中表达较低,在高组织学分级、淋巴结转移及Ki-67指数组中表达明显降低。BC069792通过BC069792-hsa- miR -658/ miR-4739-KCNQ-JAK2-AKT的ceRNA调控网络,抑制乳腺癌细胞的增殖、侵袭转移,从而在体内、体外抑制乳腺癌细胞的增殖、侵袭转移。
作者首次发现lncRNA可以靶向钾通道蛋白诱导AKT磷酸化。在此基础上,研究钾通道KCNQ4的作用机制及其在癌症中的作用。
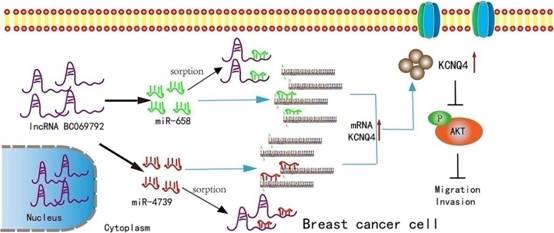
图8 LncRNA BC069792抑制乳腺癌肿瘤进展的机制
参考文献
Zhang Y, Dong X, Guo X, Li C, Fan Y, Liu P, Yuan D, Ma X, Wang J, Zheng J, Li H, Gao P (2023) LncRNA-BC069792 suppresses tumor progression by targeting KCNQ4 in breast cancer. Mol Cancer;22(1):41. doi: 10.1186/s12943-023-01747-5. PMID: 36859185; PMCID: PMC9976483.






