ZNF334启动子的靶向DNA去甲基化抑制结直肠癌的生长
结直肠癌(CRC)是全球癌症死亡的主要原因。肿瘤抑制基因或原癌基因启动子中DNA甲基化的异常调控是CRC发生和发展的基本过程之一。锌指蛋白(ZNFs)是最丰富的蛋白质群之一,在与肿瘤发生相关的许多重要生物学过程中起作用。我们在CRC组织中检测到与正常组织相比,ZNF334基因的异常高甲基化,这种修饰下调了ZNF334的表达。此外,TET1被鉴定参与调节ZNF334的甲基化水平。体外和体内实验均表明,靶向去甲基化系统上调了ZNF334的表达,抑制了CRC的生长。总之,ZNF334启动子的靶向DNA去甲基化揭示了CRC的精确治疗。本文于2023年3月发表于“Cell Death and Disease”(IF=9.685)上。
技术路线

结果
1)CRC中ZNF334下调受DNA甲基化调控
为了研究CRC中ZNF334的特征,基于TCGA数据库进行了在线分析。首先,我们利用TCGA项目中收集的泛癌视图分析数据集,比较了ZNF334在24个肿瘤组织和正常组织中的表达。结果显示,与正常组织相比,大多数肿瘤组织中ZNF334表达降低,CRC组织中ZNF334表达下调存在显著性差异(图1A)。我们进一步根据癌症分期分析了ZNF334在CRC中的表达情况。结果显示,与正常组织相比,ZNF334在1期CRC中表达明显下调,而在2、3、4期CRC中无明显差异(图1B)。同时,ZNF334基因启动子在人CRC组织中的甲基化程度明显高于远端组织(图1C)。为了进一步研究ZNF334在CRC中的表达水平和启动子甲基化状态,我们收集了93个包含临床分期和预后的CRC组织,其中49个包含配对的相邻正常组织。利用我院采集的组织进行qRT-PCR检测ZNF334,结果显示97.96%的人结直肠癌组织中ZNF334较邻近正常组织下调(图1D)。恶性组织中甲基化率较高(图1E)。事实上,ZNF334中CpG甲基化的平均百分比与其表达水平呈负相关(图1F),表明DNA甲基化抑制了人类结直肠肿瘤中ZNF334的转录。接下来,根据中位数将ZNF334的表达和甲基化程度分为“高”和“低”。结果显示,ZNF334 mRNA的表达是CRC患者预后的积极指标(图1G),同时,ZNF334甲基化在CRC患者中具有预测作用(图1H)。此外,还检测了HCoEpiC和CRC细胞(HCT116、RKO、SW480和HT29)中ZNF334在mRNA水平上的表达。我们观察到CRC细胞中ZNF334 mRNA的表达水平低于HCoEpiC(图1I)。根据BSP测序,CRC细胞中有29个CpG位点高甲基化(图1J)。这些结果表明,ZNF334在人结直肠肿瘤组织中的下调是DNA甲基化依赖的,ZNF334的表达和甲基化可能是CRC患者预后的潜在指标。

2)CRC中DAC和AZA诱导的去甲基化作用介导了ZNF334的上调
为了进一步确定DNA甲基化在ZNF334下调中的潜在作用,我们使用两种广谱去甲基化剂AZA和DAC处理CRC细胞(HCT116、RKO、SW480和HT29)。采用CCK-8法检测CRC细胞的增殖能力。结果显示AZA和DAC处理的CRC细胞增殖活性降低,且增殖活性与AZA和DAC浓度呈负相关(图2A, B),同时我们观察到AZA和DAC处理后的ZNF334 mRNA表达水平高于未处理的细胞(图2C, D)。我们进一步探索了AZA和DAC是否会影响体外CRC细胞凋亡。结果显示AZA和DAC处理的HCT116细胞的凋亡率明显高于对照组(图2E)。BSP产物测序也显示AZA和DAC处理的CRC细胞中ZNF334基因启动子区域的甲基化降低(图2F)。综上所述,在CRC细胞中,DNA甲基化抑制了ZNF334的表达。

3)TET1刺激ZNF334的活性去甲基化
为了进一步研究甲基化在CRC细胞中ZNF334失活中的作用,我们通过qRT-PCR检测了HCoEpiC和CRC细胞(HCT116、RKO、SW480和HT29)中TET (TET1、TET2和TET3)的表达。结果显示,TET1 mRNA在CRC细胞中的表达水平低于HcoEpiC细胞(图3A)。qRT-PCR结果显示,与邻近正常组织相比,54.02%的人结直肠肿瘤组织中的TET1水平下调(图3B)。随后选择HCT116和RKO细胞进行进一步分析,因为这两种细胞中TET1表达较低。pLVX-MYRF-TET1感染HCT116和RKO细胞。qRT-PCR分析显示,TET1在HCT116和RKO细胞中的mRNA表达水平明显高于空白对照组(图3C)。此外,TET1组显著抑制了HCT116和RKO细胞的增殖(图3D)。最后,qRT-PCR结果显示,在CRC细胞中过表达TET1后,ZNF334的表达水平有效上调(图3E)。综上所述,TET1介导的DNA甲基化参与了ZNF334在CRC细胞中的表达调控。
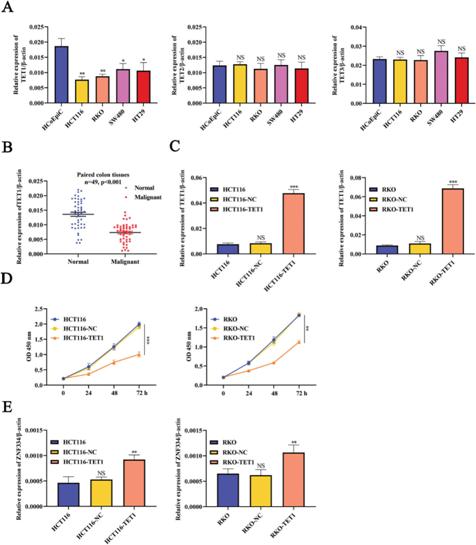
4)体外ZNF334靶向去甲基化的抗肿瘤作用
为了通过特异性去甲基化逆转ZNF334的表达,我们设计了5个sgRNAs,构建了基于dCas9-multiGCN4/scFv-TET1CDsgRNA的特异性去甲基化体系。通过将TET1的催化结构域融合到用荧光报告GFP标记的失活Cas9的N端来生成该体系(图4A)。转染dCas9-multiGCN4/scFv-TET1CD-sgZNF334后,在HCT116细胞中瞬时转染效率达到86.48%(图4B)。qRT-PCR结果证实,在HCT116细胞中,ZNF334在mRNA水平上有效上调(图4C)。基于BSP产物的测序也显示,转染dCas9-multiGCN4/scFv-TET1CD-sgZNF334的CRC细胞中CpG甲基化降低(图4D)。随后,使用CCK-8方法测量HCT116细胞的增殖率。实验结果显示,dCas9-multiGCN4/scFv-TET1CD-sgZNF334显著抑制了HCT116细胞的增殖(图4E)。此外,dCas9multiGCN4/scFv-TET1CD-sgZNF334转染组的HCT116细胞迁移量低于对照组(图4F)。这些结果证明了ZNF334靶向去甲基化在CRC中的抗肿瘤作用。此外,通过任何基于cas9的技术在感兴趣的基因组中识别脱靶切割是重要的。因此,我们使用COSMID在线工具选择了前5个潜在的脱靶位点,以检测它们的mRNA转录水平是否因脱靶去甲基化而改变(图4G)。如图4H所示,dCas9-multiGCN4/scFv-TET1CD-sgZNF334组与dCas9-multiGCN4/scFv-TET1CD-sgRNA及空白对照组之间,这些潜在脱靶基因的mRNA表达量均无明显差异(图4H)。这些结果表明dCas9-multiGCN4/scFv-TET1CD-sgZNF334对ZNF334的去甲基化是有效和特异性的。
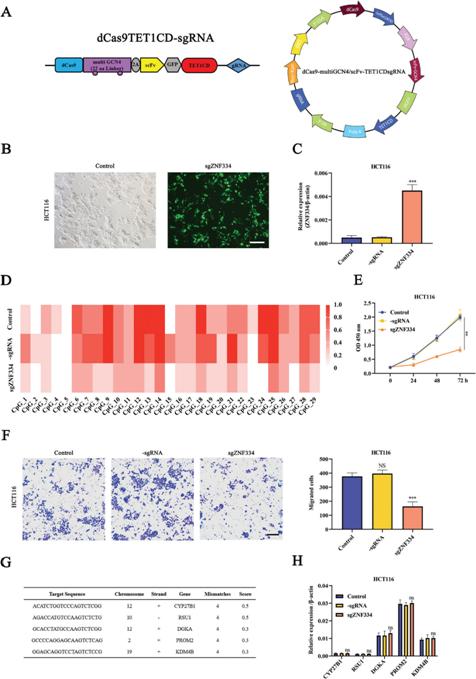
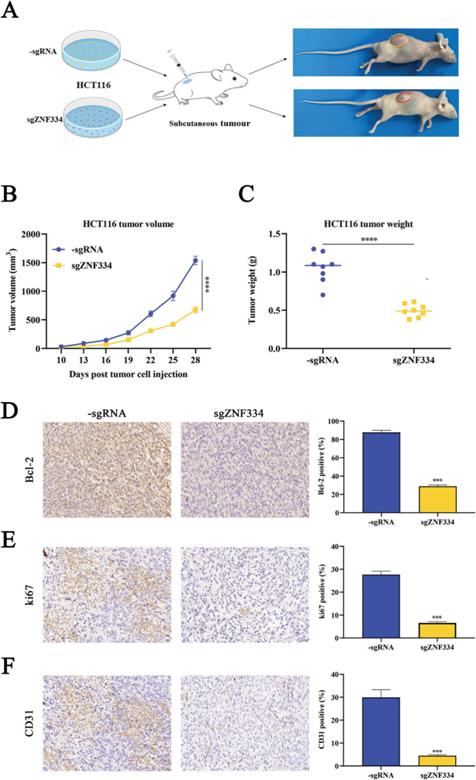
接下来,为了评估ZNF334靶向去甲基化对体内肿瘤生长的作用,将dCas9-multiGCN4/scFv-TET1CD-sgZNF334或dCas9-multiGCN4/scFv-TET1CD-sgRNA转染的5 × 106个HCT116细胞注射到雌性野生型(WT) BALB/c裸小鼠腹部,建立皮下肿瘤模型(图5A)。我们的结果表明,ZNF334的靶向去甲基化显著降低了HCT116细胞的肿瘤体积(图5B)。靶向去甲基化ZNF334也显著抑制了HCT116细胞的重量(图5C),此外,靶向去甲基化ZNF334后,HCT116肿瘤中凋亡细胞增多,增殖细胞减少(图5D, E)。我们还通过内皮特异性抗原CD31染色,确定了ZNF334的靶向去甲基化对肿瘤血管化的影响。如图5E所示,用ZNF334的靶向去甲基化治疗可显著降低CD31染色(图5F)。总的来说,这些数据表明,ZNF334的靶向去甲基化是治疗CRC的一种潜在的抗肿瘤策略。
结论:
我们的研究表明,启动子区高DNA甲基化水平可下调ZNF334的表达,并参与CRC的发生。接下来,我们使用dCas9-multiGCN4/scFv-TET1CD-sgZNF334特异性下调ZNF334启动子区域的甲基化水平,这可以恢复ZNF334的表达,并在体外和体内均具有显著的抗肿瘤作用。综上所述,我们探索了抑癌基因ZNF334在结直肠癌发生中的生物学作用,为结直肠癌的早期诊断和精准治疗提供了新的靶点和临床依据。
参考文献:
Yang B, Tang H, Wang N, Gu J, Wang Q. Targeted DNA demethylation of the ZNF334 promoter inhibits colorectal cancer growth. Cell Death Dis. 2023 Mar 25;14(3):210. doi: 10.1038/s41419-023-05743-x.






