MYTHO,一种新的骨骼肌自噬和完整性调节剂
自噬在肌肉的质量、功能和完整性上发挥着核心作用。调节自噬的分子机制很复杂,目前有很多未知性待挖掘。在本文中,作者鉴定一个独立于FoxO的基因d230025d16rik,命名为MYTHO(Macroautophagyand YouTH Optimizer)。在本研究中,作者经过一系列功能实验和分子研究推断MYTHO是肌肉自噬和完整性的关键调节因子。本研究于2023年3月发表于《Nat Commun》,IF:17.694。
技术路线:

1、D230025D16Rik编码的一种蛋白MYTHO,在不同的组织中表达并在分解代谢条件下转录上调
为鉴定新的FoxO依赖的调节自噬的基因,作者筛选已发表的转录组图谱,寻找在饥饿野生型(WT)小鼠骨骼肌中上调但在FoxO1/3/4肌肉特异性敲除小鼠中功能不变的转录本。随后,作者通过选择在不同物种中保守的转录本和具有自噬相关的LIRs/GIMs基序(LC3相互作用区和GABARAP相互作用区)的开放阅读框(ORF)来减少候选转录本的数量。从上述分析中,作者鉴定D230025D16Rik基因,根据其在C. elegans中对巨噬和寿命的调控能力,将其命名为Macroautophagy andYouTH Optimizer(MYTHO)。作者通过定量RT-qPCR证实MYTHO在WT小鼠的肌肉中被诱导,而在FoxO1/3/4SkmKO小鼠的肌肉中不被诱导(图1A)。在小鼠组织中,MYTHO蛋白在肺和肝脏中大量表达,在心脏和各种肢体肌肉中表达较少(图1B)。值得注意的是,MYTHO蛋白表达水平在富含快收缩糖酵解纤维的肌肉(胫骨前几和腓肠肌)和富含慢收缩氧化纤维的肌肉(比目鱼肌)中相似(图1B)。几个萎缩条件数据集获得的上调基因(GSE63032、GSE20103、GSE48363和GSE145480),揭示肌肉MYTHO mRNA在多种分解代谢条件下上调(图1C)。RT-qPCR证实这一点(图1D),MYTHO mRNA在饥饿、失神经、癌症恶病质和败血症等多种自噬条件所诱导。
为获得MYTHO在分解代谢条件下的病理特征,作者在抑制改变肌肉质量和自噬的不同模型中使用各种功能损失和增益方法。MYTHO敲低(MYTHO-KD)通过电穿孔sh-RNA的质粒来实现,可以防止急性饥饿和肿瘤小鼠的TA萎缩(图1E)。MYTHO-KD在很大程度上预防14天去神经所引发的肌纤维萎缩(图1E)。与这些发现一致的是,腺病毒(AAV)介导的MYTHO-KD在3周内显著增加对照组小鼠的肌肉质量,并减弱LPS诱导的肌肉萎缩(图1F-H)。MYTHO-KD抑制LPS诱导的多种自噬蛋白和标记物含量的增加,包括p62/SOSMT1、BNIP3和LC3-I到LC3-Ⅱ的保护,暗示MYTHO很有可能调控自噬(图1I-J)。这些数据表明,在萎缩条件下,MYTHO增加,抑制MYTHO可以抵消急性分解代谢条件下的萎缩。
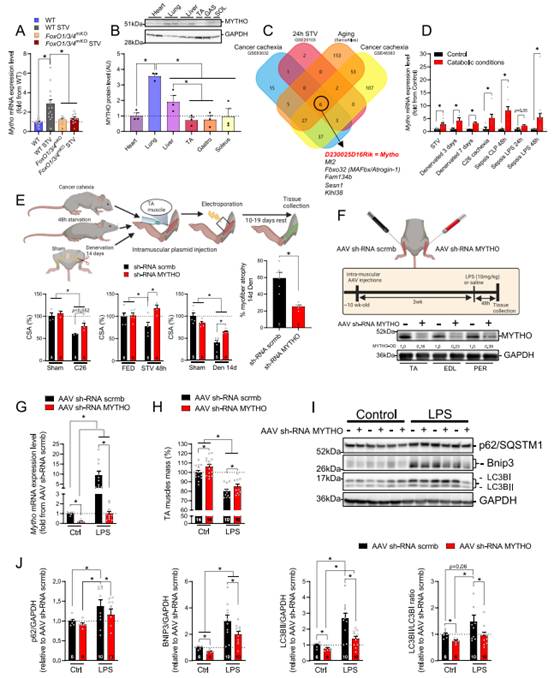
图1 D230025D16Rik编码一种名为MYTHO的蛋白,该蛋白在不同组织中表达,并在分解代谢条件下转录上调
2、MYTHO是骨骼肌自噬所需的
为明确MYTHO是否在调控骨骼肌自噬中发挥重要作用,作者测量MYTHO蛋白在细胞内的定位以及自噬体的标记(LC3B)和溶酶体(LAMP2)。作者在WT小鼠短屈肌(FDB)中电转染编码MYTHO-green fluorescent protein(MYTHO-GFP)和LC3BmCherry(LC3B-cherry)的质粒,单个肌纤维进行可视化。在分离的骨骼肌肌纤维中,MYTHO-GFP与LC3B-cherry共定位(图2A-B),但与LAMP2共定位程度较轻(图2A-C),证实MYTHO与自噬相关。此外,当用营养剥夺来增加体内的自噬通量时,MYTHO在自噬体和溶酶体上的定位增强(图2A-C)。为评估当自噬体与溶酶体的融合被抑制时,MYTHO-GFP的定位是否被改变,在分离单个肌肉纤维之前,对动物注射秋水仙素(破坏微管网络)。图2B-C展示秋水仙素处理后,MYTHO-GFP和LC3B-mCheery的共定位增加,MYTHO-GFP和LAMP2-mcherry的共定位没有改变。饥饿增加MYTHO-GFP和自噬体和溶酶体标志物的共定位;然而,秋水仙碱处理对MYTHO-GFP和LC3B-mCheery的共定位没有影响,但显著降低MYTHO-GFP在溶酶体的定位(图2A-C)。这些结果说明MYTHO首先定位于自噬体,然后从自噬体转移到溶酶体。
为进一步评估MYTHO对肌肉自噬的调节,作者研究秋水仙素处理后MYTHO-KD对自噬通量的影响。WT小鼠中含有sh-RNA寡核苷酸的MYTHO-KD在基础条件下部分减少了自噬体的数量,并抑制饥饿引起的LC3B点状细胞数量的增加(图2D-E)。这些结果说明在分解代谢条件下,MYTHO是骨骼肌自噬增强的重要调控子。

图2 MYTHO是骨骼肌自噬所必需的
3、延长骨骼肌中MYTHO消耗导致肌肉过度生长、损害肌肉收缩力,并诱导多种严重的肌病特征
为进一步探索MYTHO在控制骨骼肌质量和功能中发挥的作用,作者测试MYTHO在不同时间点的影响。与之前的研究一致,AAV介导的MYTHO-KD在AAV介导后的第3周、第6周、12周和20周出现骨骼肌大量增加(图3A)。为定义骨骼肌中MYTHO-KD的生理和功能影响,在AAV转导后的第3、6、12和20周评估TA的收缩特性。AAV感染3周后,MYTHO-KD对肌肉没有明显的影响(图3B)。然而,当AAV感染6、12和20周后,肌肉中的TA显著低于MYTHO-KD组(图3B)。上述数据表明长时间响应的MYTHO-KD反应增加的肌肉量在很大程度上是无用的。
为深入了解MYTHO-KD影响肌肉收缩能力的潜在机制,作者对肌肉切片进行组织学检查。MYTHO-KD治疗6周后发现一些组织异常,如不规则的蓝色纤维、中心核纤维、炎症细胞浸润、肌纤维坏死核小直径再生纤维(图3C)。接下来,作者使用EBD染料评估肌纤维膜的完整性。6周的MYTHO-KD与EBD阳性纤维数量增加相关(图3C-D)。另外,作者还对小鼠IgG阳性纤维的肌肉切片进行F4/80染色,作为细胞膜损伤的指标。6周MYTHO-KD和12周MYTHO-KD在一定程度上增加巨噬细胞浸润(F4/80+区域),并诱导IgG阳性纤维的出现(图3F)。这些数据表明延长MYTHO-KD导致严重的疾病特征出现。这些数据也突出表明MYTHO-KD引发的炎症反应在AAV传导后6周达到高峰。
为进一步研究MYTHO-KD对骨骼肌健康的影响,作者接下来对肌层粘连蛋白和细胞核进行免疫染色(DAPI染色),结果显示,12周的MYTHO-KD导致纤维大小异常变化,肌纤维总数增加,TA中有中央细胞核的纤维数量增加(图3H)。作者发现异常纤维大小变化在12周后,MYTHO-KD患者的纤维类型发生变化,其特征是IIB型纤维的比例增加8%,IIA型纤维的比例减少45%(图3I)。这种由MYTHO-KD引发的纤维类型的转变与编码各种肌球蛋白重链(MHC)亚型的基因表达的改变和几种再生肌生成标记的改变有关(图3J-N)。事实上,Myog(编码肌细胞生成素)和围产期MHC异构体(Mhy8)的表达在MYTHO-KD后的不同时间点显著增加,而Myh2(一个编码IIA型MHC的基因)在AAV转导后3、6、12和20周显著下调。这些结果进一步证实MYTHO-KD延长导致多种肌病特征。
利用电子显微镜对肌肉样本的观察,进一步证实明显的肌病特征是由延长MYTHO-KD反应引起的。正如图4A所示,作者发现了明显的超微结构异常,包括肌浆网扩张(SR)、板层体、线粒体肿胀、糖原积累、自噬物质和管状物质大龄积累(图4A)。接着,作者观察到MYTHO-KD的肌肉中STMM1和SERCA2阳性纤维的数量增加(图4B-C)。如图4D,MYTHO耗尽减少Fam134b(一个重要的ER-phagy受体)的表达。类似于中央核疾病和和肌纤维疾病,作者观察到有MYTHO-KD的肌肉中有desmin蛋白的积累(图4E)。有趣的是MYTHO-KD肌肉的NADHTR染色揭示类似于中央核病变的核样病变(图4F)。为评估MYTHO-KD是否改变线粒体酶的表达,对肌肉切片的丁二酸脱氢酶(SDH)染色结果显示,与未表达MYTHO-KD的肌肉相比,带有MYTHO-KD的肌肉中SDH活性染色的整体强度明显降低(图4G-H)。此外,在带有MYTHO-KD的肌肉中检测到一些不规则的SDH阳性纤维(图4G)。在saponin渗透的肌纤维中,线粒体Ca2+滞留能力的测量显示出双相变化,在MYTHO-KD六周后增加,12周后减少(图4I)。这些表明骨骼肌的MYTHO耗竭导致严重的肌病,并伴有广泛的超微结构病理改变,包括管状聚集物和大量含有非晶态物质的液泡的存在。
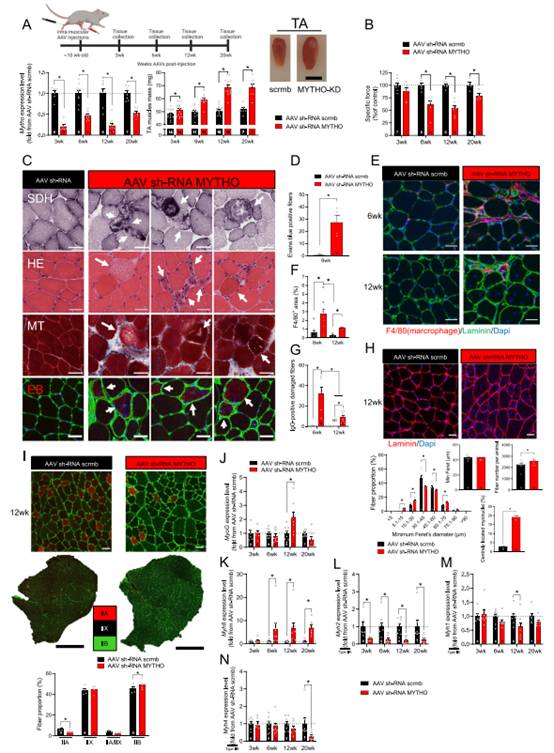
图3 骨骼肌中长时间的MYTHO消耗导致过度生长,损害肌肉收缩力,并诱发几种严重的肌病特征
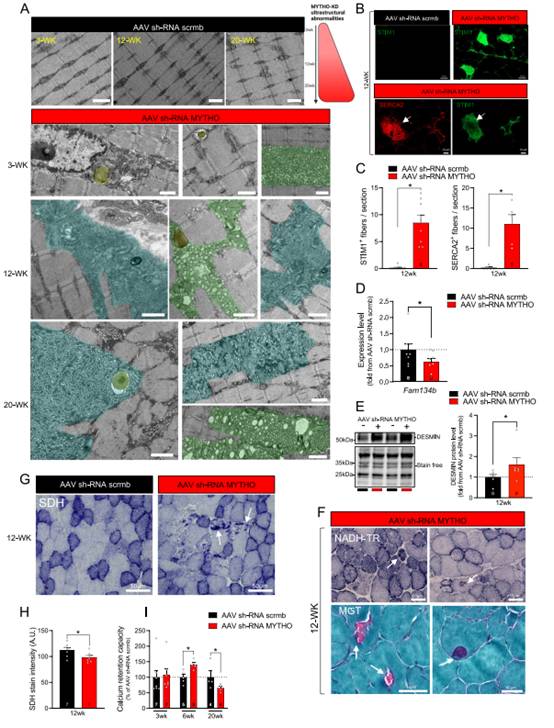
图4MYTHO耗竭导致超结构严重异常
4、MYTHO-KD触发生长信号的激活和自噬受损
为探究MYTHO-KD诱导的肌肉肿大和肌病特征的机制,作者对MYTHO-KD后3周和12周获得的GAS肌肉样本进行微阵列分析。MYTHO-KD 12周后检测到的前100个最稳健的调控基因热图(图5A)。长时间的MYTHO-KD改变了参与骨骼肌生长和发育的几个基因的表达,如Igf2、Mustn1、Mybph和Lmcd1(图5A)。GSEA显示,161个基因上调,53个基因下调(Log2FC>2,p<0.05),在生长因子刺激的细胞反应、肌肉结构发育、创面愈合和细胞因子产生调控等方面均有显著富集(图5B,C)。RT-qPCR验证了12周的MYTHO-KD增强Igf2、金属硫蛋白Mt1和Mt2的表达,降低Mtsn的表达(图5D)。
考虑到MYTHO-KD引发的进行性肿大,结合与生长信号相关的基因表达增加。作者下一步通过嘌呤霉素掺入分析来研究MYTHO-KD是否改变体内肌肉蛋白的合成。12周的MYTHO-KD诱导肌肉蛋白合成的增加(图5E)。作者还观察到MYTHO-KD与AKT和S6(哺乳动物mTORC1的下游靶点)的磷酸化增加有关(图5F)。这些结果表明,骨骼肌中MYTHO的缺失导致生长信号通路的持续激活。
为评估与MYTHO-KD相关的肌肉质量增加是否部分通过抑制蛋白质降解介导,作者通过测量自噬通量来评估自噬活动。作者发现12周的MYTHO-KD损伤了肌肉自噬,p62/SQSTM1和LC3BI的积累证明这一点,并降低LC3BⅡ/LC3BI比值(图5G)。肌肉自噬在急性饥饿反应中的增加,在使用MYTHO-KD的肌肉中减弱(图5G),这表明长期的MYTHO-KD会导致持续的自噬损伤。
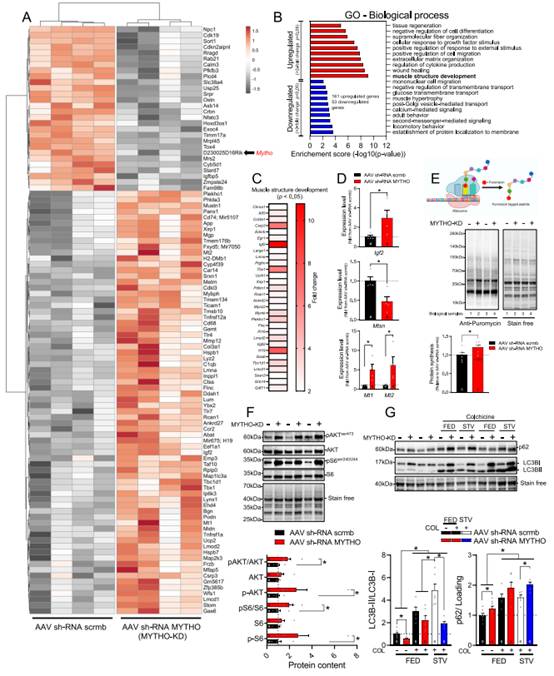
图5 MYTHO损耗激活生长信号
5、自噬对于MYTHO耗竭诱发肌病表型是可有可无的
考虑到MYTHO在体内自噬过程中起着关键作用(图2),作者接下来研究与MYTHO-KD相关的肌病特征是否由于抑制自噬体形成。为验证其可能性,作者在肌肉特异性诱导Atg7敲除小鼠(Atg7iSkM-KO)的骨骼肌中引入MYTHO-KD(图6A)。骨骼肌中Atg7缺失可阻止自噬体的形成(图6C)。敲除MYTHO 12周后,Atg7iSkM-KO和WT小鼠的骨骼肌质量增加到类似程度(图6B),这表明MYTHO的作用不仅仅是自噬调节器。骨骼肌中MYTHO和Atg7的消耗导致LC3BI的显著积累,与WT小鼠相比,Atg7iSkM-KO小鼠的MYTHO-KD肌肉中LC3BI的积累更为明显(图6C)。重要的是,MYTHO-KD导致WT和Atg7iSkM-KO小鼠肌肉中心的肌核比例相似,而单独删除Atg7对该参数无影响(图6D-F)。虽然电子显微镜证实Atg7iSkM-KO小鼠肌肉中膜结构的积累,但这些超微结构异常明显,且不像MYTHO-KD小鼠肌肉中观察到的那么严重(图6G)。这些结果表明,自噬的破坏是由MYTHO控制的系统之一,但不是唯一的系统,并参与肌病表型。

图6 自噬对于MYTHO耗竭诱发肌病表型是可有可无的
由于MYTHO-KD导致mTORC1通路的慢性过度激活,作者推测使用雷帕霉素治疗阻断该通路可以预防或减弱由MYTHO-KD引发的肌病表型。为验证猜想,作者制定了如图7A所示的实验方案。MYTHO-KD在载药处理和雷帕霉素处理小鼠的骨骼肌中均成功(图7B-C)。正如预期的那样,MYTHO缺陷肌肉显示S6Ser240/244的磷酸化增加,而用雷帕霉素治疗的小鼠显示S6Ser240/244的磷酸化减少(图7D)。MYTHO-KD增加了肌肉质量(增加18%),然而,在雷帕霉素治疗的小鼠中,MYTHO-KD的这种影响被削弱(增加9%)(图7E)。同样,在注射了药物的动物中,MYTHO-KD的破伤风等长TA比力峰值下降了约38%,而在注射了雷帕霉素的动物中,峰值下降为13%(图7F)。雷帕霉素处理也减弱了具有中心核的纤维比例,但对MYTHO-KD组肌纤维的总体最小Feret直径没有重大影响(图7G-I)。这些数据表明,雷帕霉素抑制mTORC1在一定程度上挽救MYTHO-KD对肌肉功能和完整性的恶性影响。
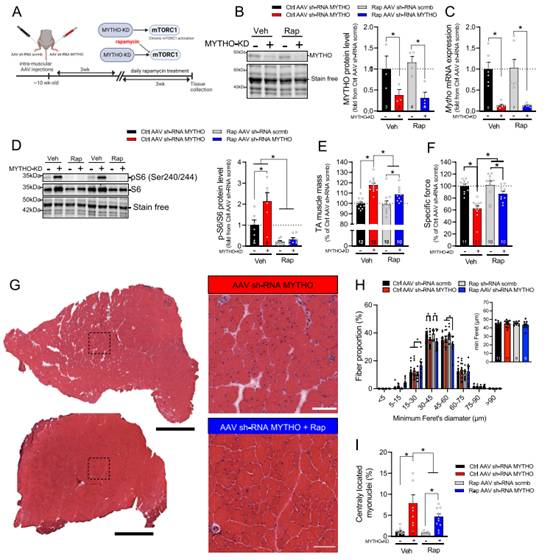
图7 雷帕霉素治疗改善MYTHO-KD诱导的肌病。
结论
本研究确定MYTHO是一个参与自噬、骨骼肌质量和完整性调节的新基因。MYHTO敲低能够抑制骨骼肌的基础病理和饥饿诱导的自噬。在各种分解代谢的条件下,包括饥饿、癌症恶病质、失神经和败血症,MYTHO的短期缺失可以保护肌肉萎缩,但其长期缺失导致严重的肌病表型,至少部分是由mTORC1通路的持续激活引起的(图8)。MYTHO表达和功能的改变是否与人类肌肉疾病和其他人类疾病有关,还需要进一步的研究。
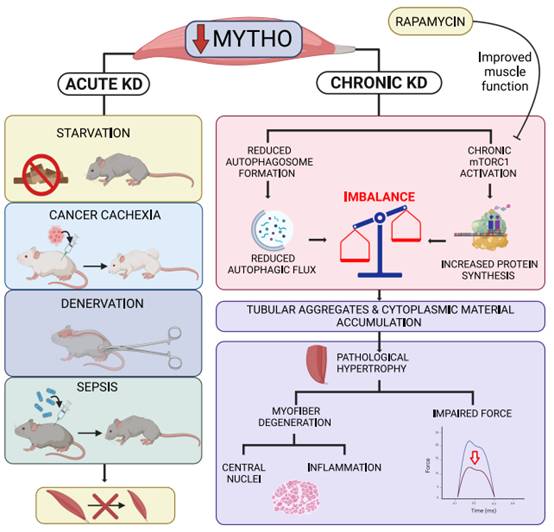
图8 MYTHO:一种参与调节自噬、骨骼肌质量和完整性的新基因。
参考文献
Leduc-Gaudet JP, Franco-Romero A, Cefis M, Moamer A, Broering FE, Milan G, Sartori R, Chaffer TJ, Dulac M, Marcangeli V, Mayaki D, Huck L, Shams A, MoraisJA, Duchesne E, Lochmuller H, Sandri M, Hussain SNA, Gouspillou G. (2023) MYTHO is a novel regulator of skeletal muscle autophagy and integrity. Nat Commun;14(1):1199. doi: 10.1038/s41467-023-36817-1.






