你不懂的新机制——SRSF6调控可变剪接适应缺氧反应
缺氧诱导会导致可变剪接(AS)发生巨大变化,从而细胞适应缺氧,但是具体是何种剪切因子的AS帮助细胞适应缺氧的机制仍不清楚。SR蛋白是与可变外显子结合并促进其纳入成熟mRNA的重要剪接因子,其包括SRSF1至SRSF12在内的12个家族成员。SR蛋白在缺氧条件下以细胞类型特异性的方式被差异调节。然而,SR蛋白如何调控AS影响缺氧反应和癌症进展的机制仍有较多未知之处。本研究发现SRSF4-PCE-SRSF6缺氧轴在不同肿瘤类型中均有活性,缺氧肿瘤中SRSF6高表达与不良预后相关。SRSF6的超保守PCE具有肿瘤抑制作用,并且PCE包含在缺氧中对降低SRSF6水平至关重要,这可能阻止肿瘤细胞进入缺氧适应的转移途径。本研究于2023年1月发表在《Nucleic Acids Research》IF:19.160期刊上。
技术路线:

主要实验结果:
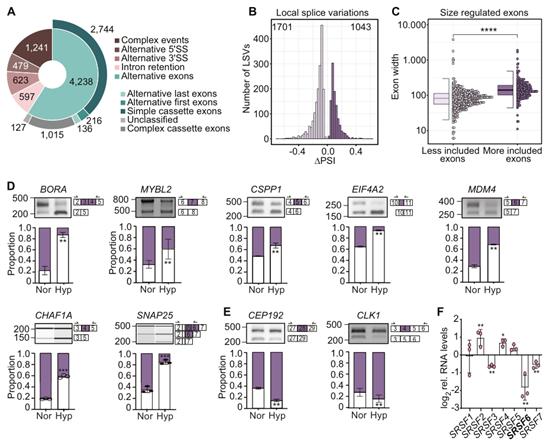
1、HeLa细胞通过整体外显子跳变适应缺氧
为更好地理解AS介导的急性缺氧(24 h; 0.2% O2)适应机制,对HeLa细胞进行测序,并用MAJIQ分析AS。总计发现7178个局部剪接变异(LSVs)在缺氧后显著(|ΔPSI|) >5%)改变(图1A)。大多数LSV影响可变盒式外显子(CEs)(4238,59%),其更常表现为跳跃性增加(图1B)。通常,跳跃的外显子比包含的外显子更短(图1C)。半定量RT-PCR验证了9个AS事件,包括7个外显子跳跃和2个外显子包含事件(图1D,E)。此外,还对RNA测序中的差异表达基因(DEGs)进行分析,GO发现RNA splicing是最显著下调的生物学过程。其反映在SR家族蛋白(SRSF1, SRSF3, SRSF6, SRSF7 and SRSF8)的水平显著下调。RT–qPCR证实SRSF3,SRSF6,SRSF7的表达在低氧组显著下调(图1F)。这些结果表明低氧降低剪接因子的表达并导致整体外显子跳跃。
2、在急性缺氧条件下SRSF6水平和剪接活性显著降低
在所有SR家族成员中SRSF6转录水平表现出最显著下调,表明低水平SRSF6可能是缺氧条件下广泛外显子跳跃的部分原因。SRSF6的一致性保守域GAAGAA在缺氧跳跃外显子中富集,而SRSF1的结合保守域GCA在被包含的外显子中富集(图2A)。与SRSF6 mRNA水平下调一致,缺氧24 h后SRSF6蛋白水平降低了60%;同时,p-SRSF6的水平显著升高(图2B)。为进一步研究缺氧对SRSF6亚细胞定位的影响,构建稳定低表达的GFP-tagged-SRSF6的海拉细胞系。结果显示,在缺氧条件下,SRSF6–GFP也下调(图2C,D,6A)。残留的SRSF6-GFP仅在NSs中检测到,其中磷酸化的SR蛋白通常以非活性形式储存(图2E)。在缺氧条件下,SRSF6的剪接功能通过转录物和蛋白质水平的降低以及磷酸化的增强而受损。
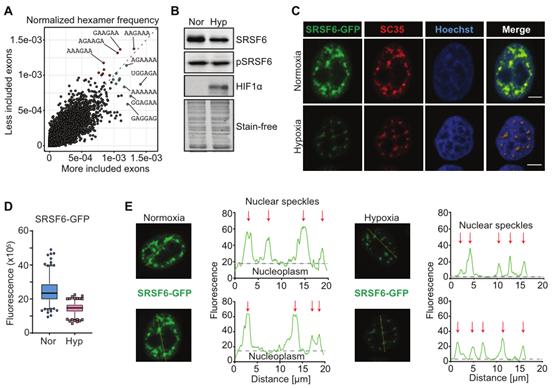
图2在急性缺氧条件下,SRSF6水平和剪接活性显著降低
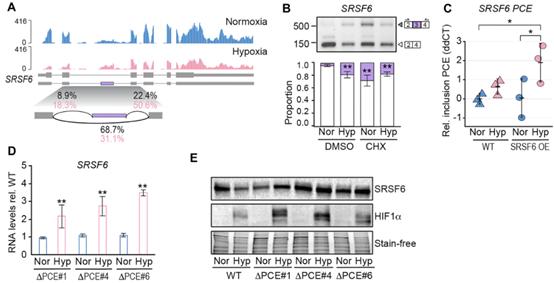
3、缺氧条件下降低SRSF6的水平需要包含毒性盒式外显子(PCE)结构域
不同癌症类型中SRSF6表达增加与不良预后相关。因此,了解SRSF6活性在缺氧条件下被调节的机制可能具有治疗意义。MAJIQ分析表明,在缺氧条件下,SRSF6的外显子3的包含增加了约3倍(图3A,B)。在常氧细胞中,CHX处理后,SRSF6-PCE和SRSF3-PCE的水平均显著升高,从而抑制NMD(图3B)。相比之下,两种PCE亚型在缺氧状态下被检测到,NMD抑制没有进一步的稳定作用(图3B)。这表明NMD在缺氧状态下会受损,PCE亚型不会通过这一途径降解。
为探究PCE包含是否导致缺氧时的SRSF6降低,作用采用CRISPR/Cas9基因编辑法移除基因组SRSF6的3’剪接位点(SRSF6ΔPCE)。RT-qPCR揭示在三种PCE缺失的亚型中,SRSF的表达在缺氧时不再下降,都表现出增长趋势(图3D)。在缺氧条件下,PCE缺失克隆中不再包含PCE,重要的是,SRSF6蛋白水平没有降低(图3E)。总之,这些数据表明,SRSF6在缺氧中的减少需要包括PCE。
4、SRSF4通过PCE包含调控SRSF6水平
PCE包合通常由3’剪接位点下游30-60 nt的SR蛋白结合促进。iCLIP数据比较了常氧状态下7种SR蛋白,显示SRSF6之后,SRSF4是SRSF6 PCE的第二个最重要的结合剂(图4A)。这表明SRSF6和SRSF4可能同时调节PCE包含和SRSF6在缺氧中的减少。为验证这一点,生成并分类了SRSF4-GFP和SRSF6-GFP过表达的HeLa细胞(图4B)。在常氧状态下,SRSF6和SRSF4 OE均能降低内源性SRSF6蛋白水平(图4B),它们在缺氧条件下进一步下降并伴随着PCE包含的增加(图3C,4C)。结合iCLIP数据,这提示,除了SRSF6自动调节外,缺氧状态下SRSF4水平的增加通过包含SRSF6 PCE直接下调SRSF6水平(图1F)。
为评估这一机制是否也存在于肿瘤中,分析了来自6个TCGA队列的肿瘤样本中的SRSF4和SRSF6表达水平以及PCE包含情况。值得注意的是,SRSF4和SRSF6水平在BRCA、COAD和STAD中呈显著的反相关,除COAD外,SRSF4水平与PCE包含度呈正相关(图4D)。作为对照,还分析了SRSF2和SRSF5,它们也与SRSF6 PCE结合,但频率较低(图4A)。纳入BRCA、CESC和LIHC肿瘤样本的缺氧评分证实,SRSF4水平与高缺氧评分呈正相关,而SRSF6水平与高缺氧评分呈负相关(图4E)。总之,这些数据表明,在低氧性癌症类型中,高SRSF4水平可能通过PCE包含降低SRSF6水平。
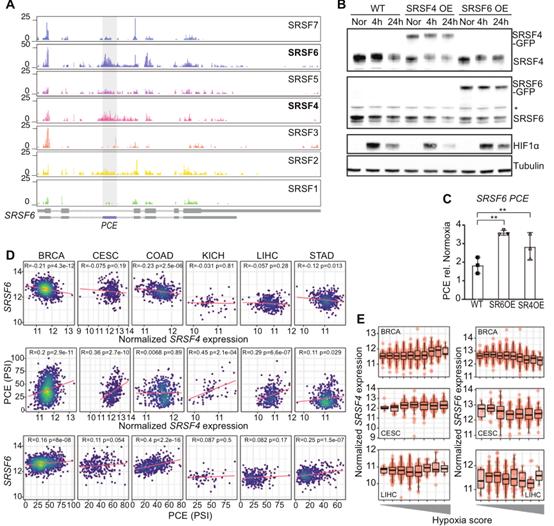
图4 SRSF4调控SRSF6水平通过PCE包含
5、在缺氧状态下维持高SRSF6水平会损害外显子跳跃
为测试降低SRSF6水平是否对低氧适应很重要,研究了持续SRSF6过表达的影响。对SRSF6 OE细胞进行RNA-seq和MAJIQ分析,以确定常氧和24小时缺氧之间的剪接变化。总的来说,SRSF6 OE细胞在缺氧条件下比WT表现出更多的剪接变化(图5A)。然而,与WT细胞相比,在SRSF6过表达细胞中,缺氧状态下,受调节的盒式外显子中的跳跃外显子的比例明显降低,表明外显子跳跃可能受损(图5B)。事实上,在WT细胞中鉴定出的1701个下调的LSVs中,1150个在SRSF6 OE细胞中没有被调控,而有62个甚至被上调(图5C-E)。
为评估SRSF6过表达是否会减弱缺氧条件下的外显子跳跃和环化,从WT数据集中选择了6个外显子跳跃事件和3个缺氧诱导的circRNA。除CSPP1外显子5外,所有被选中的跳跃或环状外显子均含有大量SRSF6结合基序(GAA)。RT-PCR证实这些外显子在常氧下发生跳跃,在低氧下它们的跳跃增加,在所有情况下,在SRSF6 OE细胞中,它们的低氧驱动的跳跃减弱。引人注目的是,除CSPP1外显子5外,这些外显子的跳跃在ΔPCE细胞中也被减弱(图5E)。总之,在缺氧状态下,维持高SRSF6水平会损害外显子跳跃。
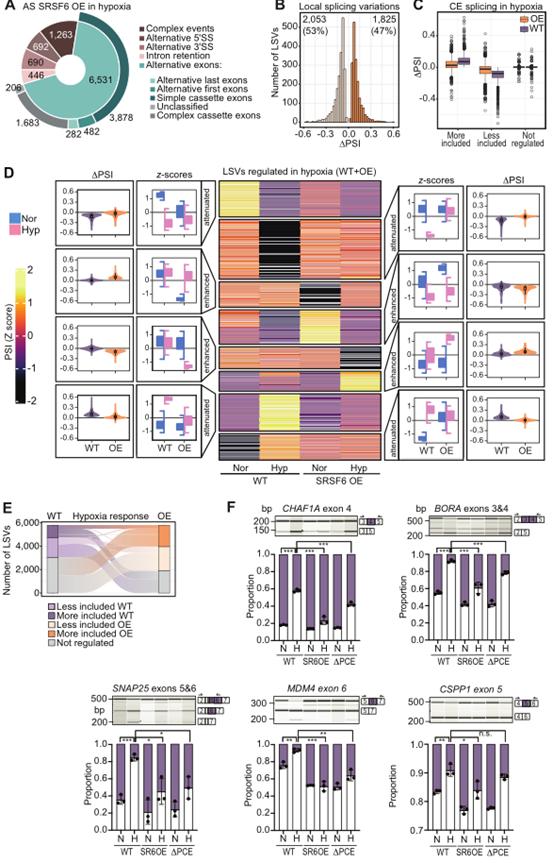
6、缺氧条件下SRSF6与3’剪切位点的结合下降
为进一步研究SRSF6介导的AS在缺氧中的调节机制,进行iCLIP(图6A)。选择较早的4小时时间点来比较SRSF6与缺氧诱导转录本的结合,因为此时HIF1α水平最高,而SRSF6水平尚未降低(图6A)。对汇集重复和严格筛选的交联事件进行峰值调用,在3145个靶基因中鉴定出18956个可重复的SRSF6结合位点(图6B)。共85.6%(16 234个)的结合位点定位于蛋白编码基因,其中CDSs结合最为富集。富含嘌呤的共识结合基序(GAAGAA)在CDS区域富集(图6C)。然而,在内含子序列中,SRSF6结合基序富集于尿苷,这表明SRSF6也可与多嘧啶束结合(图6C)。SR蛋白通常通过结合外显子剪接增强子(ESE)序列来促进剪接,但它们也可以通过结合内含子剪接沉默子(ISS)序列来抑制替代外显子的包含。事实上,在SRSF6 OE细胞中,缺氧时,CEs 3 '剪接位点上游12-13 nt被跳过,内含子中可见SRSF6结合的明显峰值(图6D,红色箭头)。该内含子峰在更多的包含外显子中不可见,且在24小时缺氧条件下显著降低,而SRSF6与这些CEs两侧外显子的结合没有改变。在下游外显子的3 '剪接位点可见到在缺氧时消失的类似峰值(图6D,红色箭头)。SRSF6在跳跃外显子中的结合率普遍高于包含外显子,缺氧24 h后结合率下降(图6D,蓝色箭头)。在SRSF6 OE细胞中专门调控的外显子上也观察到类似的缺氧敏感峰。总之,数据表明,SRSF6通过直接结合到可变外显子或3 '剪接位点上游,促进常氧状态下可变外显子的包含。
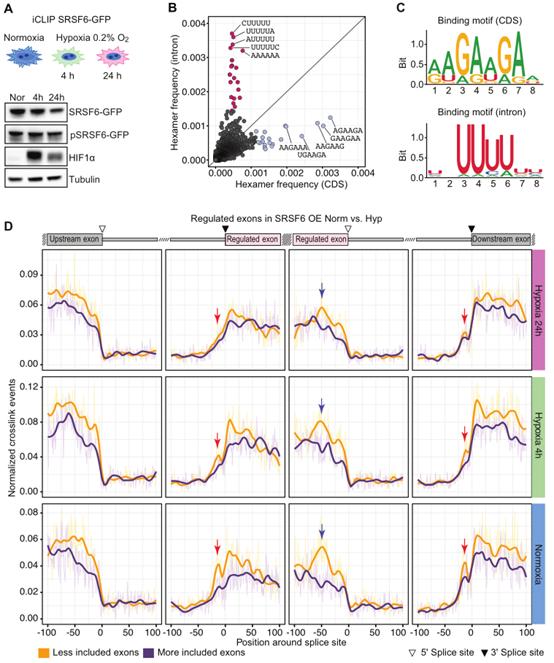
7、缺氧时SRSF6下调导致核散斑扩散
除了在AS调节中起作用外,SRSF6也是NSs的核心蛋白。有趣的是,NSs在缺氧时扩散(图7A,B)。使用标记物SC35和SRRM2进行免疫荧光实验,在SRSF6水平较低的WT和SRSF4 OE细胞中,NSs在缺氧条件下看起来更小、更多或完全消失。然而,CoCl2处理后没有观察到NS扩散,SRSF6水平保持不变,并且SRSF6水平在SRSF6 OE或SRSF6ΔPCE细胞中也明显减少,在缺氧条件下SRSF6水平仍然很高(图7C,D)。这些数据表明,SRSF6在缺氧状态下的减少是NS扩散所必需的。
文献报道NS的扩散也会影响lncRNA MALAT1的流动性,它存在于这些凝析液中。根据iCLIP数据,MALAT1是SRSF6结合密度最高的转录本,在缺氧条件下进一步增加(图7E,F)。SRSF6沿着MALAT1的整个长度密集包覆,支持SRSF6在将这个lncRNA拴在NS上的直接作用(图7F)。当SRSF6水平较低时,MALAT1水平在缺氧时升高,lncRNA在NSs和核质中检测到。相反,在SRSF6过表达细胞中,MALAT1仅在NSs中可检测到,并与SRSF6和NS标记物SC35完全共定位(图7G)。这说明在缺氧状态下,SRSF6的下调和NS的扩散增加了MALAT1的核迁移率。为进一步测试这一点,作者量化了MALAT1的可萃取性,这与NSs或其他相分离的生物分子凝聚物中的隔离程度相关。在没有热处理的情况下,在缺氧的SRSF6 OE细胞中,MALAT1的可提取性明显低于WT细胞,而WT细胞中MALAT1在没有热处理的情况下几乎可以完全提取(图7H)。数据表明,在缺氧条件下,高水平的SRSF6会阻止NS扩散和全局外显子跳跃,并降低MALAT1的可萃取性和核迁移率。
为测试缺氧介导的SRSF6减少和NS扩散是否也发生在非癌细胞中,将HUVECs置于24小时的缺氧中。与HeLa细胞相似,SRSF6 mRNA水平在缺氧状态下降低了约5倍(图7I),SRSF6蛋白水平降低了约50%。Ss也在缺氧条件下分散(图7J),MALAT1在此条件下完全可提取,相比之下,在常氧条件下,MALAT1的可萃取性减少了3.4倍(图7K)。在测试的6个剪接靶点中,有3个显示了与缺氧HeLa细胞相同的剪接模式(图7L), MALAT1水平也增加了(图7I)。这表明,由SRSF6减少介导的急性缺氧反应在HeLa细胞和HUVECs细胞中是保守的,但AS的结果可能是细胞类型特异性的,可能取决于转录组和SRSF6与其他剪接调节蛋白的相互作用。
总之,这些结果表明,在缺氧条件下,SRSF6的减少允许NS扩散,这导致了包括MALAT1在内的储存的剪接因子的释放。这促进了应激相关基因的外显子跳跃和AS,并在低氧应激中提供了SRSF6介导的除直接影响AS外的另一层基因调控。
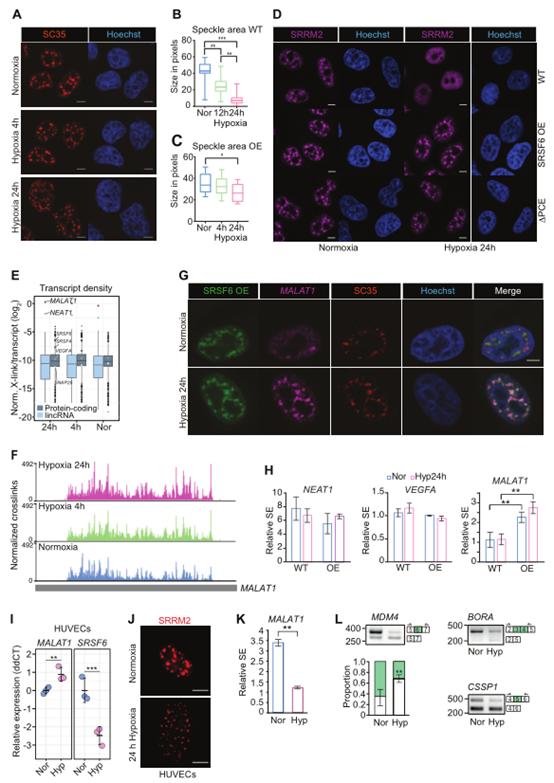
图7 在低氧条件下,SRSF6的下调使NS扩散并增加MALAT1的核迁移率
8、在缺氧状态下维持高水平的SRSF6抑制应激反应,并导致DNA损伤和基因组不稳定
为评估低氧条件下高SRSF6水平对细胞生存和适应的影响,进行了DEGs分析。与WT细胞相比,SRSF6过表达细胞在缺氧条件下显示出更少的DEGs(582下调,1409上调),表明在SRSF6过表达细胞中缺氧反应被部分抑制。通过对不同条件下基因表达模式的聚类分析,发现了几个聚类的DEGs,在这些DEGs中,在WT细胞中观察到的缺氧诱导的上调或下调在SRSF6 OE细胞中减弱(图8A)。在低氧条件下,SRSF6 OE细胞中HIF1α和HIF1α诱导的蛋白BNIP3的表达水平均低于WT细胞(图8B)。在缺氧条件下,SRSF6 OE细胞的微核数量也明显高于WT(图8C,D),在DNA受损的细胞中,这是染色体不稳定的指标。SRSF6基因中的PCE失活引起了相同的染色体不稳定性表型(图8C,D)。在WT细胞缺氧时清晰可见的应激颗粒,在SRSF6 OE和ΔPCE细胞中完全被抑制,这与高SRSF6水平抑制一般应激反应一致(图8E)。
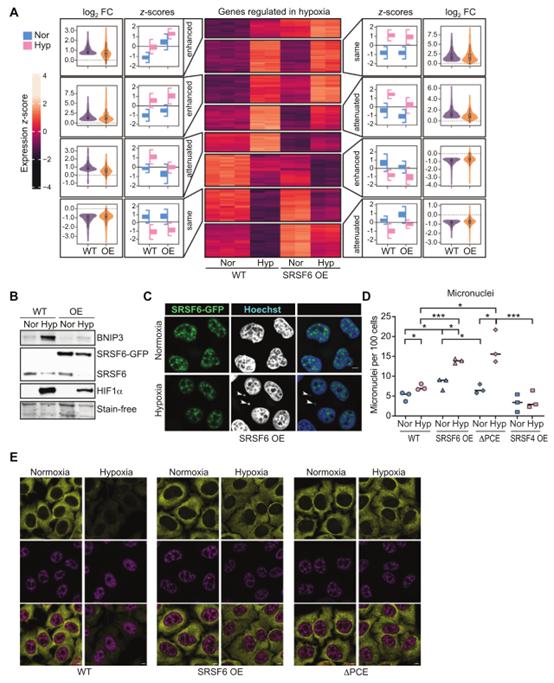
图8 在缺氧条件下维持高水平SRSF6抑制压力响应并导致基因组不稳定
总之,本研究确定SR蛋白SRSF6是控制缺氧时适应性AS反应的一个关键因素(图9)。利用HeLa细胞发现,SRSF6的活性在急性缺氧时通过总蛋白水平的降低和SRSF6磷酸化的增强而降低。前者是通过以牺牲蛋白质编码的SRSF6异构体为代价,将PCE纳入其自身的转录本中实现的。PCE的包含主要是由SRSF4和SRSF6本身促进的,SRSF4的水平和活性在缺氧时增加,而SRSF6本身则与PCE大量结合。数据表明,SRSF6在缺氧时失活有双重目的:(i)它允许SRSF6的直接目标外显子跳跃和剪接特定的circRNA,这可能在缺氧适应中完成特定的功能;(ii)它在缺氧时引起NS的分散,释放储存的剪接因子,预计会引起基因表达和剪接的整体变化,正如在缺氧观察到的那样。
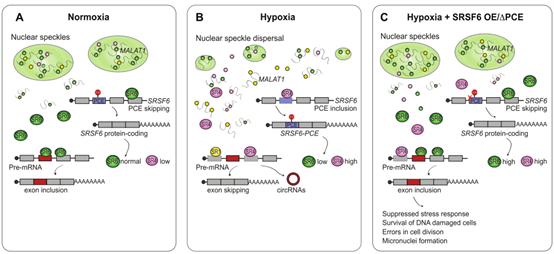
图9 SRSF6调控缺氧适应的模式图
参考文献:
de Oliveira Freitas Machado Camila., Schafranek Michal., Brüggemann Mirko., Hernández Cañás María Clara., Keller Mario., Di Liddo Antonella., Brezski Andre., Blümel Nicole., Arnold Benjamin., Bremm Anja., Wittig Ilka., Jaé Nicolas., McNicoll François., Dimmeler Stefanie., Zarnack Kathi., Müller-McNicoll Michaela.(2023). Poison cassette exon splicing of SRSF6 regulates nuclear speckle dispersal and the response to hypoxia. Nucleic Acids Res, 51(2), 870-890. doi:10.1093/nar/gkac1225






