当杀手变成小偷:PD-1胞啃作用抑制NK细胞消除肿瘤的能力
胞啃作用(trogocytosis)调节免疫反应,其分子机制尚不清楚。在白血病小鼠模型中,淋巴细胞对肿瘤细胞进行高速率的胞啃作用。自然杀伤细胞(NK)和CD8+ T细胞在进行胞吞作用时,都从白血病细胞获得检查点受体PD-1。体外和体内研究表明,NK细胞表面的PD-1并非内源性表达,而是完全来源于白血病细胞,并以SLAM受体依赖的方式表达。通过胞啃作用获得的PD-1能有效抑制NK细胞的抗肿瘤免疫。克隆性浆细胞疾病患者的PD-1促红细胞增多得到证实,其中PD-1染色的NK细胞也可染色肿瘤细胞标记物。我们的研究结果除了揭示了PD-1在NK细胞和细胞毒性T细胞上存在的一种以前未被认识的机制外,还揭示了免疫细胞接触肿瘤细胞时发生的膜转移的免疫调节作用。本文于2022年4月发表于Science Advances (IF=14.957)。
技术路线:
结果:
(1) NK细胞从肿瘤细胞获取PD-1
小鼠NK细胞在体外被一组炎症介质急性刺激时,未能在蛋白水平上上调PD-1。缺乏PD-1诱导与Pdcd1位点的表观遗传学分析相一致,在细胞因子刺激之前或之后,脾脏NK细胞中都无法获得Pdcd1位点,与NK细胞中另一种检查点受体(Tigit)的启动子或CD8+ T细胞中的Pdcd1位点形成对比(补充图未展示)。
考虑到PD-1在NK细胞上表达的相互矛盾的证据,我们假设NK细胞不是内源性表达PD-1,而是从其他细胞获得PD-1。为了验证这一假设,我们最初使用了RMA细胞,它来源于小鼠T细胞的转化,表达高水平的PD-1(图1A,红色)。我们生成了表达同基因标记Thy-1.1 (C57BL/6小鼠不表达Thy-1.2等位变异)的RMA细胞,并使用CRISPR-Cas9靶向PD-1 (RMA-pdcd1−/−Thy1.1)(图1A,分别为蓝色和紫色)。当与RMA细胞孵育时,来自Pdcd1+/+和Pdcd1−/−小鼠的NK、T和B细胞均表达PD-1阳性,而RMA-Pdcd1−/−细胞则不表达PD-1(图1B, C),这表明PD-1不是由先天和适应性淋巴细胞内源性表达的,而是在这些环境中从肿瘤细胞获得的。使用从Pdcd1+/+或Pdcd1−/−小鼠中分离的NK细胞(纯度约为90%)获得一致的结果(图1D)。无论PD-1在肿瘤细胞上是否表达,免疫细胞表面都能大量检测到Thy-1.1(图1B, C)。为了确定RMA细胞内源性表达的其他蛋白是否被NK细胞获得,我们将表达cd45.1的NK细胞与表达CD45.2的RMA细胞共培养。结果表明,当与RMA细胞相互作用时,NK细胞获得了几种它们不会内源性表达的蛋白质。
我们接下来使用了C1498细胞,这是常用的白血病模型。部分C1498细胞(约5%)在培养中内源性表达PD-1(图2A)。我们对PD-1+C1498细胞进行分类,确认它们在培养2周后稳定表达PD-1(图2B),然后与来自Pdcd1+/+或Pdcd1−/−窝友的脾细胞孵育。根据RMA细胞获得的结果,当与C1498细胞孵育时,Pdcd1−/−小鼠的NK细胞和CD8+ T细胞都获得了PD-1,如果肿瘤细胞具有更高的PD-1表达,则获得PD-1的几率更高(图2C)。在Pdcd1−/−小鼠中观察到的PD-1染色与在Pdcd1+/+小鼠中观察到的PD-1染色非常相似,这表明即使在C1498模型中,大部分PD-1也不是由免疫细胞内源性表达,而是来自肿瘤细胞。使用Pdcd1−/−NK细胞纯化的NK细胞重复类似实验。24小时后,NK细胞与PD-1+C1498细胞孵育后,PD-1染色呈阳性(图2D)。PD-1染色在72小时后进一步增加,同时与C1498亲本细胞孵育的NK细胞发生了变化(图2D)。这些数据表明NK细胞和CD8 T细胞在体外从白血病肿瘤细胞系获得PD-1。
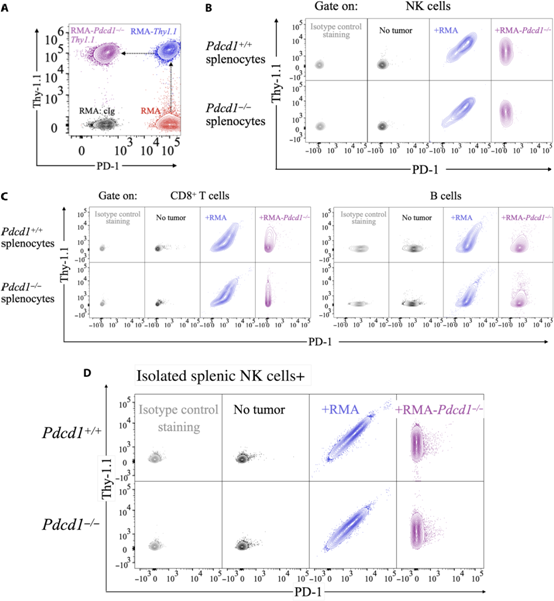
图1:淋巴细胞从RMA癌细胞获得PD-1和Thy-1.1
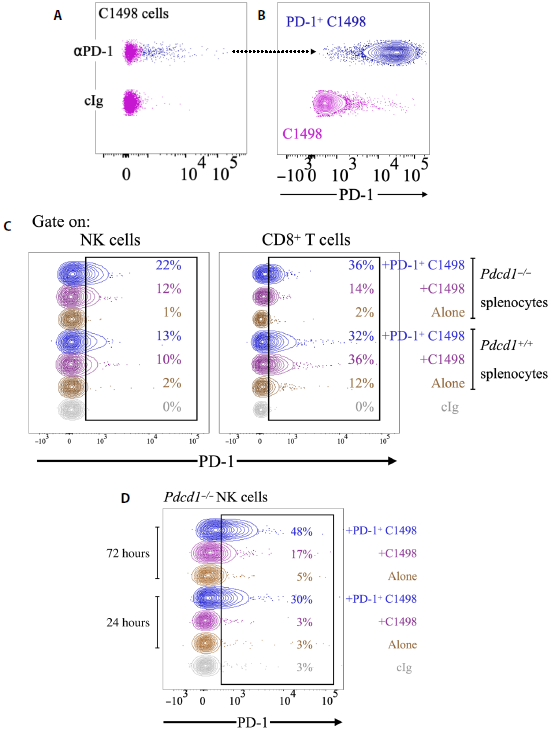
图2:NK细胞和T细胞从C1498癌细胞中获得PD-1
(2) 胞啃作用负责PD-1从肿瘤向NK细胞的细胞间转移
一旦我们确定NK细胞从肿瘤细胞中获得PD-1,我们就研究了胞啃作用是否负责PD-1的转移。细胞-细胞接触是胞啃作用所必需的。与我们的假设一致,PD-1是通过胞啃作用获得的,与肿瘤细胞一起培养的Pdcd1−/−NK细胞未能对PD-1和Thy-1.1进行染色(图3A, B)。此外,用RMA细胞修饰的上清液培养的NK细胞未能对PD-1进行染色(图3)。这些实验揭示了细胞间的接触是NK细胞获取PD-1所必需的,并表明可溶性或外泌体PD-1不负责PD-1的转移。
虽然目前还没有一种特定的胞啃作用的药理抑制剂,但已知阻断三磷酸腺苷(ATP)合成或肌动蛋白聚合会干扰胞啃作用。与PD-1是通过NK细胞的胞啃作用获得的观点一致,叠氮化钠或抗霉素A(两者都阻止ATP合成)或拉赤菌素A(阻止肌动蛋白聚合)预处理NK细胞,导致PD-1和Thy-1.1获取的强烈减少(图3E, F)。最后,用放线菌素D(阻止转录)预处理NK细胞,并没有阻止Pdcd1+/+NK细胞对PD-1的染色。证实NK细胞表面的PD-1蛋白并非来源于内源性Pdcd1转录本(补充图未展示)。
蛋白质通过胞啃作用的转移伴随着膜脂的转移。PD-1转移与从肿瘤细胞中获取脂质相结合,如实验所示,NK细胞与先前用CellVue标记的RMA细胞共培养,CellVue是一种嵌入细胞膜脂质区域的染料(图3G)。不仅NK细胞对该染料呈强烈阳性,而且PD-1染色在从肿瘤细胞中获得脂质的NK细胞上检测得更丰富(图3G)。
为了获得PD-1被NK细胞胞啃的直接证据,我们用PD-1绿色荧光蛋白(GFP)融合蛋白补充PD-1缺陷的RMA细胞。在活体成像实验中,NK细胞与肿瘤细胞共孵卵几分钟后获得GFP信号(补充图未展示)。这些实验表明,PD-1与其他蛋白质一起,通过NK细胞的胞啃作用获得。

图3:Trogocytosis (胞啃作用)负责PD-1从肿瘤向NK细胞的细胞间转移
(3) SLAM受体驱动NK细胞对肿瘤细胞中PD-1的胞啃作用
从供体细胞获取蛋白质可以通过受体-配体接合来促进,这一过程被称为反式内吞作用,已知NK细胞介导。在培养中,NK细胞不表达PD-L2,但表达PD-L1 (图4A),因此,PD-L1可以作为反式内吞作用驱动的PD-1获取的配体。然而,饱和剂量的PD-L1阻断抗体并没有减少PD-1的获取(图4B, C)。用一种抗体阻断RMA细胞上的PD-1也得到了类似的结果,这种抗体可以阻止PD-L1的结合。这些实验不仅表明PD-1/PD-L1的结合不是PD-1转移所必需的,而且还表明PD-1抗体与Fc受体的接合不能促进胞吞作用。我们使用来自两种不同小鼠品系的PD-L1缺陷NK细胞寻求遗传证实:全身PD-L1敲除(Cd274−/−)和NK细胞特异性PD-L1敲除(Ncr1+/Cre×Cd274fl/fl),我们将其与PD-1缺陷小鼠(Pdcd1−/−Ncr1+/CreCd274fl/fl)进行杂交。PD-L1缺陷NK细胞获得PD-1和Thy-1.1的水平与PD-L1表达对照组分离的NK细胞相似(图4D, E)。在CD8+ T细胞和B细胞中,PD-L1对于PD-1和Thy-1.1的获取也是不可或缺的(补充图未展示)。
SLAM受体是造血细胞之间细胞-细胞相互作用的重要介质,不仅在NK细胞中大量表达,还在T细胞和B细胞中大量表达。考虑到PD-1同时被先天和适应性淋巴细胞胞啃,我们假设SLAM受体促进了PD-1的胞啃。为了验证这一假设,我们将整个SLAM位点被删除的小鼠脾细胞与肿瘤细胞一起培养,然后评估NK细胞、T细胞和B细胞的PD-1和Thy-1.1染色。与我们的假设一致,来自SLAM缺陷小鼠的NK细胞不能从RMA细胞获得PD-1(图4F)。不仅PD-1的获取被取消,而且SLAM缺陷的NK细胞不能与肿瘤细胞进行胞吞作用,如缺乏Thy-1.1转移所示(图4F)。由于SLAM受体在许多白细胞中广泛表达,我们研究了NK细胞的细胞内表达是否对PD-1嗜噬作用是必需的。为此,我们从CD45.1 (SLAM-充足)或CD45.2 (SLAM-缺乏)小鼠中分离出脾脏NK细胞,并以竞争性或非竞争性方式与RMA细胞共培养。缺乏SLAM受体的分离NK细胞从肿瘤细胞获取PD-1的效率较低。这不仅在SLAM充足和SLAM缺乏细胞与肿瘤细胞共培养时是正确的,而且在竞争环境中也是如此,在肿瘤细胞存在的情况下,两种基因型一起培养(图4G)。
考虑到SLAM受体在介导细胞-细胞相互作用中的重要性,我们分析了其他粘附分子的缺失是否也会干扰胞啃作用。LFA-1是一个关键的粘附分子,但缺乏CD11a表达(LFA-1的亚基)的NK细胞在PD-1或Thy-1.1获取方面并不存在缺陷(补充图未展示)。NKG2D是一种由NK细胞普遍表达的激活受体,它也不参与介导NK细胞和RMA细胞之间的胞啃作用(补充图未展示)。这些结果表明SLAM受体介导PD-1从肿瘤到免疫细胞的胞啃作用。
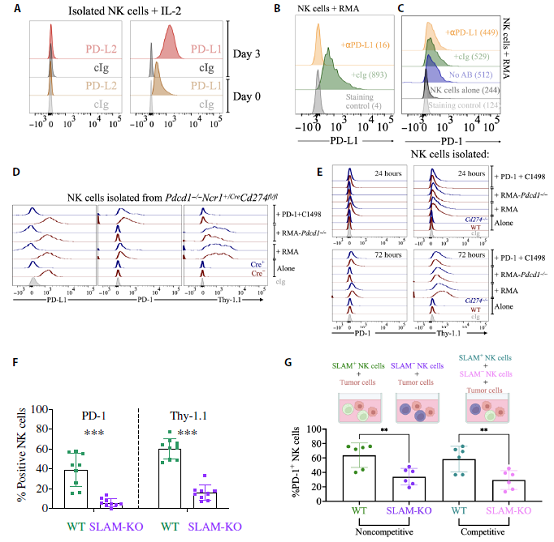
图4:SLAM受体是胞啃作用所必需的
(4) 活化的NK细胞在体内从肿瘤细胞获得PD-1
我们进行了体内研究以确定瘤内NK细胞是否胞啃PD-1。将Pdcd1+/+或Pdcd1−/−littermates与表达Thy-1.1的RMA或RMA-Pdcd1−/−细胞一起注射,当肿瘤达到~300 mm3时,我们分析瘤内淋巴细胞的PD-1染色(补充图未展示)。在所有小鼠队列中,NK细胞浸润肿瘤,Thy-1.1染色强烈(图5A-D, y轴),表明体内发生了胞啃现象。只有当肿瘤细胞不仅在Pdcd1+/+小鼠中表达PD-1,而且在Pdcd1−/−小鼠中也表达PD-1时,NK细胞表面才检测到高水平的PD-1(图5A, C相对于B, D)。这些数据表明,PD-1不仅被肿瘤浸润的NK细胞获得,而且在RMA模型中,胞啃作用是导致PD-1在NK细胞表面存在的主要机制。对CD8+ T细胞的观察结果一致(图5A-D)。Pdcd1−/−小鼠两侧注射RMA或RMA-Pdcd1−/−细胞,只有NK细胞浸润RMA肿瘤,但没有PD-1缺陷肿瘤或脾脏NK细胞,PD-1染色(图5E, F)。这些数据表明NK细胞从肿瘤微环境中的癌细胞获得PD-1。
PD-1染色在活化的NK细胞上更高。对Pdcd1−/−小鼠浸润RMA肿瘤的NK和T细胞的分析证实,PD-1+NK和T细胞对Sca-1和CD69等激活标记的染色也更亮(图5G)。当分析肿瘤微环境中PD-1+与PD-1−NK细胞时,我们发现获得PD-1的NK细胞更被激活,表达更高水平的激活受体,并且分布在CD11b/CD27定义的三种成熟状态,略微偏向成熟且有功能的CD11b+CD27+ (R2)细胞(补充图未展示)。我们没有观察到与KLRG1表达的相关性,只注意到与NKG2A的弱相关性(补充图未展示),而其他检查点受体包括CTLA-4, TIM3和TIGIT只是低表达。获得PD-1的NK细胞是更好的干扰素-γ(IFN-γ)生产者,并且脱颗粒性更强(补充图未展示)。这些数据表明,与肿瘤细胞相遇激活的NK细胞也是更容易获得PD-1的细胞,因此更容易被PD-1抑制。
我们在体内测试了SLAM受体对PD-1胞啃作用的需求。与体外实验一致(图4F, G),浸润RMA肿瘤的SLAM缺陷NK细胞获得较低水平的PD-1和Thy-1.1(图5H),突出了SLAM受体作为胞啃作用的驱动因素的重要性。

图5:瘤内淋巴细胞从肿瘤细胞获得PD-1
(5) 通过胞啃作用获得的PD-1抑制NK细胞对癌症的反应
一旦我们确定NK细胞在体内胞啃PD-1,我们就试图确定胞啃PD-1是否抑制抗肿瘤免疫。使用CRISPR-Cas9,生成了缺乏PD-1表达的RMA-S-Pdl1变体(图6A)。注射到Pdcd1−/−小鼠(其中NK细胞上PD-1的唯一来源是肿瘤细胞)时,缺乏PD-1表达的肿瘤细胞的生长明显减慢(图6B)。然而,缺乏PD-1并不会延迟体外细胞的生长,也不会阻止RMA-S-Pdl1-Pdcd1−/−细胞在免疫缺陷小鼠中生长肿瘤(图6C)。结果表明,缺乏PD-1的肿瘤细胞形成异位肿瘤的能力降低,而不是具有细胞固有的生长缺陷,因为它们不能通过PD-1转移抑制NK细胞。
通过RMA-S-Pdl1模型,我们先前证明PD-1阻断可以挽救NK细胞在体内控制肿瘤生长的能力。考虑到PD-1在肿瘤细胞中的表达以细胞外源性方式促进体内生长,我们认为PD-1阻断剂的治疗作用也应在Pdcd1−/−小鼠中观察到。当我们用PD-1阻断抗体(RMP1-14)注射RMA-S-Pdl1细胞治疗PD-1缺陷小鼠时,肿瘤生长显著减少(图6D)。当我们向PD-1缺陷小鼠注射PD-1缺陷RMA-S-Pdl1细胞时,PD-1阻断剂没有治疗效果(图6E)。
为了证实肿瘤来源的PD-1抑制了NK细胞,而没有其他免疫反应成分,我们在使用单克隆抗体(PK136)减少NK细胞的小鼠中注射了RMA-S-Pdl1细胞,并用PD-1阻断剂治疗小鼠。NK细胞的减少足以消除阻断抗体的治疗效果,而PD-1阻断在对照组中延缓了肿瘤的生长(图6F)。PD-1抗体在免疫受损小鼠中失效(图6G)。免疫受损小鼠体内肿瘤细胞的类似生长(图6G)排除了PD-1阻断抗体的肿瘤细胞固有效应。
为了排除PD-1抗体的治疗效果是由于NK细胞对PD-1抗体包被的癌细胞可能介导的抗体依赖细胞细胞毒性(ADCC),我们使用了一种缺乏与Fc受体结合能力的抗PD-1的工程版本(Fc-silent RMP1-14)。使用Fc沉默的PD-1抗体治疗可以延缓表达PD-1的肿瘤的生长(图6H),这表明PD-1抗体在Pdcd1−/−小鼠中的治疗效果不是由于ADCC。这些结果表明,受血小板胞啃的PD-1抑制了NK细胞的抗肿瘤活性,而PD-1阻断抗体可以拯救NK细胞。

图6:NK细胞存在且肿瘤细胞表达PD-1时,PD-1阻断剂对Pdcd1−/−小鼠有效
(6) 多发性骨髓瘤患者NK细胞群对肿瘤细胞标志物和PD-1染色的鉴定
为了确定NK细胞是否从癌症患者的肿瘤细胞中获得PD-1,我们分析了来自克隆浆细胞疾病患者骨髓(BM)的NK细胞的PD-1染色。我们依赖于CD138,一种经常由无性系浆细胞表达但不由NK细胞表达的蛋白,作为替代促红细胞增多标记物。流式细胞术分析证实,在一些患者中存在高散射CD138+群体(补充图未展示),我们将其鉴定为克隆浆细胞。在大多数样本中,高散射CD138+细胞表达PD-1(补充图未展示)。NK细胞进行胞啃作用的指示来自于BM抽吸液的分析,其中鉴定出CD138+NK细胞群,在CD56brightCD16−和CD56dimCD16+NK细胞亚群中(图7,粉红色和绿色),证实了在小鼠模型中获得的结果。CD138和PD-1染色的NK细胞数量可观且一致(图7绿色),这支持了克隆浆细胞疾病患者的NK细胞从肿瘤细胞中获得PD-1和癌细胞标记物的观点。
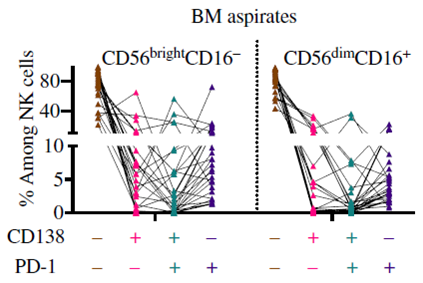
图7:NK细胞可抑制CD138和PD-1在克隆浆细胞疾病患者骨髓中的作用
结论:胞啃作用是NK细胞和T细胞从肿瘤细胞中获得PD-1的一种新机制。PD-1胞啃作用强烈依赖SLAM受体,在体内功能上抑制NK细胞消除肿瘤的能力。
参考文献:
Hasim, M. S., Marotel, M., Hodgins, J. J., Vulpis, E., Makinson, O. J., Asif, S., Shih, H. Y., Scheer, A. K., MacMillan, O., Alonso, F. G., Burke, K. P., Cook, D. P., Li, R., Petrucci, M. T., Santoni, A., Fallon, P. G., Sharpe, A. H., Sciumè, G., Veillette, A., Zingoni, A., … Ardolino, M. (2022). When killers become thieves: TrogocytosedPD-1 inhibits NK cells in cancer. Science advances, 8(15), eabj3286. https://doi.org/10.1126/sciadv.abj3286.






