简单-直接-分高:SLM2以跨突触方式塑造突触特性
突触特性的确定是神经元环路功能的基础。“末端选择”转录因子协调协调终端基因电池可以指定细胞类型的特定属性。此外,泛神经元剪接调节因子被认为与指导神经元分化有关。然而,剪接调节因子如何指导特定的突触特性的细胞逻辑仍然不清楚。本研究对小鼠海马中替代剪接调节因子SLM2的细胞类型特异性功能进行了系统的遗传学分析,证明,SLM2依赖的可变剪接(AS)以跨突触的方式专门指导突触特性的规范。本文于20233年2月发表在《Cell Reports》IF: 10.0期刊上。
技术路线:

主要实验结果:
1、SLM2的结合mRNA编码突触蛋白
在小鼠海马体中,SLM2在谷氨酸能锥体细胞中表达,但也在GABAergic中间神经元亚群中表达。其中包括定向-肺泡腔隙-分子(OLM)细胞CA1,这是一类SST阳性的中间神经元。在神经元细胞核内,SLM2主要集中在核亚结构中(图1A),让人联想起类核小体其由SLM2同源物SAM68组成。然而,在海马神经元中,只有一小部分亚核结构显示SLM2-SAM68共定位(图1B)。为确定SLM2相关的RNAs,在小鼠全脑和海马样本上使用了增强型交联和免疫沉淀(eCLIP)。77%的结合事件发生在内含子,而只有2%映射到外显子(图1C)。交叉连接诱导截断位点(CITS)分析确定了确切的蛋白质-RNA交叉连接位点,这些位点富含UWAA元件(W=U/A;图1D),这是SLM2在体外识别的motif。使用mCross(一种模拟RBP结合序列特异性和交联位点的计算方法)进行新的motif识别,显示UUWAAAA 7-mer是体内被SLM2结合的主要RNAmotif(图1E)。使用CLIPper和IDR鉴定了复制体中的高置信度SLM2结合事件(图1F)。对SLM2结合的mRNAs的GO分析显示,编码谷氨酸突触成分的mRNAs有很强的富集性(图1G)。在全脑样本的424个高置信度的SLM2目标mRNA中,有110个在SynGO45中被注释为编码突触蛋白,其中有59个突触前和49个突触后成分(图1H)。这些包括泛神经元表达的mRNA,如Nrxn1,2,3、Nlgn1、Lrrtm4、Dlgap1,2、Tenm2和Cadm1,以及优先在GABAergic中间神经元表达的突触后蛋白,如Erbb4和Gria4。在input样本中没有观察到明显的峰值,而目标mRNA中密集的UWAAmotif簇与SLM2的结合事件紧密相连(图1I)。这些实验揭示了一个编码突触蛋白的mRNAs阵列,它们在体内被内源性的SLM2结合。
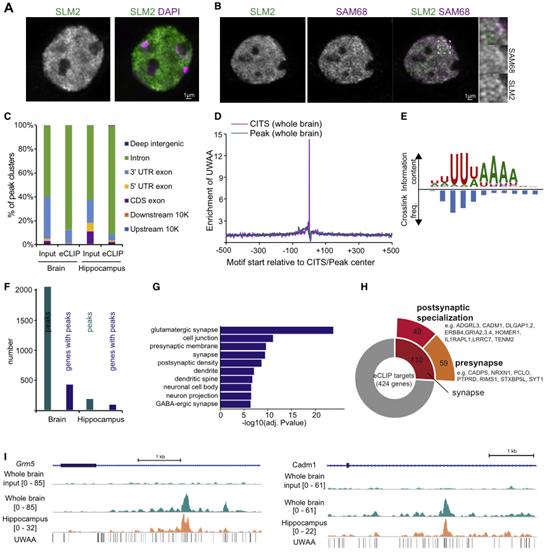
图1结合SLM2的mRNA编码突触蛋白
2、细胞类型特异性SLM2依赖外显子的鉴定
RBP的作用通常依赖于表达水平。因此,定量了海马神经元亚群的SLM2免疫反应性(图2A-B)。SLM2的表达在CA3锥体细胞(Grik4-cre)中表达量最高,在CA1锥体细胞(CamK2-cre)和SST神经元(SST-cre)中明显表达(图2B)。超过90%的遗传标记的CA1和CA3锥体细胞表达SLM2(图S2C)。相比之下,SLM2在齿状颗粒细胞中不表达(图2B)。使用RiboTrap在不同细胞类型中进行条件性消融并绘制各自细胞中的转录。分别使用CamK2-cre、Grik4-cre和SST-cre品系在海马CA1细胞,CA3锥体细胞和SST阳性GABAergic中间神经元中选择性消融SLM2,分别命名为Slm2△CamK2,Slm2△Grik4,Slm2△SST(图2C和2D)。SLM2的免疫染色证实了该蛋白在Slm2△SST出生后第16-18天(P16-18)完全丧失,在Slm2△CamK2和Slm2△Grik4在出生后第42-45天(P42-45)75%-90%的cre阳性细胞中完全丧失(图2D)。
使用RiboTrap亲和分离技术,对野生型和敲除型细胞的转录组进行了深度测绘。重复样本之间的差异很小,或者说敲除小鼠与野生型小鼠的RiboTrap样本之间的差异很小(图2E),这表明SLM2的损失并不影响这些细胞类型的终端基因电池。散点图进一步证实在整体基因表达水平上只有很小的改变(图2F)。最强烈改变的转录物是SLM2的类似物SLM1/Khdrbs2,与功能交叉抑制相一致。
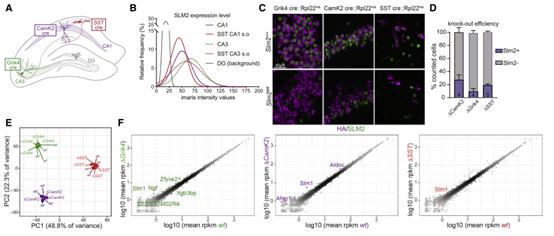
图2 海马细胞类型中SLM2的条件消融
SLM2的缺失并没有广泛地改变这些细胞类型特异性的剪接特征但改变了少量的AS事件(图3A),包括Nrxn2选择性剪接片段4外显子掺入(AS4)在三个细胞群中增加(图3A-B)。相比之下,Nrxn3的相应替代外显子仅在CA3(Grik4)和CA1(CamK2)细胞中被去调控(图3C)。Syntaxin结合蛋白5-like(Stxbp5l;也叫Tomosyn-2)中相互排斥的替代外显子e23/e24的去调控是CA1和CA3而不是Slm2△SST细胞中普遍改变的另一个剪接事件(图3A)。整合eCLIP和RiboTrap剪接分析,发现在去调节的替代外显子下游500个碱基范围内有密集的内含SLM2结合事件和UWAAmotif(图3B和3C)。这表明,SLM2的结合指导了上游替代外显子的跳跃。
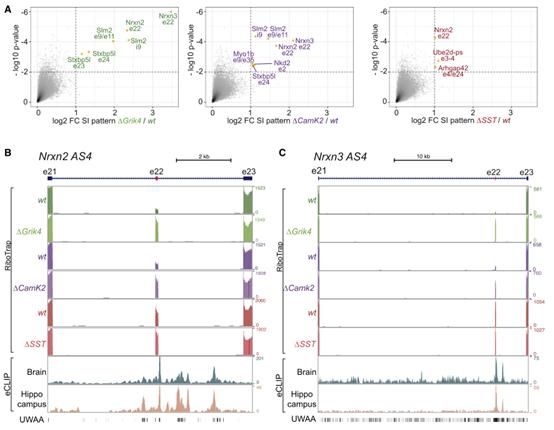
图3 SLM2直接调控编码突触蛋白的mRNA的AS
3、SLM2缺失导致细胞类型特异性突触表型
考虑到SLM2对结合和调节编码突触蛋白的mRNA具有显著选择性,所以作者探讨了SLM2消融的功能后果。在突触前CA3锥体细胞中条件消融SLM2导致CA1神经元中Schaffer侧支刺激引起的突触后电流显著增加(附图1A-C),因此,从CA3神经元中删除SLM2足以改变到突触后CA1锥体细胞的突触传递。从SST中间神经元中条理性敲除SLM2(Slm2△SST)并没有改变SST阳性中间神经元的内在特性(附图1C-F),表明SLM2不是这些细胞的特异性所必需的。然而,eCLIP分析发现了大量的SLM2与编码谷氨酸突触蛋白的mRNA结合(图1G-H),所以作者检测了Slm2△SST细胞的谷氨酸能输入。结果显示SST中间神经元的微小兴奋性突触后电流(mEPSC)振幅没有变化,但观察到mEPSC频率显著升高,表明Slm2△SST细胞上的谷氨酸能突触密度增加(图4A-E)。作者调查了对肺泡中假定的CA1轴突进行越来越多的电刺激的AMPAR介导的突触后反应,发现与较大的突触数量一致的兴奋明显增加(图4F)。此外,对同一轴突的40赫兹的刺激导致了短期促进的显著增加(图4G)。由于该突触的短期促进是通过增加递质释放介导的,这些结果表明,突触后SST间神经元的SLM2通过跨突触机制控制谷氨酸传导和这些细胞的突触招募。
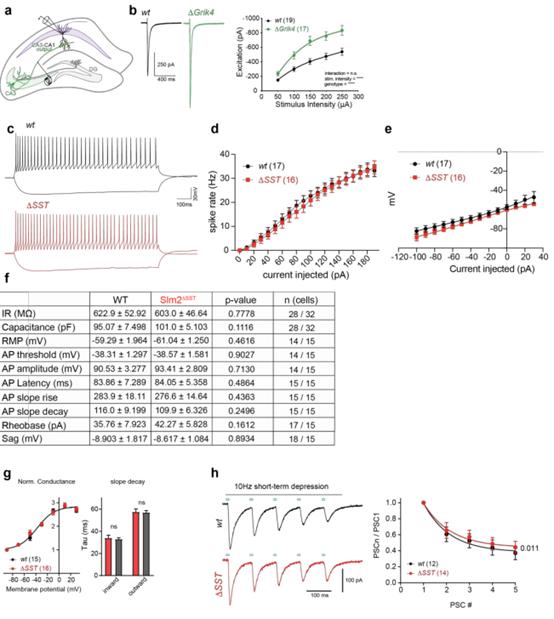
附图1Slm2条件敲除细胞的电生理分析
通过光遗传刺激SST中间神经元和全细胞膜片钳记录从CA1锥体细胞来进一步分析GABAergic SST中间神经元的输出突触。发现Slm2△SST小鼠中光遗传学诱发的突触后抑制电流的大小没有变化(图4H)。光遗传学诱发电流的动力学没有改变,表明突触后GABA A受体的组装正常(附图1G)。应用10 Hz的光遗传刺激,在野生型细胞中诱导OLM-CA1突触的抑制,使用该方案,在Slm2△SST小鼠的脑片中观察到短期抑郁有小幅但显著的减少(附图1H)。因此,SST中间神经元的SLM2选择性缺失导致谷氨酸能驱动增加到OLM中间神经元,与输出到CA1神经元的突触基本相似。
研究表明,光遗传刺激诱导的OLM中间神经元异常激活会损害物体识别实验中的物体记忆。因此,使用Slm2△SST小鼠进行新的物体识别测试。突变型和野生型小鼠在测试场地的移动能力或与物体交互的总时间方面没有差异(图4I)。在测试物体识别记忆时,野生型小鼠探索新物体的时间显著增加,相比之下,Slm2△SST小鼠与新奇和熟悉的物体互动的时间相似(图4J-K)。因此,SST中间神经元中SLM2的选择性缺失与小鼠短期记忆的特定缺陷有关。
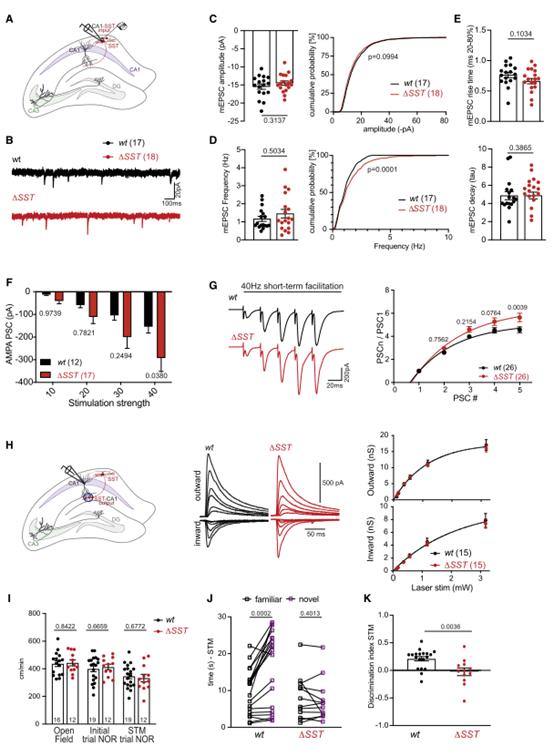
图4 SLM2通过跨突触的方式控制突触的可塑性和功能
总之,本研究表明AS因子SLM2结合编码突触蛋白的mRNA;SLM2以细胞类型特异性的方式调节剪接异构体;SLM2缺失导致突触功能的选择性非细胞自主改变;在SST中间神经元中缺乏SLM2的小鼠表现出短期记忆缺陷。
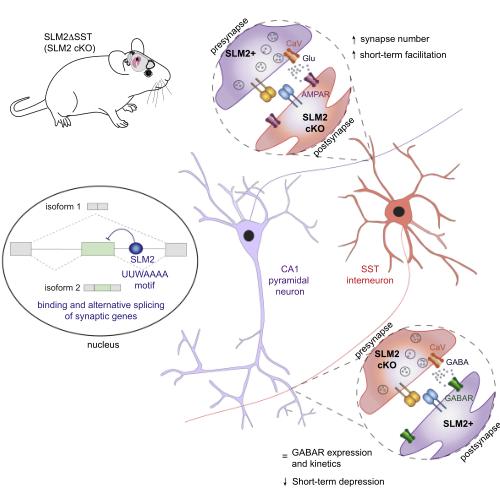
图形摘要
参考文献:
Traunmüller L, Schulz J, Ortiz R, Feng H, Furlanis E, Gomez AM, Schreiner D, Bischofberger J, Zhang C, Scheiffele P. A cell-type-specific alternative splicing regulator shapes synapse properties in a trans-synaptic manner. Cell Rep. 2023 Feb 28;42(3):112173. doi: 10.1016/j.celrep.2023.112173. Epub ahead of print. PMID: 36862556.






