METTL3通过诱导线粒体自噬促进小细胞肺癌的化学耐药性
肺癌在全球所有癌症类型中发病率和死亡率最高,其5年总生存率较差。肺癌根据其病理特征可分为小细胞肺癌(small cell Lung cancer, SCLC)和非小细胞肺癌两种亚型。SCLC因其侵袭性强、恶性程度高、易发生耐药而导致众多患者死亡。最初,大多数SCLC患者对含铂一线化疗有应答。然而,患者的反应往往不持久,容易产生化疗耐药,导致疾病复发。线粒体自噬是一种选择性自噬,参与线粒体去极化、缺氧、发育等多种生物学过程。因此,探索SCLC的耐药机制对于寻找逆转耐药的治疗靶点至关重要。既往研究表明,自噬参与了SCLC对化疗的耐药,且自噬在化疗耐药的SCLC细胞株中显著增强。然而,关于线粒体自噬是否与SCLC耐药特异性相关的报道较少。该研究发表于《Journal of Experimental & Clinical Cancer Research》,IF: 12.658。
技术路线:

主要研究结果:
1. METTL3在SCLC耐药细胞株中高表达,且与患者不良预后相关
许多研究表明,m6A修饰在胃癌、肝癌等多种实体肿瘤的化疗或靶向耐药中发挥作用。为了确定m6A是否参与SCLC化疗耐药,作者对敏感和耐药的SCLC细胞株(H69和H69AR)进行了高通量全转录组测序,并分析了m6A相关基因的表达差异。作者观察到,在化疗敏感和化疗耐药细胞系之间,与m6A修饰相关的7个基因的表达有显著差异(图1A)。采用单因素Cox回归分析这7个基因在两组SCLC患者中的表达情况,并进一步分析m6A相关基因的表达与患者预后的关系。队列1来自公共数据库GEO(GSE60052),包括79例SCLC患者的转录组和临床数据,队列2包括58例在当地医院接受治疗的SCLC患者。在总生存(OS)的单因素Cox回归分析中,在两个队列中只有METTL3与SCLC生存和预后相关(图1B-C)。队列1和队列2的生存曲线均显示,METTL3高表达与较差的OS相关,METTL3是不良预后的标志(图1D)。
为了进一步明确METTL3是否在SCLC化疗耐药中发挥关键作用,作者采用qRT-PCR和Western blot分析了METTL3在两对化疗药物敏感和耐药细胞株。METTL3在耐药细胞株H69AR和H446DDP中的mRNA和蛋白表达水平显著高于其对化疗敏感的细胞株(图1E-F)。免疫荧光也显示METTL3在耐药SCLC细胞株中高表达,主要定位于细胞核,少部分位于细胞质(图11G)。
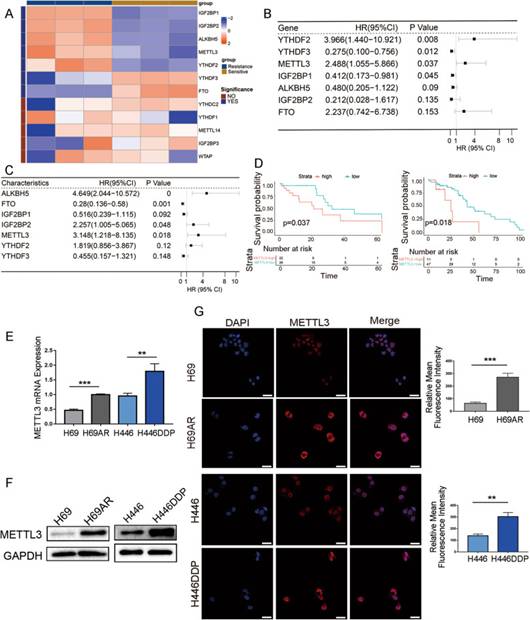
图1METTL3在SCLC中的表达及其临床意义
2. METTL3过表达促进SCLC化疗耐药
为了进一步评估METTL3是否参与SCLC化疗耐药,作者使用慢病毒转导构建了稳定敲低METTL3的H69AR和H446DDP细胞株。在化疗后24小时检测细胞的半数抑制浓度(IC50)和细胞凋亡,在耐药细胞株中敲低METTL3显著降低了化疗药物CDDP和VP16的IC50(图2A-B)。流式细胞术结果也显示,METTL3敲低组的凋亡细胞比例高于对照组,且这种差异具有统计学意义(图2C-D)。Western blot结果显示,敲低METTL3后,表明细胞凋亡强度的凋亡蛋白cleaved PARP和BAX的表达水平显著升高,而抗凋亡蛋白BCL-2的表达水平显著降低(图2E)。
为了补充在化疗耐药细胞系中的发现,作者在化疗敏感细胞系H69和H446中过表达METTL3。与空载体对照组相比,过表达METTL3的细胞化疗IC50值显著增加(图2F-G)。凋亡蛋白的Western blot和流式细胞术分析也表明,METTL3过表达显著降低了凋亡细胞的比例(图2H-J)。
为了阐明METTL3诱导SCLC化疗耐药是否依赖于其甲基转移酶功能,作者构建了METTL3野生型和突变型重组质粒(图2K)。在SCLC细胞中过表达METTL3显著增加了化疗药物的IC50,而敲除METTL3甲基转移酶结构域阻断了METTL3诱导的化疗耐药(图2L)。这些数据表明,METTL3通过其甲基转移酶结构域调控SCLC的化疗耐药过程。
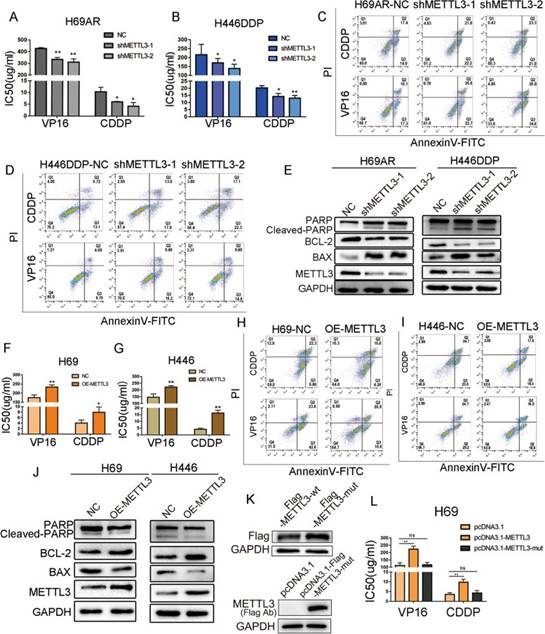
图2METTL3在体外诱导SCLC化疗耐药
3. METTL3在体内促进SCLC化疗耐药
由于铂类-依托泊苷联合方案仍然是SCLC的一线治疗选择,因此作者同时使用CDDP和VP16在体内研究METTL3是否参与SCLC的化疗耐药。裸鼠皮下注射敲低METTL3的H69AR细胞或过表达METTL3的H69细胞,并给予PBS或化疗药物(CDDP 3 mg/kg和VP-16 2 mg/kg)处理。METTL3敲低显著抑制移植肿瘤的生长(图3A),并显著降低化疗后移植肿瘤的体积(图3B-C)。通过IHC评估肿瘤异种移植中的METTL3表达(图3D)。相比之下,过表达METTL3的H69肿瘤的生长速度和体积显著高于对照H69肿瘤(图3E-G)。METTL3在异种移植瘤中的表达也通过IHC进行评估(图3H)。METTL3在体内可促进SCLC化疗耐药,METTL3有望成为逆转SCLC化疗耐药的有效治疗靶点。
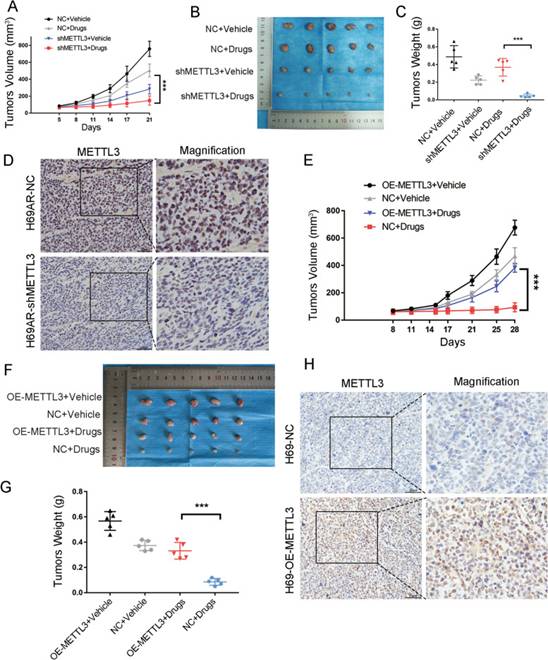
图3METTL3在体内对SCLC化疗耐药性的影响
4. METTL3促进DCP2的m6A甲基化,调控DCP2的表达
为了进一步阐明METTL3的靶基因以及METTL3促进SCLC化疗耐药的机制,作者对METTL3敲低和对照H69AR细胞进行了MeRIP-seq,敲低和对照细胞的m6A位点均高度富集了GGAC基序(图4A)。由于METTL3是一种m6A甲基转移酶,作者聚焦于敲低METTL3后m6A甲基化水平显著降低的基因,并通过倍数差异选择前20个基因。同时,对敲低或过表达METTL3的H446DDP和亲本H446细胞进行RNA-seq检测。然后,将MeRIP-seq基因集与RNA-seq基因经差异分析后取P≤0.01的交集,发现三个基因在三个队列之间存在显著差异(图4B)。为了确定METTL3的下游靶基因,作者对三个不同的交集基因进行了荧光qPCR,发现DCP2是SCLC中METTL3的靶基因(图4C-D)。来自MeRIP-seq的IGV图也显示,METTL3敲低后,DCP2编码区(CDS)的m6A甲基化水平显著降低(图4E)。MeRIP-qPCR验证了上述结果。在H69AR和H446DDP细胞中,METTL3敲低导致DCP2 m6A甲基化水平显著降低,在H69和H446细胞中,METTL3过表达显著增加DCP2 m6A甲基化水平(图4F-G)。METTL3敲低导致DCP2蛋白水平显著升高,而METTL3过表达显著降低DCP2蛋白水平(图4H-I)。总之,这些发现表明DCP2是METTL3的靶基因,并且METTL3通过诱导DCP2的m6A甲基化来下调DCP2的表达。
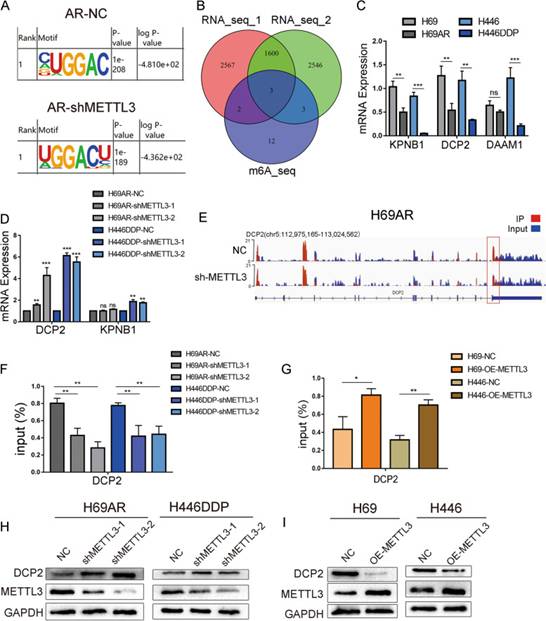
图4DCP2是METTL3的下游靶点
5. DCP2通过调控线粒体自噬影响SCLC化疗耐药
为了确定METTL3对DCP2水平的调节是否有助于SCLC的化疗耐药性,作者分别在化疗耐药和化疗敏感细胞系中构建了DCP2过表达和DCP2敲低细胞。治疗24 h后测定化疗药物CDDP和VP16的IC50。在敏感细胞中敲低DCP2显著增加了化疗药物的IC50值(图5A),而在耐药细胞中过表达DCP2显著降低了化疗药物的IC50值(图5B)。进一步的挽救实验表明,敲低METTL3后,细胞对化疗药物的敏感性增加,IC50值降低。然而,当同时敲低METTL3和DCP2时,由METTL3引起的化疗耐药性被恢复(图5C-D)。
为了进一步探索METTL3介导化疗耐药的可能下游机制,作者对MeRIP-seq数据进行了GO通路富集分析。GO分析显示自噬相关通路高度富集,在12条差异显著的自噬相关通路中,有5条通路属于“线粒体自噬伴选择性自噬”类别(图5E)。为明确线粒体自噬是否参与SCLC化疗耐药,利用共聚焦显微镜评估SCLC化疗敏感和耐药细胞的线粒体自噬。在化疗耐药细胞中过表达DCP2后,Mtphagy荧光强度显著降低,并且这一发现在分析的两个细胞系中一致(图5F)。在化疗敏感细胞中敲低DCP2后,Mtphagy荧光强度显著增加(图5G-H)。进一步的实验表明,当在耐药细胞系中敲低METTL3时,观察到线粒体自噬减少,并且这种减少的线粒体自噬通过同时敲低METTL3和DCP2而恢复(图5I-J)。综上所述,作者发现METTL3的靶基因DCP2通过影响线粒体自噬水平参与SCLC的化疗耐药过程。
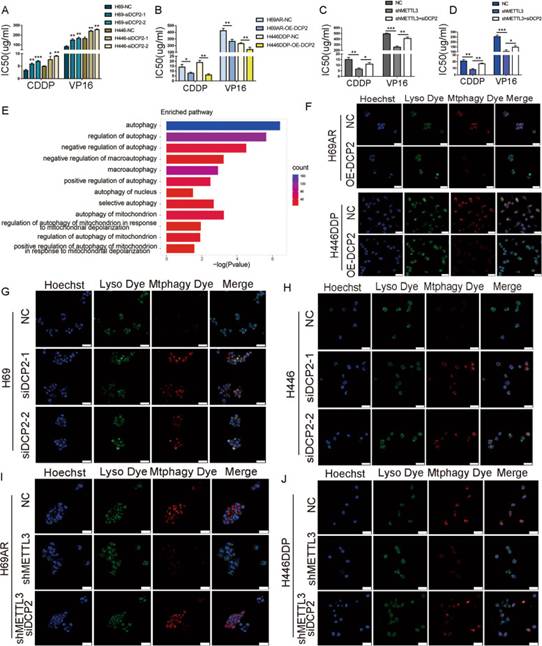
图5DCP2通过调控线粒体自噬预防SCLC化疗耐药
6. DCP2调控Pink1-Parkin通路介导的线粒体自噬
在以往的研究中,线粒体自噬通过两种经典途径发生:由膜去极化触发的pink1-parkin介导的泛素依赖性途径和受体介导的途径,其核心成分包括BNIP3、BNIP3L/NIX和PHB2。为了探究DCP2是否通过这些已知的通路调控SCLC中的线粒体自噬,作者分析了DCP2敲低对化疗敏感的细胞中线粒体自噬基因的表达变化。DCP2敲低导致Pink1和Parkin mRNA水平升高,而BNIP3、BNIP3L和PHB2的mRNA水平无显著变化(图6A-B)。同样,在过表达DCP2的耐药细胞中,Pink1和Parkin的mRNA水平降低(图6C)。这些结果表明,DCP2影响了Pink1和Parkin的mRNA稳定性,DCP2可以诱导Pink1和Parkin的降解。
为了进一步研究SCLC细胞中线粒体自噬的变化,作者分析了Pink1, Parkin, LC3和P62的蛋白水平。在化疗敏感细胞中敲低DCP2或过表达METTL3,线粒体自噬蛋白表达水平显著升高(图6D-E)。此外,在耐药细胞中过表达DCP2或敲低METTL3,线粒体自噬蛋白水平降低(图6F-G)。
进一步的挽救实验表明,当在耐药细胞中同时敲低METTL3和DCP2时,敲低METTL3引起的自噬蛋白水平的变化被恢复(图6H)。METTL3通过调控DCP2的水平,通过调控pink1-parkin介导的线粒体自噬参与SCLC化疗耐药。
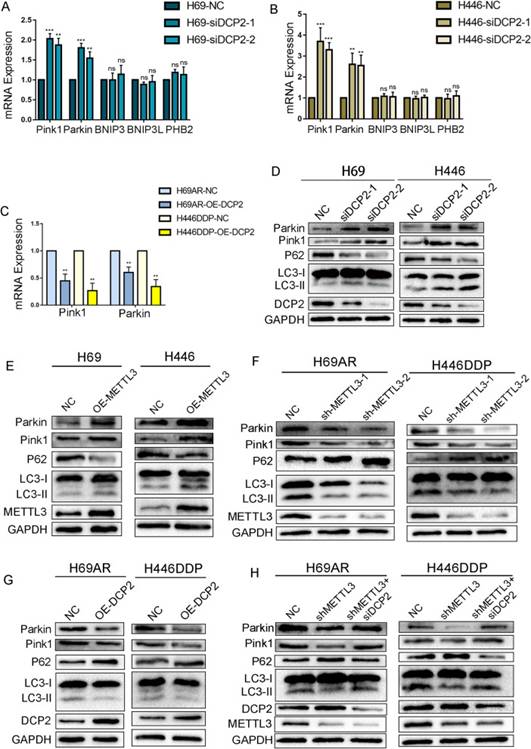
图6DCP2通过Pink1-Parkin通路调节线粒体自噬
7. DCP2调控SCLC线粒体损伤
大量研究证实,化疗耐药与线粒体功能障碍有关。线粒体自噬是通过自噬对线粒体的靶向吞噬和破坏,被认为是线粒体质量控制的主要机制。因此,作者推测SCLC化疗耐药过程中存在线粒体损伤水平的变化。线粒体膜电位(MMP)和线粒体活性氧(mtROS)是反映线粒体活性的关键指标,因为它们反映了电子传递和氧化磷酸化过程,而这两个过程是生物过程和人类癌症发病机制中ATP产生的驱动力。作者发现,在SCLC化疗敏感细胞中敲低DCP2显著减少了线粒体ROS的产生,并显著增加了MMP(图7A-B),表明敲低DCP2可以减轻化疗药物诱导的线粒体损伤。同样,在化疗耐药细胞中过表达DCP2后,DCP2过表达组化疗药物诱导的线粒体损伤增加(mtROS荧光强度增加,MMP荧光强度降低)(图7C-D)。进一步的挽救实验表明,当在耐药细胞中同时敲低METTL3和DCP2时,METTL3引起的化疗药物诱导的线粒体损伤得到恢复(图7E-F)。综上所述,METTL3在SCLC中对DCP2的调控改变了化疗药物诱导的线粒体损伤水平。
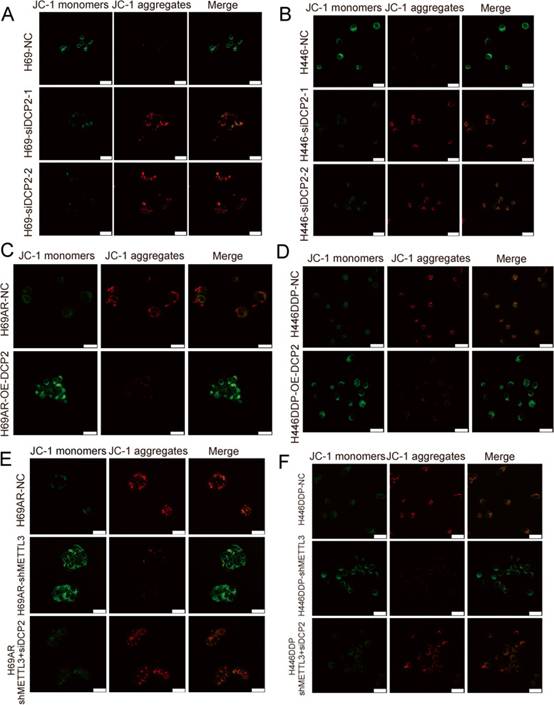
图7DCP2调节SCLC细胞线粒体损伤水平
8. METTL3抑制剂STM2457可在体内外逆转SCLC细胞的化疗耐药性
STM2457是一种新型、高选择性、口服活性METTL3抑制剂,之前在一项急性白血病研究中已经报告了STM2457。用不同浓度的STM2457处理正常肺上皮细胞(HBE),确定STM2457能够在不影响正常肺上皮细胞增殖的情况下抑制SCLC细胞METTL3表达的合适浓度。分别用CDDP和VP16处理细胞24 h,检测IC50和细胞凋亡。经STM2457处理后,CDDP和VP16的IC50值显著降低(图8A-B)。流式细胞术结果也显示,STM2457处理组的凋亡细胞比例高于对照组(图8C-D)。
为观察STM2457在体内是否影响SCLC的耐药性,将6.25μM STM2457处理24 h的H69AR细胞皮下注射到裸鼠体内。与化疗药物联用时,STM2457显著抑制了移植瘤的生长速度,并显著减小了化疗后移植瘤的体积(图8E-F)。综上所述,METTL3抑制剂STM2457可以逆转SCLC患者的化疗耐药,具有治疗SCLC患者化疗耐药的潜力。
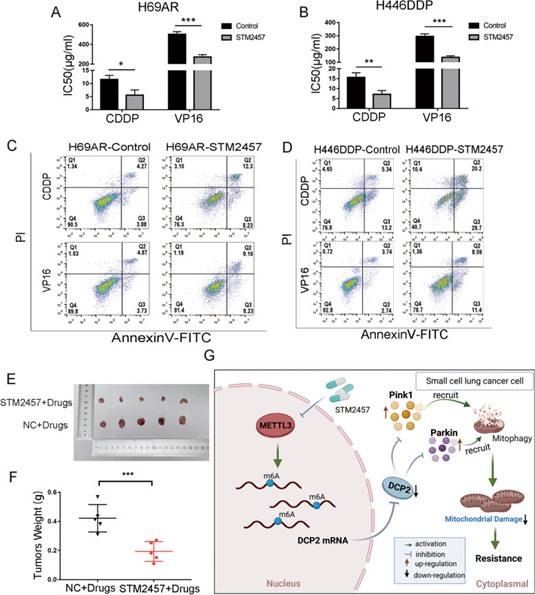
图8METTL3抑制剂STM2457在体内外均可逆转SCLC细胞的化疗耐药性
结论:
该研究证实m6A甲基转移酶METTL3通过促进DCP2的m6A,诱导Pink1-Parkin通路介导线粒体自噬,减轻线粒体损伤,参与SCLC化疗耐药过程。同时,新型METTL3抑制剂STM2457也被证明具有调节SCLC化疗耐药的作用。因此,METTL3有望成为逆转SCLC化疗耐药的新靶点。
参考文献:
Sun Y, Shen W, Hu S, Lyu Q, Wang Q, Wei T, Zhu W, Zhang J. METTL3 promotes chemoresistance in small cell lung cancer by inducing mitophagy. J Exp Clin Cancer Res. 2023 Mar 17;42(1):65.






