MYC介导的PDAC对曲美替尼和HCQ的耐药性可通过CDK4/6和溶酶体抑制来克服
KRAS>RAF>MEK1/2>ERK1/2信号通路的药理抑制对胰腺导管腺癌(PDAC)患者没有临床益处。联合抑制MEK1/2(使用曲美替尼[T])和自噬(使用氯喹[CQ]或羟氯喹[HCQ])在临床前模型和患者(患者1)中显示出显著的抗肿瘤作用。然而并非所有患者对T/HCQ方案有反应,患者1最终发展为耐药疾病。我们报告了原发性或获得性耐药与围绕c-MYC的局灶性DNA拷贝数增加有关。c-MYC在PDAC细胞系中的异位表达使其具有T/HCQ抗性。CDK4/6抑制剂palbociclib (P)也诱导自噬并覆盖c-MYC介导的T/HCQ耐药,因此P/HCQ促进了T/HCQ耐药PDAC肿瘤的消退,c-MYC表达升高。患者1的P/HCQ治疗导致生化疾病反应。这些数据表明,c-MYC表达升高既是T/HCQ抗性的标志,也是一种中介,这种抗性可以通过使用P/HCQ来克服。本文于2023年3月发表于Journal of Experimental Medicine(IF=17.579)。
技术路线:

结果:
(1) 在对曲美替尼+HCQ显示先天或获得性耐药的PDACs中检测到c-MYC表达升高
我们先前报道了一例PDAC转移性疾病患者(患者1)在曲美替尼(2mg/d)联合HCQ治疗(1200mg/d, T2/HCQ1200)。基于描述T/HCQ抗肿瘤作用和患者1的症状的临床前数据,我们治疗了第二名患者(患者2),其疾病也在所有标准护理PDAC治疗中进展(图1A)。患者2接受了曲美替尼(2mg/d)+HCQ (400mg/d; T2/HCQ400)降至800 mg/d,然后降至1200 mg/d (T2/HCQ1200),以使潜在的毒性变得明显并减轻。患者2的CA19-9水平持续上升(图1A),在T2/HCQ1200治疗2个月后,计算机断层扫描(CT)成像显示,疾病进展与T/HCQ治疗的内在耐药性一致(图1B)。患者1最初对T2/HCQ1200治疗有反应,最终获得耐药,CT成像显示CA19-9水平升高和疾病进展(图1C, D)。随后对T/HCQ耐药肺转移进行活检,进行(1)免疫组化(IHC)分析,(2)生成患者来源的异种移植(PDX),以及(3)分析躯体肿瘤DNA。这种转移也表现出围绕c-MYC的局灶性拷贝数增加。免疫组化分析显示,相对于患者1初次手术切除时获得的原发病灶,T/HCQ耐药转移灶中c-MYC表达升高(图1E)。在T/HCQ治疗前采集的肝转移活检组织分析发现,第三例患者(患者3)也患有T/HCQ耐药疾病(图1F, G)。综合这些数据,提示c-MYC升高与T/HCQ耐药之间存在相关性。
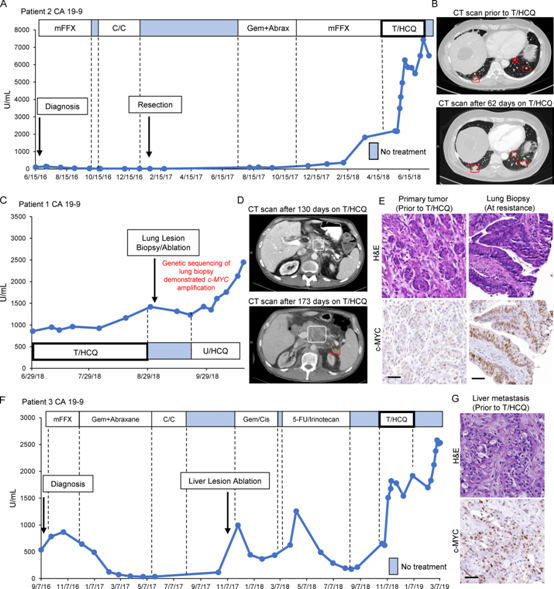
图1:c-MYC表达在对T/HCQ表现出先天或后天抗性的PDACs中升高
(2) c-MYC使PDAC对曲美替尼联合CQ治疗产生耐药性
突变激活的KRAS通过其典型效应物RAF和PI3K提高c-MYC的表达。相反,在一些PDAC模型中,MAPK信号通路的抑制可抑制c-MYC的表达。为了测试c-MYC表达的升高是否会使PDAC细胞对T/HCQ产生抗性,我们设计了PDAC细胞系,有条件地表达c-MYCWT或c-MYCT58A,后者是c-MYC的稳定形式。强力霉素(Dox)治疗导致c-MYC表达相对内源性蛋白增加约2-5倍(图2A, C)。向T/CQ处理的细胞中添加Dox可使c-MYC表达恢复到对照水平的0.7-2.2倍(图3C定量)。为了评估异位c-MYC表达是否介导体内对T/CQ的耐药性,将表达Tet-On c-MYC的HPAF-II或PDX220细胞移植到NOD/SCID小鼠中。当给荷瘤小鼠喂食对照饲料(−Dox)时,T/CQ治疗显示肿瘤停滞或消退,c-MYCWT的异位表达(图2A, C)或c-MYCT58A在喂食含有Dox的(+Dox)饲料的小鼠中,肿瘤对T/CQ治疗产生耐药性。当用T/CQ治疗的小鼠被喂食Dox饲料以诱导最初对T/CQ治疗有反应的肿瘤中的c-MYC表达时,观察到肿瘤再生,这表明c-MYC表达可以介导获得性T/HCQ耐药。相反,从最初耐药疾病的小鼠中去除Dox饲料导致肿瘤消退,这表明减少c-MYC表达可使肿瘤对T/CQ治疗敏感。T/CQ治疗组肿瘤的c-MYC和pERK降低,而与Dox联合治疗则恢复了c-MYC的表达(图2B, D)。
我们假设,T/CQ耐药细胞中c-MYC表达的降低可能会使这些细胞对T/CQ治疗敏感。极光激酶A (AURKA)的抑制剂,如alisertib,通过取消AURKA与c-MYC结合时对FBW7介导的蛋白酶体降解的保护来破坏c-MYC的稳定。alisertib治疗PANC-1细胞可降低c-MYC的表达,加入曲美替尼可进一步增强c-MYC的表达(图2E)。用(1)载体,(2)T/CQ组合,(3)单独alisertib,或(4)alisertib+T/CQ治疗小鼠携带的PANC-1肿瘤。PANC-1肿瘤对T/CQ联合或alisertib单药治疗有耐药性。然而,alisertib加T/CQ可引起肿瘤消退,这表明通过AURKA阻断降低c-MYC表达可使T/CQ治疗敏感。T/CQ和alisertib治疗组肿瘤的c-MYC表达减少,但在alisertib+T/CQ治疗组检测到c-MYC的额外减少(图2F)。曲美替尼治疗导致pERK1/2减少,而CQ治疗导致p62SQSTM1增加。这些研究表明,c-MYC表达升高对T/CQ治疗具有耐药性,降低c-MYC表达可能会增加T/CQ耐药疾病的敏感性。
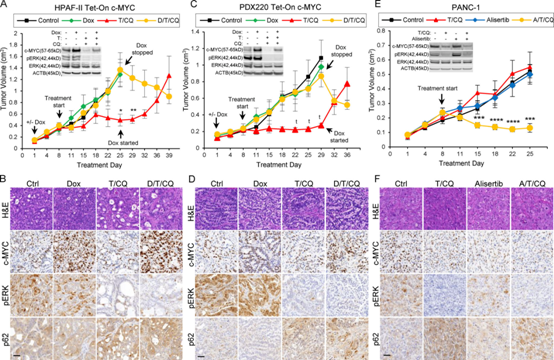
图2:c-MYC检测异种移植胰腺肿瘤对T/CQ的敏感性
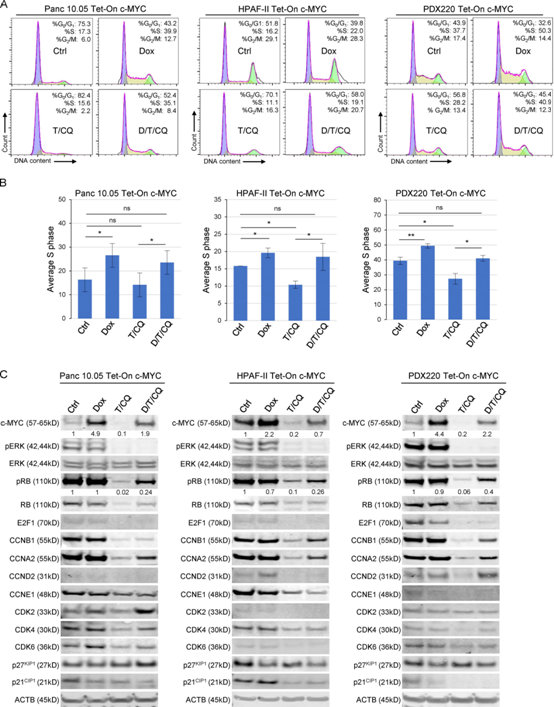
图3:c-MYC表达升高可阻止T/CQ介导的细胞周期阻滞
(3)在曲美替尼+CQ联合治疗时,c-MYC促进细胞周期进展
为了探索c-MYC如何介导对T/CQ的耐药性,我们检测了细胞分裂周期,这是由激活的KRAS和c-MYC调节的癌症的标志之一。为了测试c-MYC表达升高是否会覆盖T/cq诱导的细胞周期阻滞,我们分析了PDAC细胞系在不存在(-Dox)或存在(+Dox)异位c-MYC时的细胞周期阶段。与对照组相比,c-MYC表达增加了处于S期或G2/M期的细胞百分比,在异位c-MYC表达7 d后,S期明显增加了约5-10%(图3A, B)。T/CQ处理降低了S期或G2/M期的细胞百分比,但c-MYCWT的表达(图3A, B)或c-MYCT58A(补充图未展示)克服了这种细胞周期阻滞,并将S期细胞的百分比恢复到控制水平。这些结果表明c-MYC的过表达在体外克服了T/CQ处理后发生的细胞周期阻滞。
为了表征c-MYC表达对细胞周期机制的影响,我们对c-MYC转录控制的细胞周期调节因子进行了免疫印迹分析。c-MYCWT表达对周期蛋白或CDKs(周期蛋白依赖激酶;图3C),但c-MYCT58A增加了HPAF-II和Panc 10.05细胞中cyclins A2和B1的表达(补充图未展示)。c-MYCT58A的表达是内源性c-MYC的8-12倍,而异位c-MYCWT的表达是内源性c-MYC的2-5倍,这可能解释了c-MYCT58A对细胞周期蛋白表达的差异影响。随着时间推移,c-MYCT58A调节c-MYC靶基因的能力可能发生改变。c-MYCWT表达导致p27KIP1表达降低(图3C)。T和T/CQ处理均降低了视网膜母细胞瘤蛋白(RB)磷酸化和RB、E2F1、A-、B-、D-和E型周期蛋白、CDK2、4和6以及p21CIP1的总表达(图3C)。在曲美替尼或T/CQ处理的PDAC细胞中,c-MYCWT或c-MYCT58A的表达引发了RB磷酸化(图3C)。c-MYC并没有诱导CDK2或cyclin E1的表达。曲美替尼或T/CQ处理的细胞中c-MYC的表达增加了cyclins A2和B1的表达。在细胞周期的最小模型中,细胞周期蛋白A2和B1对于细胞周期的完成至关重要,而周期蛋白A是促进肺细胞系中c-MYC驱动细胞周期进展的主要周期蛋白。这些发现表明,c-MYC介导的细胞周期蛋白A2和B1、RB失活和p27KIP1减少的作用足以促进T/CQ存在时的细胞周期进展。这些数据表明诱导的c-MYC表达覆盖T/CQ诱导的细胞周期阻滞。
(4) 药物抑制CDK4/6诱导PDAC细胞系自噬
KRAS调控的下游信号通路通过调控D型周期蛋白及其伙伴CDK4和CDK6 (CDK4/6)促进G0>G1>S期细胞周期转变。我们评估了CDK4/6抑制剂在PDAC细胞系中调节自噬的能力。细胞周期阻滞和自噬诱导有关联。为了确定CDK4/6抑制是否调节自噬,我们用palbociclib处理了四种表达mCherry-eGFP-LC3B自噬通量报告(AFR)的PDAC细胞系(图4A, B),并观察了与对照组相比的自噬诱导。为了测试自噬是否由CDK4/6抑制而非palbociclib的脱靶效应诱导,PDAC细胞使用额外的CDK4/6抑制剂(abemaciclib或ribociclib)处理,再次诱导自噬(图4C)。与DMSO对照相比,palbociclib、ribociclib或trametinib处理的活的MIA-PaCa2AFR细胞的荧光图像显示eGFP阳性斑点的预期减少(图4D)。palbociclib、abemaciclib或ribociclib对CDK4/6的抑制导致酸性细胞器增加(图4F, G),其程度与曲美替尼或Earle’s平衡盐溶液(EBSS;饥饿控制)类似。为了进一步表征这些细胞器,我们进行了电子显微镜观察,用palbociclib或abemaciclib处理导致单膜和/或双膜自噬囊泡的大小显著增加(图4H, I)。虽然阿贝西库治疗导致囊泡数量显著增加,但帕博西库和曲美替尼治疗没有。CQ介导的溶酶体-自噬体融合抑制了Panc 10.05AFR和MIA-PaCa2AFR细胞中palbociclil诱导的自噬(图4E)。
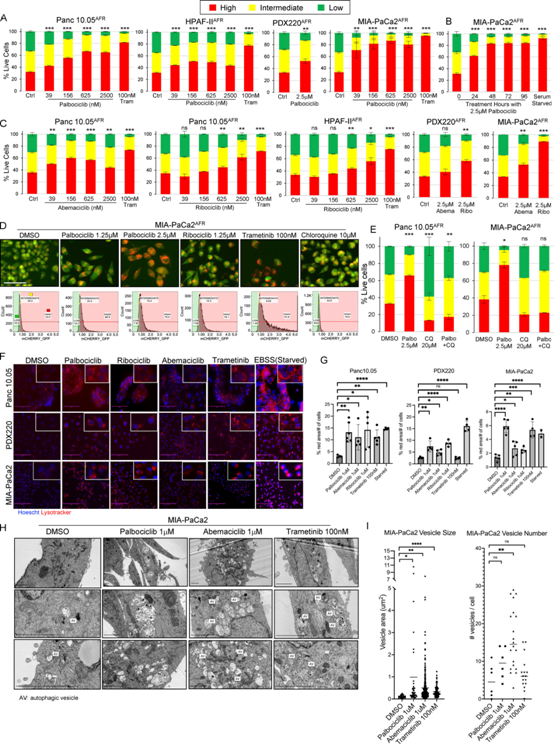
图4:CDK4/6抑制诱导人PDAC系自噬
(5) 帕博西尼联合CQ可延缓PDAC体外生长
为了确定CDK4/6联合溶酶体抑制是否会阻止细胞增殖,我们使用(1)DMSO,(2) palbociclib,(3) CQ或(4)P/CQ处理的细胞进行了体外生长测定。与对照组相比,P/CQ表现出显著的协同抗增殖作用(图5A)。与对照组相比,CQ+ribociclib或abemaciclib处理MIA-PaCa2细胞再次产生显著的抗增殖作用(图5B, C)。
用曲美替尼治疗PDAC细胞可增加G0/G1期细胞的比例;然而添加CQ没有进一步的影响(补充图未展示)。为了确定在palbociclib中添加CQ是否对细胞周期进程有进一步的影响,我们用palbociclib或P/CQ处理MIA-PaCa2、PDX220和HPAF-II细胞(补充图未展示)。与我们观察到的T/CQ相似,帕博西利加入CQ并没有增加G0/G1期的细胞比例。
为了确定P/CQ处理是否导致细胞死亡,我们评估了caspase 3/7活性。虽然在MIAPaCa2细胞中,对照组和联合组之间没有差异,但P/CQ处理的Panc 10.05细胞中caspase 3/7活性增加(补充图未展示)。这些数据表明,自噬是一种保护机制,在CDK4/6抑制时促进PDAC细胞生长。
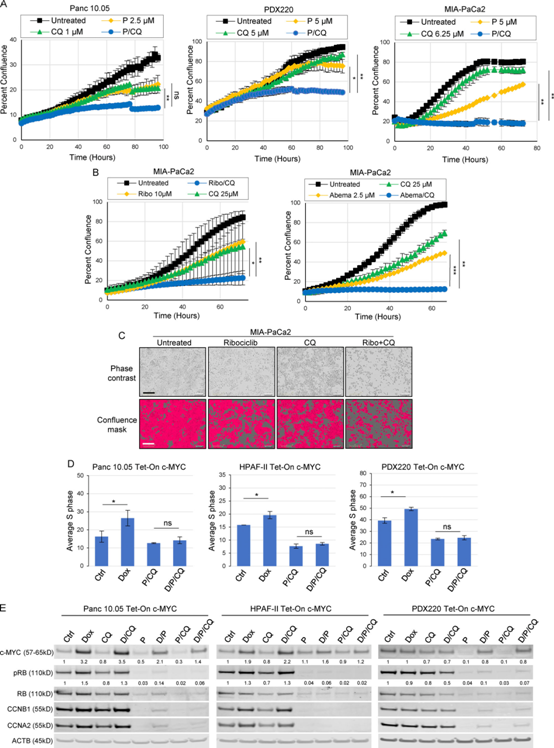
图5:c-MYC表达升高不能阻止P/CQ介导的细胞周期阻滞
(6) 帕博西尼加CQ可以阻止c-MYC介导的细胞周期进程
鉴于c-MYC能够克服曲美替尼或T/CQ诱导的增殖阻滞,我们测试了c-MYC表达升高的细胞是否对CDK4/6抑制敏感。与对照相比,palbociclib和P/CQ诱导了显著的细胞周期阻滞(补充图未展示)。c-MYCWT或c-MYCT58A的异位表达未能克服palbociclib或P/CQ介导的细胞周期阻滞(图5D)。虽然P/CQ和T/CQ处理对细胞周期调节因子的表达产生了类似的影响,但c-MYCWT或c-MYCT58A的异位表达未能促进RB磷酸化或诱导P/CQ后细胞周期蛋白A2或B1的表达(图5E)。这些数据表明c-MYC不能克服P/CQ引起的细胞周期阻滞。
(7)帕博西尼联合CQ可诱导c-MYC异位表达的PDAC的肿瘤停滞
为了确定P/CQ治疗是否可以在有或没有c-MYC表达的情况下阻止PDAC肿瘤生长,将小鼠移植到Tet-On表达c-MYC的HPAF-II或PDX220细胞(图6A, C),并用(1)载体(对照),(2)Dox诱导c-MYC表达(Dox),(3) palbociclib (P,仅在PDX220中),(4)P/CQ,或(5)Dox+P/CQ (D/P/CQ)处理。无论c-MYC表达如何,P/CQ治疗均可阻止肿瘤生长。免疫组化分析证实,在Dox治疗的小鼠中,肿瘤生长中的c-MYC表达升高,palbociclib治疗时RB磷酸化降低(图6B, D)。这些结果表明,用P/CQ治疗异种移植PDAC肿瘤以c-MYC独立的方式抑制生长。
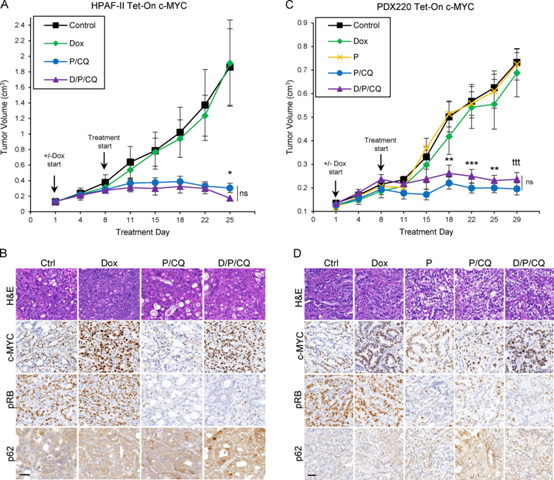
图6:P/CQ阻止表达c-MYC升高的PDAC异种移植的生长
(8) 患者1在帕博西尼+HCQ治疗后显示CA19-9肿瘤标志物减少
在T2/HCQ1200治疗177 d后,患者1在CT成像上表现出疾病进展的迹象,包括CA19-9增加和肿瘤大小(图7A)。在出现对曲美替尼耐药后,基于BRAF驱动的PDAC对ulixertinib的明显敏感性,患者1被切换到ERK1/2抑制剂(ulixertinib)+HCQ的联合治疗。然而患者无反应。肺转移分析显示,与原发肿瘤相比,染色体8p包括c-MYC的拷贝数增加。患者同意接受palbocilclib+HCQ治疗。CA19-9水平在治疗9 d后下降,并持续10 d,表明对P/HCQ有反应(图7A)。P/HCQ治疗开始3周后,CT成像显示转移性肝病灶液化性坏死(图7B)。患者出现恶性高钙血症(HHM),检测显示甲状旁腺激素相关肽(PTHrP)升高106.0 pmol/升(正常范围0-2.3 pmol/升),提示肿瘤细胞裂解(补充图未展示)。患者的HHM被成功治疗。然而患者未能茁壮成长,并停止了P/HCQ治疗,此时他的血清CA19-9水平升高,患者选择接受临终关怀。
我们从NOD/SCID小鼠肺病变活检中建立了PDX模型。免疫组化分析显示c-MYC的表达与活检肺病变相似(补充图未展示)。为了确定患者1对P/HCQ的反应是否由于任何单一药物的作用,对T/HCQ耐药肿瘤小鼠进行(1)载体,(2)CQ,(3)曲美替尼,(4)palbociclib,(5) T/CQ,或(6)P/CQ治疗。患者1的PDX肿瘤对除P/CQ外的所有治疗均耐药(图7C),进一步提示P/CQ治疗对T/HCQ耐药且c-MYC表达升高的PDAC有效。对照与药物治疗小鼠的肿瘤免疫组化分析证实(1)c-MYC表达,(2)曲美替尼治疗小鼠的pERK1/2降低,(3)曲美替尼和帕博昔利治疗小鼠的pRB降低,以及(4)CQ治疗小鼠的p62SQSTM1升高(图7D)。这些结果表明,帕博昔利联合HCQ可能有效治疗c-MYC介导的对曲美替尼和HCQ耐药的PDAC。
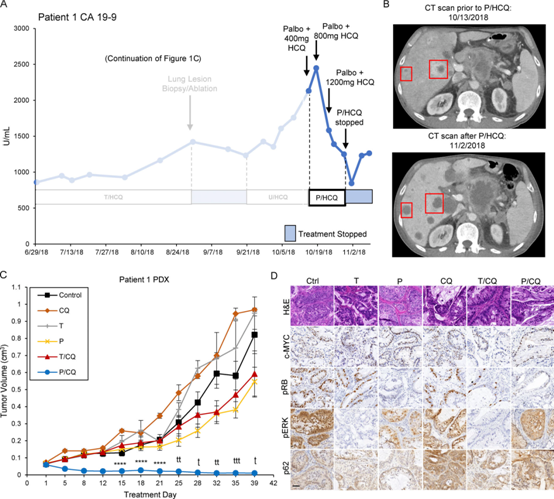
图7:患者1用P/HCQ治疗导致CA19-9和整体肿瘤负荷减少
结论:P/HCQ治疗可能是PDAC患者的另一种可能的治疗方式,值得在严格的临床试验中进一步探索。
参考文献:
Silvis, M. R., Silva, D., Rohweder, R., Schuman, S., Gudipaty, S., Truong, A., Yap, J., Affolter, K., McMahon, M., & Kinsey, C. (2023). MYC-mediated resistance to trametinib and HCQ in PDAC is overcome by CDK4/6 and lysosomal inhibition. The Journal of experimental medicine, 220(3), e20221524. https://doi.org/10.1084/jem.20221524.






