线粒体代谢酶输入缺陷引起异位代谢应激
实验方法:蛋白表达与纯化,质粒构建,免疫印迹,荧光显微法,亚细胞分离实验,体内泛素化实验,Pull-down分析,斑点试验,RNA sequencing,嘌呤霉素掺入试验,阳离子代谢产物的LC-MS/MS分析,多核糖体分析
线粒体蛋白输入缺陷与多种疾病相关。尽管非输入的线粒体蛋白具有很大的聚集风险,但它们的积聚如何导致细胞功能障碍仍不清楚。在这里,作者证明了非进口的柠檬酸合成酶被泛素连接酶SCFUcc1靶向蛋白酶体降解。出乎意料的是,作者的结构和遗传分析表明,非输入的柠檬酸合酶似乎在细胞质中形成了酶活性构象。它的过量积累引起柠檬酸盐的异位合成,进而导致糖的碳通量失衡,氨基酸和核苷酸库减少,以及生长缺陷。在这些条件下,翻译抑制被诱导,并作为一种保护机制缓解了生长缺陷。作者认为,线粒体输入失败的后果并不局限于蛋白毒性损伤,而是非输入性代谢酶的积累引发了异位代谢应激。本研究于2023年4月发表在期刊《Science Advances》(IF:14.957)上。
技术路线:
主要研究结果:
1、F-box蛋白Ucc1识别柠檬酸合成酶相对微量但精细的结构变化
为研究底物识别亚基Ucc1识别柠檬酸合成酶的机制,作者进行了X射线晶体结构分析。与常用的模拟底物蛋白的肽段不同,作者在2.30-Å分辨率下成功确定了Ucc1-Skp1与全长Cit2复合物的结构(图1A)。Skp1(残基1 ~ 84和97 ~ 112)的N端区域的电子密度在该复合物中不可见(图1A)。Cit2-Ucc1-Skp1复合物结构包含1个Ucc1-Skp1复合物和1个Cit2二聚体(图1A)。该四元复合物具有弯曲的结构,其中Skp1和Cit2位于Ucc1的两端。此外,Ucc1持有两个Cit2分子中的一个(图1A)。
在相互作用面上,Cit2中的H14和H20螺旋分别与Ucc1中的H9和H10螺旋相关联,Cit2中的H6-H7 loop与Ucc1中的S10链相关联(图1B)。位于这些表面的残基中,Cit2中的D154和E309分别与Ucc1中的K345和R184形成盐桥,而Cit2中的E309和S409/S410分别与Ucc1中的Y185和E212形成氢键(图1B)。含有D154A、E309A或S409A/S410A突变的Cit2突变体与Ucc1的结合减少(图1C)。类似地,含有R184A/Y185A、E212A或K345A突变的Ucc1突变体与Cit2的结合减少(图1D)。
Ucc1-Skp1-Cit2四元复合物中Cit2的结构与图1E中Cit2的开放形式[Apo-Cit2(A)]几乎完全一致。该形式不含其底物草酰乙酸(OAA)和乙酰辅酶A。作者还测定了Cit2与OAA和CoA形成复合物的闭合形式的晶体结构。这里用CoA代替乙酰CoA,以防止结晶过程中的反应。作者发现,在OAA和CoA存在下,Cit2发生了配体诱导的构象变化,包括E309的移动,导致Cit2中的E309与Ucc1中的Y185之间的氢键以及Cit2中的E309与Ucc1中的R184之间的盐桥被破坏(图S2A)。也许更关键的是,这种构象变化还涉及Cit2中螺旋14的大量移动,导致空间位阻,很可能阻止了Ucc1(图S2 , A ~ C)的识别。Ucc1优先识别开放(无配体)形式的酶,而不识别闭合(有配体结合)形式的酶(图S2D)。这些结果表明,与其他研究较多的F-box蛋白,如Fbw7、Cdc4、β-TrCP1和Skp2,发生的典型的degron介导的底物识别不同,Ucc1识别催化过程中底物结合引起的相对细微但精细的结构变化。这是由于极性界面通过氢键和盐桥相互补充的结果。此外,这些结果为之前提出的较高量的糖异生代谢物(如乙酰辅酶A和齐墩果酸)稳定Cit2进一步激活乙醛酸循环的正反馈环路提供了结构基础。
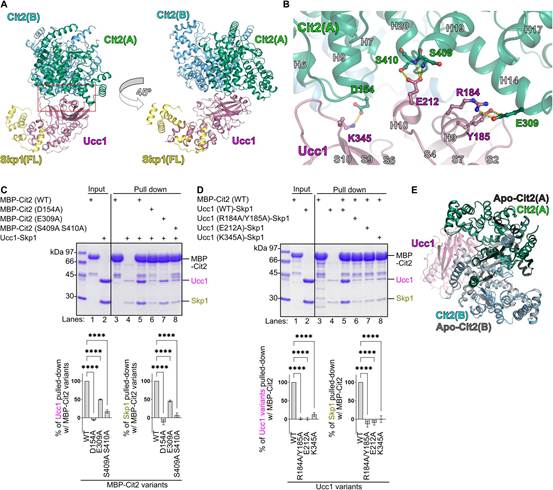
图1 Ucc1-Skp1复合物识别柠檬酸合酶的结构基础
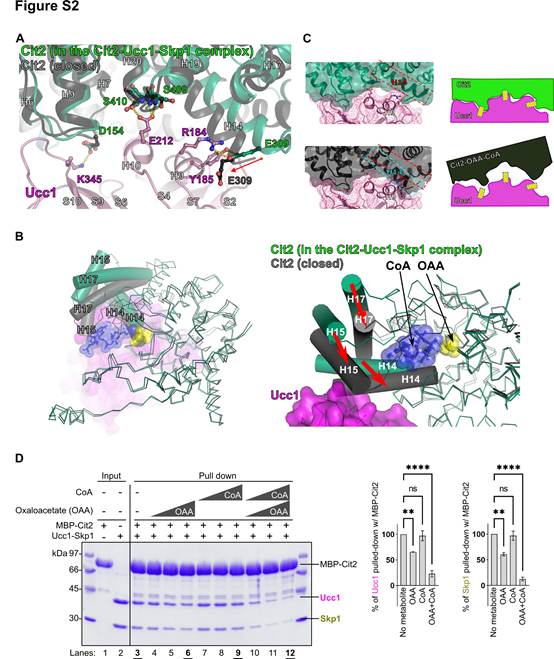
图S2 配体诱导的Cit2构象变化阻止了它识别Ucc1
2、非进口线粒体柠檬酸合成酶是被SCFUcc1泛素连接酶复合物蛋白酶体降解的靶标
作者解析Apo-Cit1的晶体结构,与Apo-Cit2的晶体结构基本一致(图2A)。因此,作者推断胞质中未导入的Cit1也可以通过SCFUcc1靶向蛋白酶体降解。为验证假设,作者首先构建一个缺少第2至第42位氨基酸的Cit1突变体,该区域含有N端线粒体靶向序列(以下作者称该突变体为NDCit1)(图2B-C)。绿色荧光蛋白(GFP)标记的NDCit1定位在细胞质中(图2D)。亚细胞定位分析进一步证实了NDCit1的细胞质定位(图2D)。为评估NDCit1的稳定性,作者进行放线菌酮追逐实验,发现NDCit1被降解,半衰期约为45 min,但加入蛋白酶体抑制剂MG132后,NDCit1被稳定(图2E)。作者还发现,在温度敏感的cdc34-2、cdc53-1和skp1-11突变细胞以及Ucc1缺失的细胞中,NDCit1降解减弱(图2F-G)。此外,NDCit1在体内以Ucc1依赖的方式被泛素化,而不是线粒体形式的成熟Cit1(mtCit1)(图2H)。这些结果表明NDCit1被SCFUcc1泛素化降解。
接下来,作者利用pull-down实验分析Ucc1与NDCit1之间的物理相互作用。将装载有重组3x FLAG-Ucc1-Skp1复合物的抗FLAG亲和凝胶与表达血凝素(HA)标记的Cit1或NDCit1细胞制备的酵母裂解液中孵育。如图2I所示,NDCit1与3xFLAG-Ucc1-Skp1复合物结合(泳道3)。用纯化的重组麦芽糖结合蛋白(MBP)标记的Cit1和Ucc1-Skp1复合物的pull-down实验证实了直接结合(图2J ,泳道9)。此外,纯化的MBP-Cit2与Ucc1-Skp1复合物的直接结合在同一实验中得到证实(泳道10)。作者注意到,当使用含有Cit1的全细胞裂解液进行基于裂解液的pull-down实验时,Cit1的成熟线粒体形式(mtCit1)被3xFLAG-Ucc1-Skp1复合物拉下(图2I ,泳道1 ,中间面板较快迁移带)。这一发现很可能是由于去垢剂诱导mtCit1从线粒体基质中溶解到裂解液中,并随后与Ucc1结合。值得注意的是,尽管它在全细胞裂解液中几乎检测不到,但与含有导肽的Cit1前体形式(preCit1)相对应的较慢迁移带也被3xFLAGUcc1-Skp1复合物拉下富集。这一结果提出preCit1也可以被SCFUcc1复合体识别降解的有趣可能性。
尽管Skp1-Ucc1-Cit1复合物的晶体结构目前尚不清楚,但作者发现Cit2中预测对Ucc1结合至关重要的氨基酸残基在Cit1中是保守的(图3A)。当NDCit1的D173和S429分别与Cit2的D154和S410同时突变为丙氨酸时,突变体(以下简称NDCit1-DS/AA)不再被Ucc1识别并泛素化。与这些结果一致,放线菌酮追赶实验证明NDCit1-DS/AA在野生型(WT)细胞中的稳定性与NDCit1在ucc1D细胞(5 ~ 8车道)中的稳定性相同(图3D , 17 ~ 20车道)。这些结果表明,前序列缺失的非输入型Cit1(NDCit1)被SCFUcc1复合体识别并泛素化降解。此外,作者的研究结果还表明Ucc1似乎可以识别折叠的柠檬酸合酶,因为对Ucc1结合至关重要的氨基酸残基在三维结构中组装在同一表面上,尽管它们位于初级序列的较远位置(图2)。

图2 NDCit1被蛋白酶体以依赖于SCFUcc1泛素连接酶的方式降解
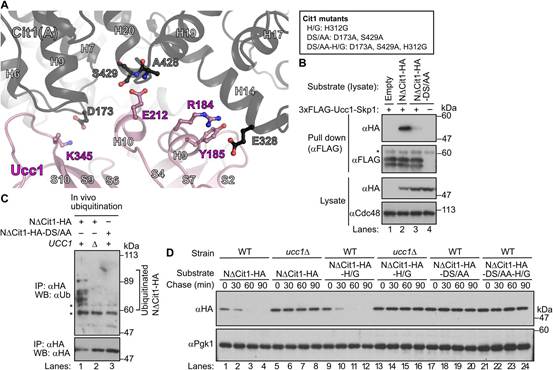
图3 Ucc1通过其保守的氨基酸识别折叠的柠檬酸合酶
3、NΔCit1毒性取决于酶的活性
为检验SCFUcc1介导的非输入性Cit1降解的生理意义,作者分析NDCit1在细胞质中积累的细胞的生长情况。细胞过表达NDCit1在GAL1启动子控制下的生长速度略慢于携带空质粒的对照细胞(图4A)。当UCC1被删除时,NDCit1的表达加剧或DS/AA突变引入NDCit1(图4A-B),表明毒性是剂量依赖性的。相比之下,过表达WT Cit1的细胞无论是否存在Ucc1或DS/AA突变(图4A),其生长速度均与对照细胞相当,表明NDCit1和Cit2作为胞质中的酶没有实质性差异。
由于作者的结构分析表明Ucc1只识别折叠的柠檬酸合成酶,作者假设NDCit1在细胞质中形成酶活性构象。作者通过直接测量细胞的柠檬酸证实NDCit1的柠檬酸合成酶活性(图4C, line3)。此外,表达NDCit1的ucc1D细胞或表达NDCit1-DS/AA的WT细胞比WT细胞或表达NDCit1的细胞积累了更多的柠檬酸(图4C)。相比之下,当对柠檬酸合成酶活性至关重要的组氨酸312突变为甘氨酸时,NDCit1和NDCit1-DS/AA的柠檬酸合成酶活性几乎被消除(图4C)。此外,H/G突变消除了NDCit1或NDCit1-DS/AA积累导致的生长缺陷表型(图4B),表明NDCit1毒性来源于酶活性。值得注意的是,H/G突变并不影响NDCit1和NDCit1-DS/AA变体的半衰期(图3D),表明较低的柠檬酸水平和生长缺陷表型的消除并不是由于蛋白水平的降低。作者还注意到NDCit1及其变体在细胞内是可溶性的,没有形成不溶性的聚集体(图4D)。总之,这些结果表明异位积累的柠檬酸合成酶的细胞毒性取决于其酶活性(图4E)。
有趣的是,与表达NDCit1的细胞相比,表达Cit1的细胞表现出更低的柠檬酸水平,其中大部分Cit1被导入到线粒体中成为成熟形式(mtCit1)(图4C,比较品系2 ~ 3和品系6 ~ 7)。这很可能是因为mtCit1在线粒体中产生的柠檬酸可能被TCA循环中的酶迅速消耗,而NDCit1产生的柠檬酸可能被消耗的程度较小。作者注意到,在酿酒酵母中没有发现三磷酸腺苷柠檬酸裂解酶,它将柠檬酸裂解为乙酰辅酶A和齐墩果酸。也有可能调节mtCit1活性的线粒体组分的可用性可能被限制在胞质中。
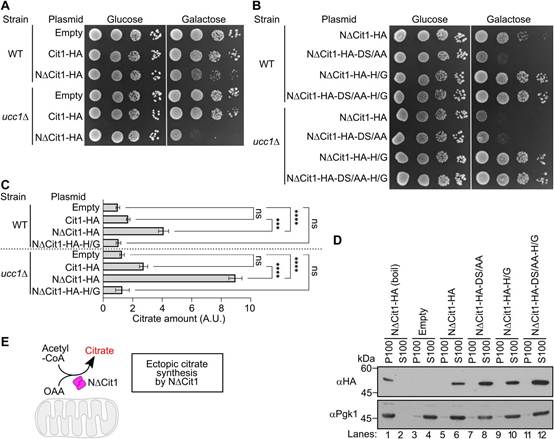
图4 积聚在细胞质中NDCit1以酶活性依赖的方式对细胞有毒
4、preCit1的毒性取决于酶的活性
到目前为止,作者的研究是基于一个缺乏线粒体靶向序列的突变体(图5A,左),这个元素将保留在由线粒体输入失败引起的真正错定位的蛋白质中。为研究含序列Cit1的稳定性,作者使用一个tom40-97温度敏感突变体(图5A,右)。当Cit1在tom40-97细胞中过表达时,preCit1会积累(图5B,lane1),并随着时间的推移而降解(lane 1-4)由于对该菌株进行遗传操作的未知难度,作者发现preCit1-ds/AA是稳定的(图5B,lane 5-12),这表明preCit1的降解取决于Ucc1。作者注意到在Tom40-97细胞中积累的Hsp60的前体形式在追赶期保持不变(图5B)。这一观察强调前体蛋白质量控制的特异性。
接下来,作者使用这种交替系统研究积累preCit1是否也具有毒性,毒性取决于酶活性。当Cit1在GAL1启动子的调控下过表达时,tom40-97细胞在允许温度26℃和限制温度35℃的条件下几乎和含有空质粒的对照细胞一样生长(图5C,第6、7行)。然而,在35℃条件下,表达Cit1-DS/AA的tom40-97细胞逃避Ucc1介导的降解,生长速度比空质粒的细胞慢(图5C第6、8行)。在半允许温度30℃的液体培养基中生长时也观察到类似的趋势(图5D-E)。通过引入消除活性(图5C,5E)的H/G突变,消除了表达Cit1-DS/AA的tom40-97酵母的生长缺陷表型。与这些结果一致,表达Cit1-DS/AA的tom40-97细胞中柠檬酸盐的水平高于表达Cit1或Cit1-DS/AA-H/G的tom40-97细胞(图5F)。这一数据表明,从纯内源位点表达的preCit1在导入失败时积累在细胞质中时可以表现出酶活性。
由于Ucc1识别折叠的柠檬酸合成酶(图1-3),非导入的preCit1被Ucc1识别并靶向降解的事实表明preCit1很可能折叠成类似于NDCit1的三维构象,在胞质中具有催化活性,尽管需要进一步的分析来充分证明preCit1在体内胞质中是否形成二聚体。preCit1-DS/AA可溶的观察结果支持了这一观点(图5G)。此外,酶活性柠檬酸合成酶在胞质中的积累比在线粒体中的毒性更大(图4)。基于这些结果,作者提出表达Cit1-DS/AA的tom40-97细胞的生长缺陷(图5C-E)可归因于非导入的preCit1在胞内合成柠檬酸盐。
当这些细胞在只含有必需氨基酸的合成“最小”培养基中生长时,表达WT Cit1的细胞比表达Cit1-ds/AA的细胞表现出更低的适应度(图5M),这表明适度的preCit1积累可以根据环境增加或降低细胞适应度。这些结果进一步支持了作者的观点,即在导入失败时积聚在细胞质中的preCit1表现出酶活性并影响细胞活性。
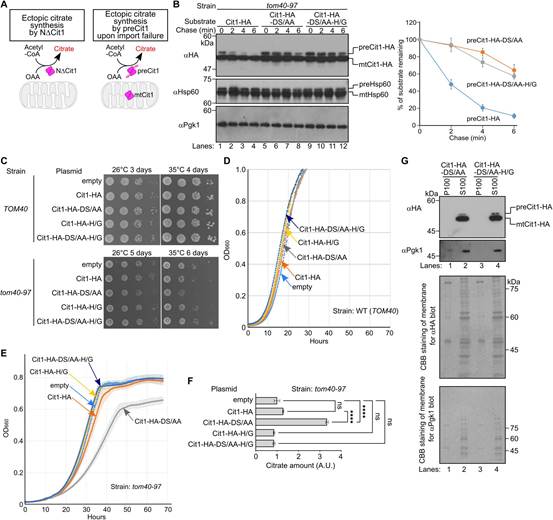
图5 preCit1的积累以酶活性依赖的方式对细胞有毒
5、异位柠檬酸盐合成引发代谢失衡
作者的数据表明,非输入Cit1的异位柠檬酸盐合成代表一种代谢扰动形式,可能模仿线粒体输入失败的后果。为全面评估胞质柠檬酸盐合成对代谢的影响,作者比较表达NDCit1-DS/AA和NDCit1-DS/AA-h/G的WT细胞(图6A)和表达Cit1的tom40-97细胞的代谢组学特征DS/AA和Cit1-DS/AA-h/G(图6A)。为此,分别采用液相色谱-质谱法(LCMS)和离子色谱-质谱法(IC-MS)对阳离子代谢物和阴离子代谢物进行了全面定量。作者从图4C和5F中发现,在这两种情况下,柠檬酸盐的积累都很明显,导致各种代谢物的波动(图6B)。累积的柠檬酸池的大小明显大于TCA循环中其他有机酸的大小(图6C)。由于柠檬酸来源于碳水化合物代谢,作者在给药后24小时评估13C流入柠檬酸池。作者发现大量糖源性13C被纳入柠檬酸池(图6D)。基于这些结果,作者得出结论,碳水化合物的通量主要指向柠檬酸盐池。碳水化合物池的重新连接可能会影响糖衍生的其他代谢物的产生,因为胞质柠檬酸盐的合成扰乱了正常的碳通量,通过这种碳通量,己糖被氧化并最终在线粒体中转化为二氧化碳。途径分析表明,除TCA和GL外,许多氨基酸和核苷酸代谢途径受到影响。有趣的是,在积累NDCit1的WT细胞和积累preCit1的tom40-97细胞中,观察到天冬氨酸显著减少,谷氨酰胺和谷氨酸显著增加(图6F)。由于这些氨基酸用于核苷酸的从头合成,因此预测观察到的氨基酸失衡会影响核酸代谢,核苷酸和脱氧核苷酸水平确实会下降(图6G)。异位柠檬酸合成可能导致不同种类代谢物的减少和增加,破坏全球代谢平衡。
尽管如此,胞内柠檬酸的保留似乎会减弱糖基天冬氨酸的产生,而天冬氨酸缺乏可能会损害核苷酸的产生。相比之下,谷氨酸和谷氨酰胺的水平升高,支持了这一解释。因此,胞质柠檬酸盐合成可能通过碳通量从糖转移而导致氨基酸失衡和嘌呤/嘧啶核苷酸减少(图6H)。
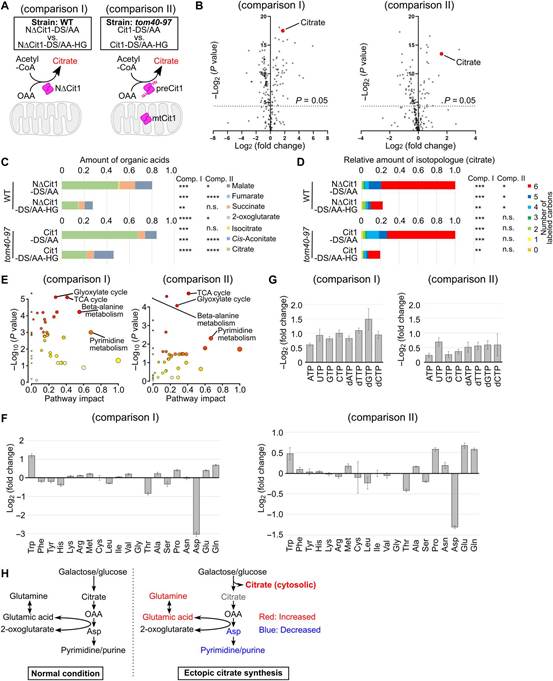
图6 异位柠檬酸盐合成引发代谢失衡
为广泛地研究细胞对异位柠檬酸合成的反应,作者对表达NDCit1-DS/AA或NDCit1-DS/AA-H/G的细胞进行了转录组分析,发现胞质中柠檬酸的合成改变超过2600个编码基因的转录本水平。编码翻译、核糖体生物合成、核糖体RNA加工和核糖体组装的mRNA显著下调(图7A)。因此,作者进行嘌呤霉素掺入实验来直接评估翻译效率。嘌呤霉素是一种链终止剂,嵌入生长的新生多肽链中,可以使用抗嘌呤霉素抗体进行WB检测。表达NDCit1-DS/AA(图7B,lane 2)的细胞嘌呤霉素掺入效率低于表达NDCit1-DS/AA-H/G的细胞(lane 4)。用放线菌酮预处理细胞阻断嘌呤霉素掺入(lane 1,3),证实新合成蛋白的检测。这一结果表明胞质柠檬酸的合成降低了翻译效率。为证实这一发现,作者还进行多聚体分离实验,其中检测到单聚体和多聚核糖体的相对含量。作者发现在表达NDCit1-DS/AA的细胞中,相对单体多聚体比例高于表达NDCit1-DS/AA-H/G的细胞(图7C)。
最后,作者检测翻译抑制是否在缓解细胞功能障碍中发挥保护作用。为此,作者删除了产物具有部分重叠功能的DOT6和TOD6基因,以抑制雷帕霉素靶蛋白复合体1和环磷酸腺苷依赖的蛋白激酶通路下游的核糖体生物合成基因的表达。如图7D所示,如前所述,NDCit1-DS/AA的过表达减缓了WT细胞以及dot6D细胞和tod6D细胞的生长(图4B)。当DOT6和TOD6同时缺失(dot6Dtod6D)时,生长缺陷被夸大。相反,当表达H/G突变的NDCit1-DS/AA时,即使在dot6Dtod6D细胞中,细胞生长也不受影响。当在液体培养基中分析生长表型时,观察到类似的趋势(图7E)。这些结果表明翻译抑制对异位柠檬酸盐合成有保护作用。线粒体输入失败不仅会引起蛋白质毒性损伤,还会引发异位代谢应激(图7F)。
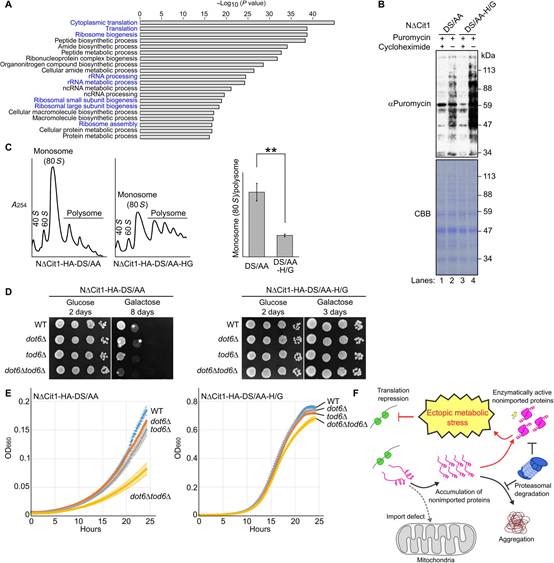
图7 翻译抑制保护细胞在异位柠檬酸应激
参考文献
Nishio K, Kawarasaki T, Sugiura Y, Matsumoto S, Konoshima A, Takano Y, Hayashi M, Okumura F, Kamura T, Mizushima T, Nakatsukasa K. (2023) Defective import of mitochondrial metabolic enzyme elicits ectopic metabolic stress. Sci Adv.;9(15):eadf1956. doi: 10.1126/sciadv.adf1956.






