脂肪来源干细胞外泌体中的miR-125b-5p缓解脓毒症肺损伤中肺微血管内皮细胞铁死亡
实验方法:外泌体分离,PMEVCs分离,transwell,划痕试验,管形成试验,ROS和抗氧化活性的检测,small RNA测序,双荧光素酶报告基因实验,动物实验,WB,ELISA,肺损伤测量,HE,免疫荧光,流式。
脓毒症是一种发病率和死亡率高的致命疾病,急性肺损伤是其最早和最严重的并发症。过度炎症引起的肺微血管内皮细胞(PMVECs)损伤在脓毒症急性肺损伤中起重要作用。本研究旨在探讨脂肪来源干细胞(ADSCs)外泌体对过度炎症性PMVECs损伤的保护作用及其机制。我们成功分离出ADSCs外泌体,并证实了其特征。ADSCs外泌体减少了PMVECs中过度炎症反应诱导的ROS积累和细胞损伤。此外,ADSCs外泌体抑制过度炎症反应诱导的铁死亡,上调GPX4在PMVECs中的表达。进一步的GPX4抑制实验表明,ADSCs外泌体通过上调GPX4来缓解炎症反应引起的铁死亡。同时,ADSCs外泌体可增加Nrf2的表达和核易位,降低Keap1的表达。miRNA分析和进一步的抑制实验证实,ADSCs外泌体特异性递送miR-125b-5p可抑制Keap1,缓解铁死亡。在CLP诱导的脓毒症模型中,ADSCs外泌体可减轻肺组织损伤,降低死亡率。此外,ADSCs外泌体可减轻肺组织氧化应激损伤和铁死亡,显著提高Nrf2和GPX4的表达。综上所述,我们揭示了一种新的潜在治疗机制,即ADSCs外泌体中的miR-125b-5p可以通过调节Keap1/Nrf2/GPX4表达,缓解脓毒症急性肺损伤中炎症诱导的PMVECs铁死亡,从而改善脓毒症急性肺损伤。
技术路线

结果
1)ADSCs和外泌体的特征
从脂肪组织分离的原代ADSCs倒置显微镜下呈纺锤形(图1A)。如图1B所示,特异性间充质干细胞表面标志物CD29、CD44、CD73和CD90在原代ADSCs中呈阳性表达。这些结果证实了ADSCs的特征。然后提取外泌体,用TEM、western blot和NTA进行鉴定。透射电镜下分离得到的囊泡呈杯状典型外泌体形态,具有双层膜结构(图1C)。Western blot结果显示,外泌体分子标志物CD63、CD9和TSG101在分离颗粒中高表达(图1D)。NTA结果显示,颗粒直径为50 ~ 150 nm,平均为117.5 nm(图1E)。CD31免疫荧光结果显示,从肺毛细血管分离的细胞被CD31阳性染色,说明我们成功分离了PMVECs(图1F)。如图1G所示,PKH26标记的外泌体可被PMVECs吸收。这些结果都表明我们成功分离了ADSCs外泌体和PMVECs。
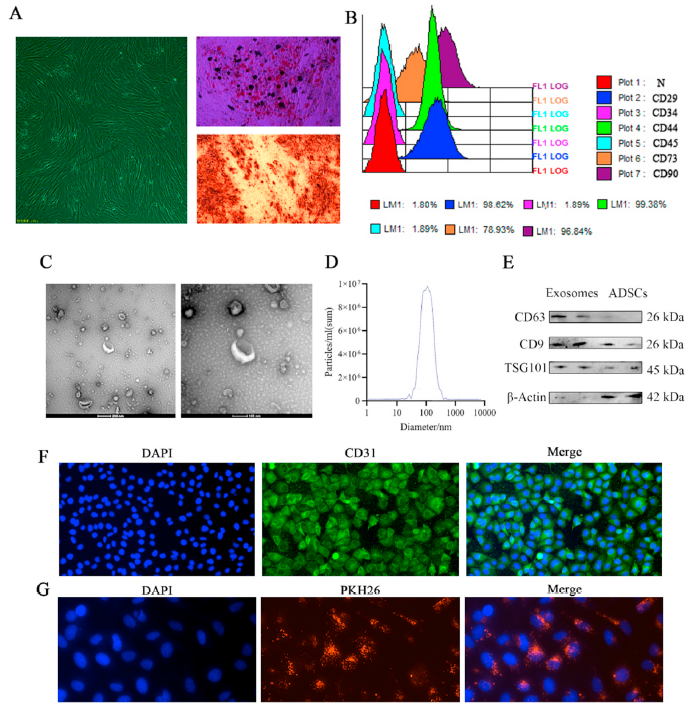
图1
2)ADSCs外泌体改善了炎症反应引起的PMVECs损伤
从新生小鼠肺组织中成功分离出原发性PMVECs。将LPS诱导RAW264.7细胞的条件培养基(CM)加入PMVECs细胞诱导损伤。同时,在PMVECs中加入ADSCs外泌体以保护其免受巨噬细胞CM诱导的损伤(图2A)。CCK8结果显示,LPS诱导的巨噬细胞CM处理PMVECs的细胞活力减弱(图2B)。流式细胞术结果显示,LPS诱导的巨噬细胞CM处理PMVECs的细胞凋亡率显著高于未处理的PMVECs(图2C)。然而,当用ADSCs外泌体处理PMVECs时,PMVECs的活力恢复(图2B),凋亡率减少(图2D)。Caspase3免疫荧光结果也验证了巨噬细胞CM对PMVECs凋亡的上调作用和ADSCs的下调作用。如图2D所示,用LPS诱导的巨噬细胞CM处理PMVECs时,Ki67的荧光强度降低,而使用ADSCs外泌体时,Ki67的荧光强度升高。在成管实验中,巨噬细胞CM组的成管数量低于对照组和ADSCs外泌体组(图2D)。transwell实验和划痕实验均显示,巨噬细胞CM削弱了PMVECs的迁移能力,而ADSCs外泌体可以恢复PMVECs的迁移能力(图2E,2F)。因此,上述结果表明,LPS诱导的巨噬细胞CM损伤了PMVECs的活力、增殖和迁移,而ADSCs改善了巨噬细胞CM诱导的损伤,减少了细胞凋亡。
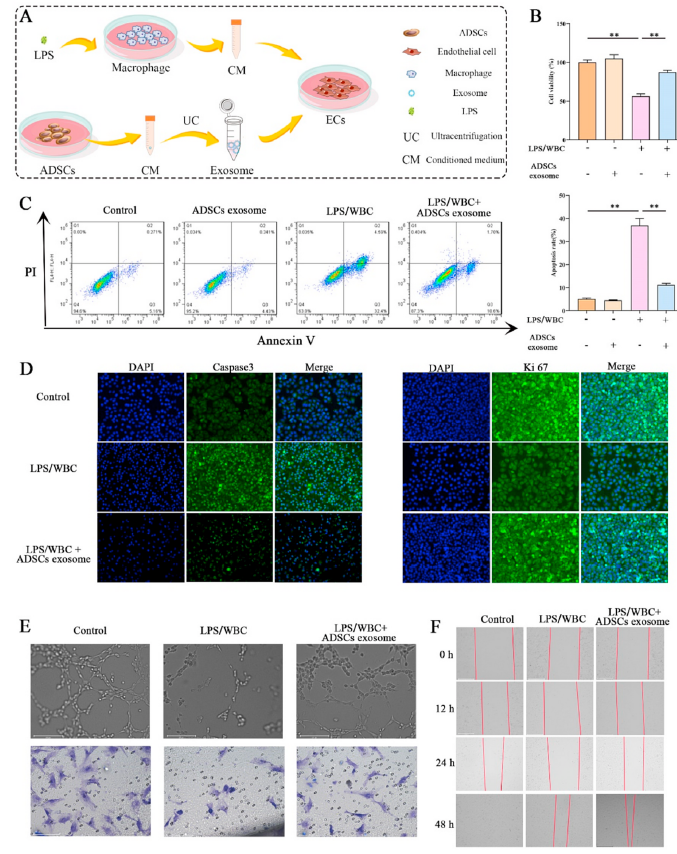
图2
3)ADSCs外泌体减少了PMVECs中炎症反应诱导的ROS积累
为了揭示ADSCs外泌体对巨噬细胞CM刺激的PMVECs的保护作用,我们检测了不同处理PMVECs的ROS积累、DNA损伤和抗氧化活性。流式细胞术和免疫荧光结果显示,当PMVECs暴露于LPS诱导的巨噬细胞CM时,ROS的积累显著增加,而ADSCs外泌体则减缓了ROS的积累(图3A和3B)。8-OHdG作为DNA损伤的指标,免疫荧光结果显示LPS诱导的巨噬细胞CM可增加PMVECs中8-OHdG的表达,而ADSCs外泌体抵消了巨噬细胞CM的上调作用。在LPS诱导的巨噬细胞CM作用下,PMVECs中SOD含量和CAT活性降低(图3D)。如图3D所示,ADSCs外泌体可增加PMVECs中SOD含量和CAT活性。线粒体膜电位(MMP)是线粒体功能状态的关键指标,也是细胞凋亡的指标之一,可以通过膜电位敏感染料JC-1进行检测。如图3E所示,在对照组和ADSCs外泌体组中,大部分线粒体呈红色荧光,而LPS诱导的巨噬细胞CM中荧光以绿色为主。即对照组和ADSCs外泌体组MMP均高于CM组。总之,暴露于LPS诱导的巨噬细胞CM导致PMVECs中ROS积累和氧化损伤,但ADSCs外泌体减少了PMVECs中炎症反应诱导的ROS积累和损伤。

图3
4)ADSCs外泌体减少PMVECs炎症反应诱导的铁死亡
为验证ADSCs外泌体对PMVECs炎症反应诱导损伤的调节作用机制,进一步检测铁死亡相关指标。通过4-羟基壬烯醛(4HNE)修饰和丙二醛(MDA)检测脂质过氧化水平。如图4A和4B所示,LPS诱导的巨噬细胞CM显著增加了PMVECs的脂质过氧化表达,而ADSCs外泌体则降低了其表达。此外,LPS诱导巨噬细胞CM下调了GSH和FRAP的表达,增加了MDA的表达。但ADSCs外泌体可缓解CM诱导的GSH、FRAP下调和MDA升高(图4C)。进一步的免疫荧光结果显示,LPS诱导的巨噬细胞CM增强了4HNE的荧光强度,削弱了GPX4的荧光强度(图4D)。ADSCs外泌体可以逆转LPS诱导的巨噬细胞CM引发的变化(图4D)。western blot结果证实LPS诱导的巨噬细胞CM和ADSCs外泌体对4HNE和GPX4表达具有相同的调节作用(图4E)。western blot结果显示,CM处理的PMVECs 中HO-1和Nrf2表达略有升高,而ADCSs外泌体组HO-1和Nrf2表达显著升高(图4E)。综上所述,LPS诱导的巨噬细胞CM可增加PMVECs 中ROS积累和铁死亡水平,而ADSCs外泌体可使其恢复。
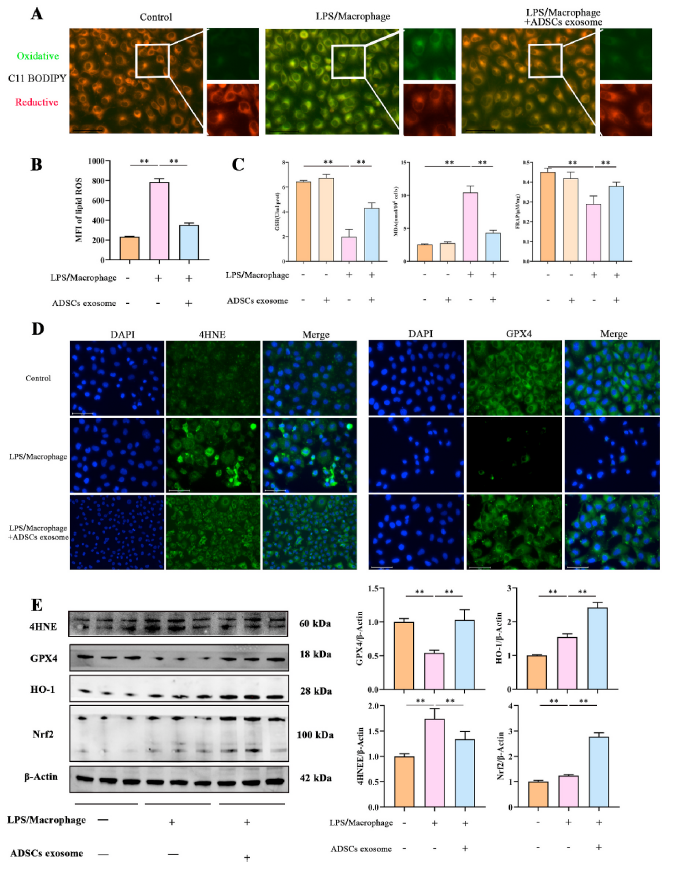
图4
5)ADSCs外泌体通过上调GPX4缓解PMVECs炎症反应诱导的铁死亡
上述结果表明,ADSCs外泌体可以抑制铁死亡,并增加GPX4。通过GPX4抑制实验进一步验证ADSCs外泌体是否通过调节GPX4对PMVECs的铁死亡有抑制作用。如图5A所示,当RSL3抑制GPX4的表达时,即使用ADSCs外泌体处理PMVECs,细胞活力和FRAP含量也会急剧下降。相反,当RSL3抑制GPX4的表达时,脂质过氧化水平及其产物显著升高。western blot结果显示,RSL3处理PMVECs后,4HNE和HO-1表达显著增加,GPX4表达明显抑制。当GPX4表达被RSL3抑制时,ADSCs外泌体对炎症反应诱导的铁死亡的保护作用被取消(图5B)。也就是说,ADSCs外泌体通过上调GPX4在PMVECs中缓解炎症反应诱导的铁死亡。

图5
6)ADSCs外泌体调节PMVECs中Nrf2通路的表达
Nrf2和Keap1信号通路是通过调控下游基因HO-1、GXP4、NQO1等降低氧化应激的最关键、最经典的细胞防御和生存通路之一。因此,我们检测了Nrf2通路中重要成分的表达。如图4E所示,western blot结果显示,暴露于LPS诱导的巨噬细胞CM时Nrf2表达略有升高,而ADSCs外泌体处理时Nrf2表达显著升高。此外,ADSCs外泌体可以增加下游抗氧化基因HO-1和GXP4的表达(图4E)。western blot和PCR结果也显示ADSCs外泌体可上调Nrf2的表达,下调Nrf2的负调控因子Keap1的表达(图6A和6B)。western blot检测细胞质和细胞核中的Nrf2蛋白,结果显示ADSCs外泌体可轻微增加细胞质Nrf2的表达,而显著增加细胞核Nrf2的表达(图6C)。综上所述,ADSCs外泌体可通过调节Keap1/Nrf2/GPX4轴缓解LPS诱导的巨噬细胞CM诱导的ROS积累、氧化损伤和铁死亡。
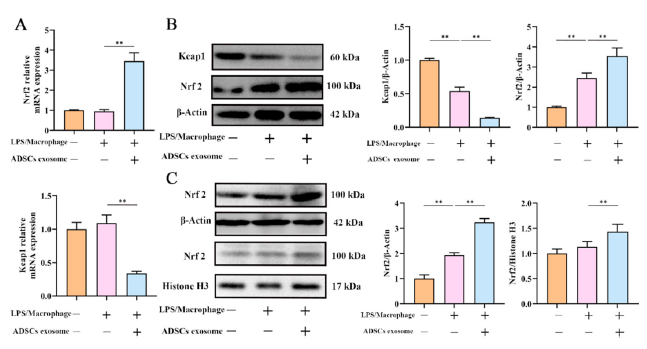
图6
7)ADSCs外泌体通过miR-125b-5p的传递调控PMVECs中的Nrf2通路
为了绘制ADSCs外泌体的miRNA表达谱,进行了微阵列分析。如图7A所示,多达63个miRNAs在ADSCs外泌体中被检测到。最丰富的前15个miRNAs为miR-24-3p、miR-23a-3p、miR-12136、miR-19b- 3p、let-7b-5p、let-7a-5p、let-7i-5p、miR-126-5p、miR-145-5p、miR-214- 3p、miR-221-3p、miR-125b-5p、miR-17-5p、miR-19a-3p、miR-3662和miR-423-5p。为了预测检测到的miRNA的潜在靶基因,我们探索了miRDB、miRtarbase、starBase和TargetScan数据库,并进一步研究了预测靶基因。值得注意的是,Keap1是miR-125b-5p的预测潜在靶点。然后,qRT-PCR结果证实miR-125b-5p在ADSCs外泌体中表达(图7B),并且在ADSCs外泌体处理PMVECs后,miR-125b-5p的表达大幅增加(图7C)。随后,通过双荧光素酶报告基因分析验证miR-125b-5p对Keap1的调控作用。如图7D所示,miR-125b-5p的过表达降低了Keap1-3'UTR-wt报告基因的活性。即Keap1是miR-125b-5p的调控靶点,miR-125b-5p可以与Keap1基因的3'UTR结合。为了进一步验证miR-125b-5p对Keap1的调控作用,我们设计合成了miR-125b-5p的模拟物和抑制剂,并将其转染到PMVECs中。如图7E所示,mimic显著促进miR-125b-5p的表达,而inhibitor则保持不变。mimic上调miR-125b-5p表达后,Keap1表达被抑制,Nrf2和GPX4表达上调。同样,抑制剂增加了Keap1的表达,而降低了Nrf2和GPX4的表达(图7F)。此外,我们用抑制剂转染ADSCs外泌体,将其加入PMVECs中,并与ADSCs外泌体比较其对Keap1通路的调控作用。结果表明,当miR-125b-5p在ADSCs外泌体中被抑制剂抑制表达时(图7G), Keap1的下调和Nrf2、GPX4的上调均得到缓解(图7H)。即当miR-125b-5p在ADSCs外泌体中被抑制表达时,ADSCs外泌体对Keap1/Nrf2/GPX4轴的调控作用被抵消。总之,ADSCs外泌体对Keap1/Nrf2/GPX4轴的调节作用取决于miR-125b-5p的传递。
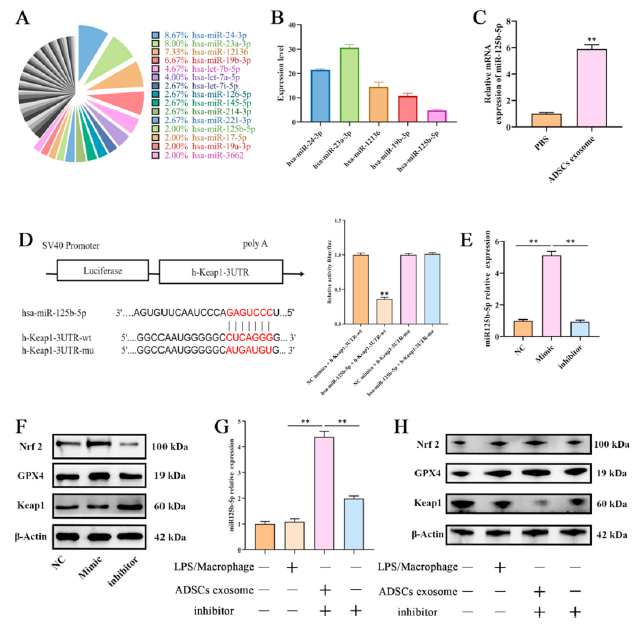
图7
8)ADSCs外泌体缓解CLP诱导的小鼠急性肺损伤
为了检测ADSCs外泌体对脓毒症急性肺损伤的保护作用,如图8A所示,我们建立了CLP脓毒症模型,并用ADSCs外泌体进行治疗。结果显示,CLP组小鼠24小时死亡一半,48小时死亡80%(图8B)。当使用ADSCs外泌体治疗时,24小时死亡率下降到10%,48小时死亡率下降到60%(图8B)。收集肺组织进行HE染色,并通过肺损伤评分、支气管肺泡灌洗液(BALF)和湿/干比分析进行损伤评分。CLP组小鼠BALF中蛋白浓度及干湿比均显著高于假手术组及ADSCs外泌体组(图8C)。HE结果显示,与假手术组相比,CLP组肺泡毛细血管肿胀充血,肺泡腔出血,并伴有炎症细胞浸润(图D)。而ADSCs外泌体明显改善上述损伤。此外,CLP增加了小鼠肺损伤评分,而ADSCs外泌体降低了肺损伤评分(图8E)。因此,ADSCs外泌体缓解了CLP诱导的小鼠急性肺损伤。
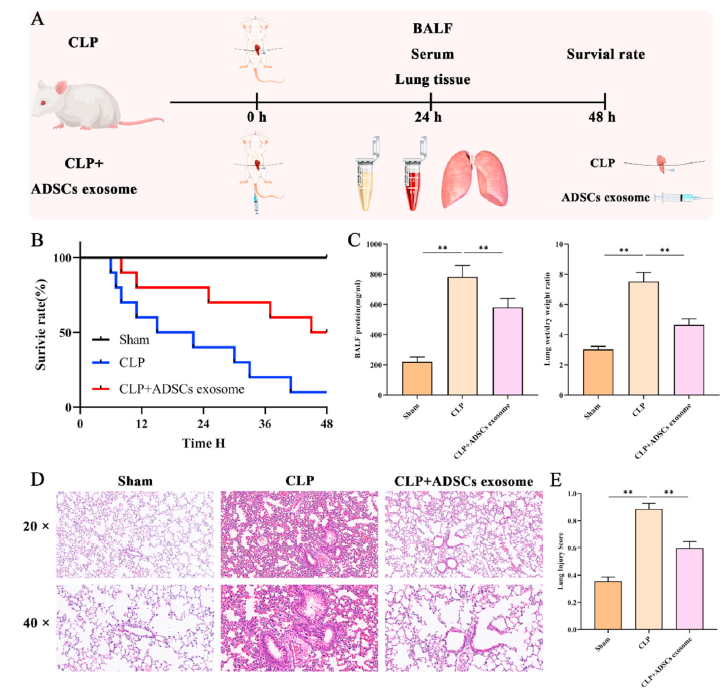
图8
9)ADSCs外泌体缓解CLP诱导的ROS并增强小鼠的抗氧化能力
为了检测CLP诱导的炎症反应和ADSCs外泌体对肺血管内皮细胞氧化应激和损伤的影响,检测了ROS、SOD、FRAP、MDA和GSH。如图9A所示,结果显示CLP处理后ROS水平明显升高,而ADSCs外泌体可以减少ROS的积累。MDA检测显示,脓毒症小鼠BALF中MDA水平远高于假手术组和ADSCs外泌体组(图9A)。同时,CLP处理后抗氧化剂SOD、FRAP和GSH水平显著降低,ADSCs外泌体可恢复其含量。Tunel染色显示CLP增加小鼠肺组织凋亡,而ADSCs外泌体减轻脓毒症大鼠肺组织凋亡(图9B)。OHdG和CD31免疫荧光双染色显示CLP组CD31阳性细胞8OHdG表达明显升高,而ADSCs外泌体组较CLP组表达降低(图9C)。
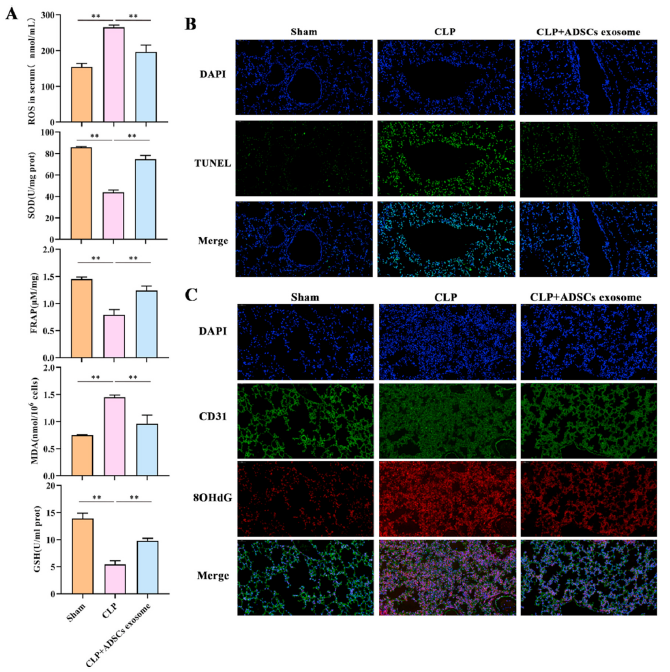
图9
10)ADSCs外泌体通过上调肺组织GPX4缓解CLP诱导的铁死亡
为验证ADSCs外泌体对CLP诱导的急性肺损伤中铁死亡和GPX4表达的调节作用,采用western blot、PCR和免疫荧光染色检测4HNE和GPX4的表达。如图10A所示,western blot结果显示CLP处理后肺组织中4HNE蛋白表达显著增加,而ADSCs外泌体处理后4HNE蛋白表达显著降低。相反,加入CLP后GPX4表达下调,加入ADSCs外泌体后GPX4表达上调。有趣的是,CLP和ADSCs外泌体均能增加HO-1的表达,而ADSCs外泌体比CLP更能增加HO-1的表达(图10A)。4HNE、GPX4和HO-1的免疫组化染色结果也显示CLP处理增加了肺组织中4HNE和HO-1阳性细胞,减少了GPX4阳性细胞(图10B)。ADSCs外泌体减少了4HNE阳性细胞数量,增加了GPX4和HO-1阳性细胞数量(图10B)。PCR结果与western blot和免疫组化结果一致(图10C)。此外,4HNE和GPX4免疫荧光染色结果也显示CLP在肺组织中增加了4HNE表达,减少了GPX4表达,而ADSCs外泌体增加GPX4表达,降低4HNE表达(图10D)。因此,ADSCs外泌体通过上调肺组织中的GPX4来缓解CLP诱导的铁死亡。
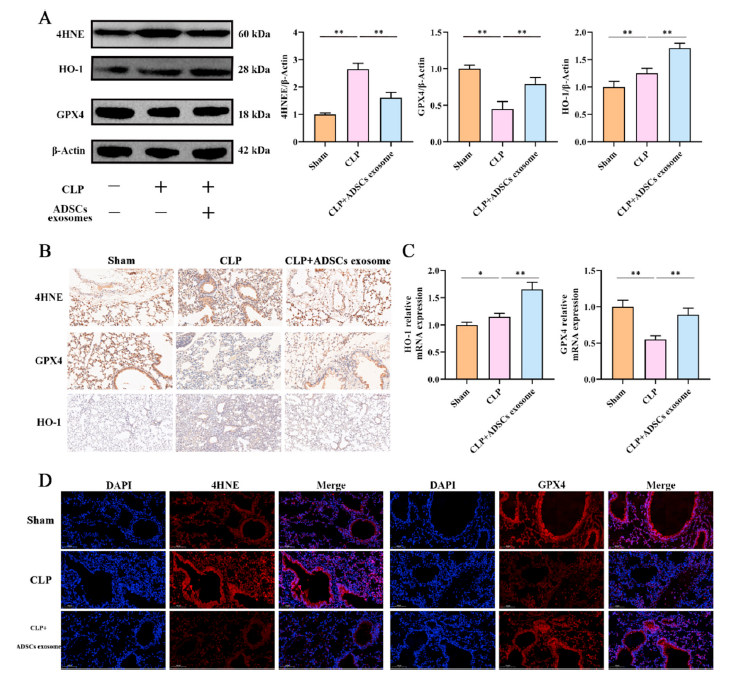
图10
11)ADSCs外泌体在CLP诱导的急性肺损伤中调控Keap1/Nrf2的表达
Keap1/Nrf2系统通过调控GPX4、HO-1等一系列抗氧化基因,是氧化应激系统的关键元件。如图11A所示,在CLP诱导的脓毒症肺组织中Nrf2蛋白表达略有升高,在ADSCs外泌体处理的小鼠中Nrf2蛋白表达明显升高。然而,Keap1在CLP诱导的脓毒症肺组织中表达略有降低,在ADSCs外泌体处理的小鼠中表达显著降低(图11A)。PCR结果也显示ADSCs外泌体处理的脓毒症小鼠肺组织中Nrf2 mRNA表达升高(图11A)。Nrf2和CD31免疫荧光双染色结果显示Nrf2在CD31+细胞中的平均荧光强度高于CD31−细胞,在ADSCs外泌体小鼠肺组织中的荧光强度高于CLP组(图11B)。此外,Nrf2免疫组化染色结果也表明,该抗氧化分子在CLP小鼠肺组织中略有上调,而在ADSCs外泌体作用下则显著上调(图11B),因此,ADSCs外泌体调节了CLP诱导的急性肺损伤中Keap1/Nrf2的表达。
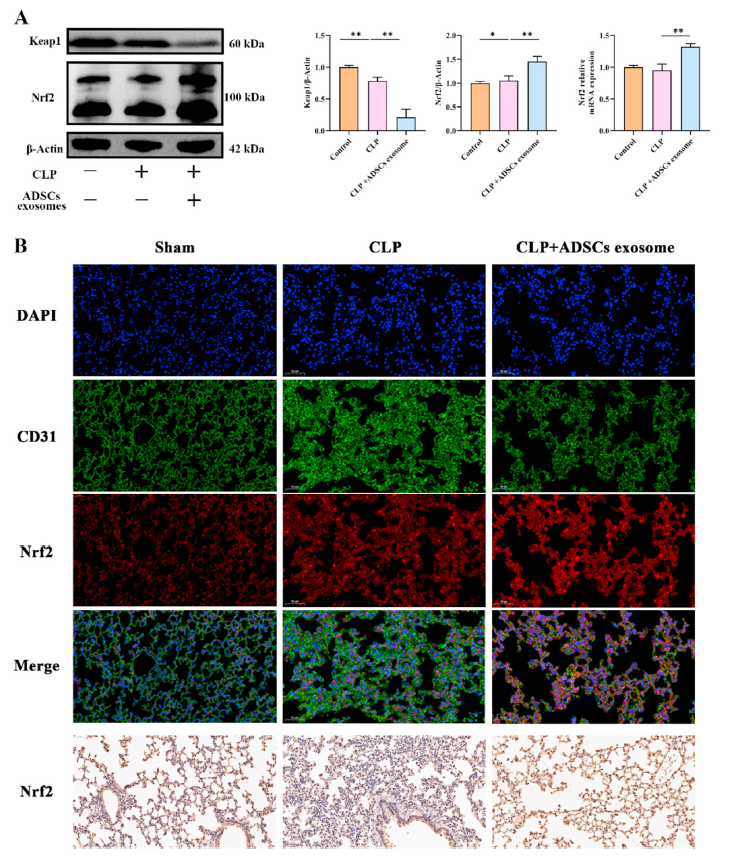
图11
结论:我们揭示了一种新的潜在治疗机制,即ADSCs外泌体传递miR-125b-5p可通过调节Keap1/Nrf2/GPX4表达,缓解脓毒症急性肺损伤所致的PMVECs铁死亡,从而改善脓毒症急性肺损伤。
参考文献:Shen K, Wang X, Wang Y, Jia Y, Zhang Y, Wang K, Luo L, Cai W, Li J, Li S, Du Y, Zhang L, Zhang H, Chen Y, Xu C, Zhang J, Wang R, Yang X, Wang Y, Hu D. miR-125b-5p in adipose derived stem cells exosome alleviates pulmonary microvascular endothelial cells ferroptosis via Keap1/Nrf2/GPX4 in sepsis lung injury. Redox Biol. 2023 Mar 9;62:102655. doi: 10.1016/j.redox.2023.102655.






