BHLHE22驱动前列腺癌免疫抑制性骨肿瘤微环境及相关骨转移
实验方法:免疫组织化学(IHC),免疫荧光(IF),流式细胞术,生物信息学分析,RNA测序,细胞因子阵列,蛋白质印迹,荧光素酶报告基因,染色质免疫沉淀测定,DNA pulldown、免疫共沉淀,动物实验

骨是晚期前列腺癌(Pca)最常见的远处转移部位。在骨肿瘤微环境(TME)中,独特的骨髓微环境和髓系细胞参与了骨肿瘤的转移、定植、休眠、激活和免疫逃逸。在过去的几十年中,晚期Pca的诊断率从3.9%增加到8.2% ,高达90%的晚期Pca患者发生骨转移。晚期PCa的治疗措施有限,包括雄激素剥夺治疗、生物靶向治疗和骨靶向药物治疗,且PCa最终会发生骨转移进展,成为一种致死性疾病。免疫检查点治疗(ICT)已被证明对多种实体肿瘤有效。然而,骨转移性PCa传统上被认为是“免疫沙漠”,导致ICT应答不佳。BHLHE22是碱性螺旋-环-螺旋(bHLH)转录因子超家族的成员,其峰值表达与晚期PCa细胞的转化进展相关。然而肿瘤BHLHE22在Pca骨转移中的作用尚不清楚。
技术路线:

主要研究结果:
1. BHLHE22在前列腺癌骨转移组织中表达上调,在转移骨组织中进一步升高
通过免疫组织化学染色检测BHLHE22在222例PCa组织中的表达,探讨其在PCa转移中的潜在作用。作者发现,与无骨转移的原发性PCa(PCa/nBM)相比,BHLHE22在有骨转移的原发性PCa(PCa/BM)中的表达显著增加,并且在BM组织中进一步上调(图1A)。然后,作者分析了人类PCa表达谱GSE77930,发现与原发性PCa和其他内脏转移部位相比,BHLHE22在转移性骨组织中的表达显著上调(图1B)。基于癌症基因组图谱(TCGA-PRAD)数据集的进一步分析表明,与PCa/nBM相比,BHLHE22在PCa/BM中的表达显著增加(图1C)。此外,基于TCGA-PRAD的Kaplan-Meier分析表明,BHLHE22高表达预测较短的无病生存期(图1D)。一致地,BHLHE22表达上调预示着较差的临床病理特征和较短的总生存期和无BM生存期(图1E, F)。总之,这些结果表明,BHLHE22的高表达与PCa患者的BM和不良预后相关。
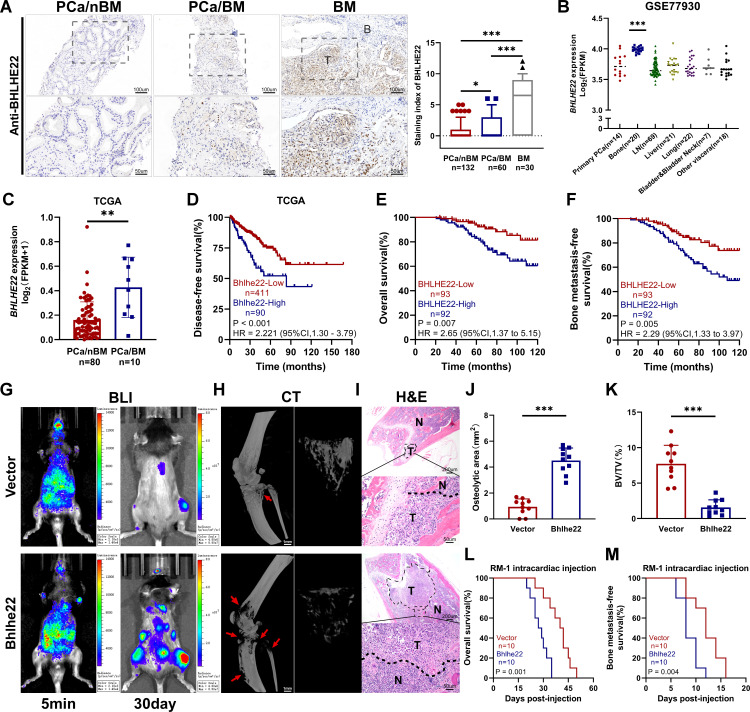
图1 BHLHE22在前列腺癌骨转移中表达上调,并促进骨转移
2. BHLHE22通过免疫相关的方式促进BM
为了探讨BHLHE22在前列腺癌中的生物学功能,作者通过左心室注射荧光素酶标记的前列腺癌细胞构建了BM小鼠模型。采用生物发光成像活体监测骨转移。RM-1细胞BHLHE 22过表达显著促进同基因C57BL/6J小鼠的肿瘤BM(图1G)。然后,通过HE证实了BM,并通过micro-CT扫描对溶骨性病变进行定量(图1H)。Micro-CT分析表明,BHLHE22导致了更大的溶骨性骨病区(图1J, K)。生存分析表明,BHLHE22的过表达预测了更短的总生存期和无BM生存期(图1L, M)。综上所述,在免疫正常和免疫缺陷小鼠之间,BHLHE22驱动不同的骨髓表型。在体内和体外实验中,BHLHE22引起了一致的表型差异。因此,作者假设BHLHE22对骨髓状态的不同影响可能是由于其对肿瘤骨免疫微环境的影响所致。
3. BHLHE22驱动骨髓中的免疫抑制性TME
为了确定BHLHE22是否以及如何影响PCa骨免疫微环境,作者研究了PCa标本中免疫抑制髓系细胞和CD8 T细胞的浸润。免疫抑制髓系细胞定义为人组织样本中的CD33细胞20免疫抑制性中性粒细胞和单核细胞被定义为CD11bGr1细胞,可进一步分为CD11bLy6CloLy6G(中性粒细胞)和CD11bLy6ChiLy6G-(单核细胞)对PCa/BM和BM组织进行CD33、CD8、BHLHE22的组织免疫荧光和4 ',6-二脒基-2-苯基吲哚染色(图2A, B),结果提示在PCa/BM和BM组织中BHLHE22-high组比BHLHE22-low组有更多的CD33细胞浸润。BHLHE22-low组的CD8 T细胞浸润高于BHLHE22-high组(图2D, E)。然后,作者在LCV注射RM-1-BHLHE22和RM-1-Vector细胞的C57BL/6J小鼠骨髓样本中检测了肿瘤浸润的CD11bGr-1细胞,以及CD4 T和CD8 T细胞。RM-1-BHLHE22组骨髓中CD11bGr-1细胞浸润较RM-1-Vector组明显增加,CD4 T和CD8 T细胞浸润较RM-1-Vector组明显减少(图2C, F)。
为了进一步证实BHLHE22在骨TME中的作用,作者收集了同时注射RM-1-Vector或RM-1-BHLHE22细胞的C57BL/6J小鼠的骨髓样本,并使用流式细胞术进行免疫分析。作者评估了CD11bGr-1细胞在CD457AAD -细胞中的相对比例。与RM-1-Vector组相比,RM-1-BHLHE22组的CD11bGr-1细胞浸润显著增加,尤其是单核细胞,而CD4 T和CD8 T细胞浸润显著减少(图2G-J)。进一步研究与免疫功能相关的关键因子,包括Arg-1、IFN-γ和PD-1。RM-1-BHLHE22组的Arg-1Gr-1细胞(图2G, H)和PD-1CD8 T细胞比例较高,而IFN-γCD8 T细胞比例较低(图2I, K)。此外,为了检测这些CD11bGr-1细胞是否确实是有功能的免疫抑制髓系细胞,作者进行了标准的T细胞共培养增殖抑制试验。将分离出的CD11bGr-1细胞以不同比例与CD8 T细胞共培养:4天后,CD11bGr-1细胞强烈抑制CD3和CD28抗体诱导的T细胞增殖和活化(图2L, M)。综上所述,作者得出结论,BHLHE22-high PCa细胞诱导的CD11bGr-1细胞通过消耗T细胞来驱动免疫抑制的TME 。
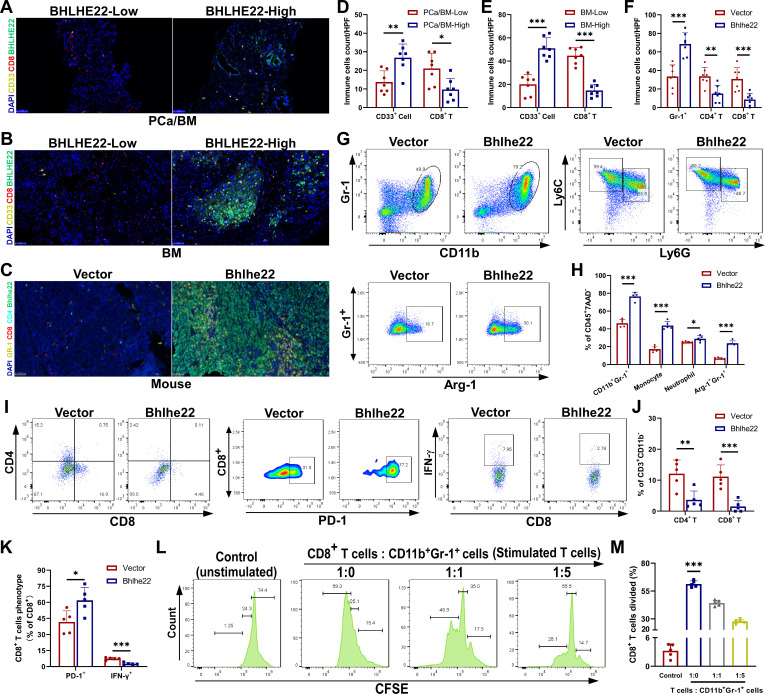
图2 BHLHE22在骨转移中驱动免疫抑制性肿瘤微环境
4. BHLHE22控制免疫抑制性中性粒细胞
作者分析了RM-1-BHLHE22和PC-3-BHLHE22细胞的RNA-seq数据集,并分别与vector细胞进行比较。作者确定了103个共上调基因和37个共下调基因。令人惊讶的是,CSF2是RM-1-BHLHE22和PC-3-BHLHE22细胞中唯一共同上调的分泌因子基因(图3A)。
细胞因子阵列分析显示RM-1-BHLHE22细胞比RM-1-Vector细胞分泌更高量的CSF2(图3B)。Western blot结果显示RM-1-BHLHE22组中CSF2的表达水平较高(图3C, D)。在LCV注射的C57BL/6J小鼠骨髓肿瘤样本中,作者检测了CSF2的表达与免疫细胞浸润的关系,包括免疫抑制性髓系细胞(Gr-1, S100A9)、CD4 T和CD8 T细胞。BHLHE22过表达组的Gr-1和S100A9细胞计数较高,CSF2水平高于载体组(图3E-H)。相关性分析显示,CSF2表达与Gr-1细胞浸润呈正相关(图3h)。Ki-67增殖标志物的阳性染色表明,BHLHE22诱导的肿瘤浸润CD11bGr-1细胞促进小鼠的骨髓生长(图3I)。因此,作者假设CSF2可能是BHLHE22 PCa诱导的免疫抑制性骨TME的关键介质。
接下来,进行了体内和体外研究,以评估CSF2中和的治疗效果。对于体内CD11bGr-1细胞浸润分析,C57BL/6J小鼠LCV注射RM-1-Vector或RM-1-BHLHE22细胞。然后,作者用重组鼠CSF2治疗非荷瘤小鼠。用抗CSF2抗体处理LCV注射小鼠。采用BLI监测脑转移,micro-CT扫描定量分析溶骨性病变。注射后30 d,取骨髓进行流式细胞术分析。与非荷瘤组相似,肿瘤BHLHE22过表达显著促进了CD11bGr-1细胞的浸润。然而,抗CSF2抗体显著抑制CD11bGr-1细胞浸润(图3J)。分离CD11bGr-1细胞,用羧基荧光素琥珀酰亚胺酯标记CD11bGr-1细胞进行体外扩增分析。将分离的CD11bGr-1细胞与RM-1-Vector或RM-1-BHLHE22细胞共培养。未共培养的CD11bGr-1细胞作为溶剂组。然后,作者用重组鼠CSF2处理非共培养的细胞。用抗CSF2抗体处理共培养细胞。孵育5天后,与CSF2组相似,CFSE实验显示肿瘤BHLHE22过表达显著促进CD11bGr-1细胞扩增。然而,抗CSF2抗体显著抑制了CD11bGr-1细胞的扩增(图3K)。因此,作者得出结论,CSF2是BHLHE22诱导免疫谱改变的关键介质。
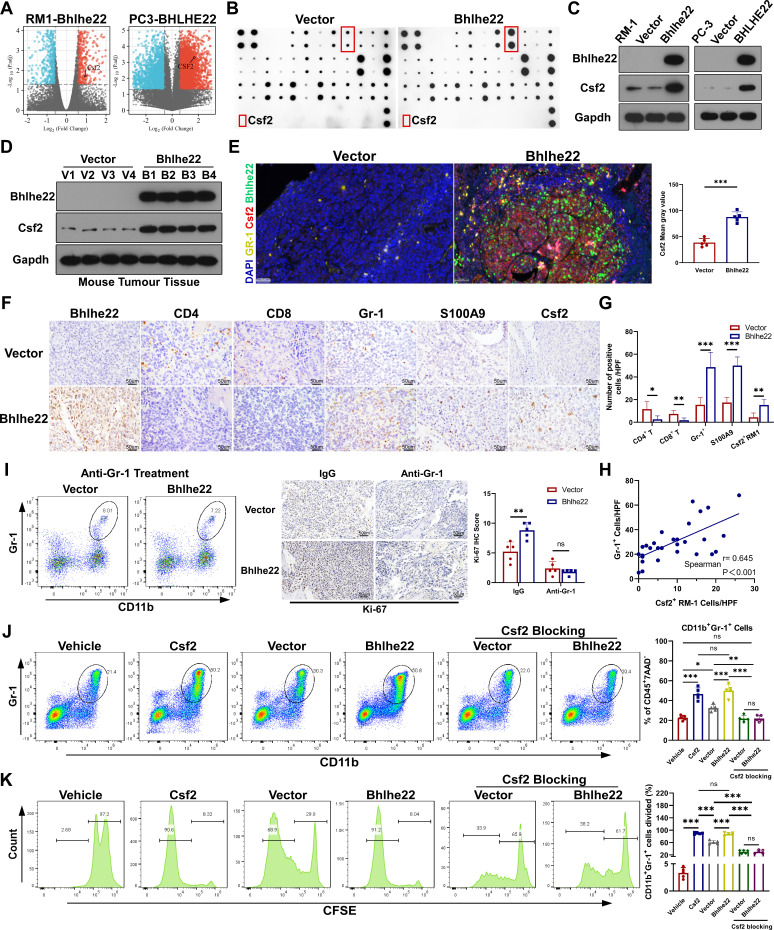
图3 BHLHE22控制免疫抑制性中性粒细胞和单核细胞的募集,CSF2作为关键介质发挥作用
5. BHLHE22和PRMT5形成一个转录复合物并转录激活CSF2
BHLHE22是一个转录因子;因此,作者试图确定CSF2是否受BHLHE22的转录调控。荧光素酶报告基因实验显示BHLHE22增加RM-1-BHLHE22和PC-3-BHLHE22细胞中CSF2启动子的活性(图4A)。BHLHE22通常形成一个转录复合物,在多种组织中决定细胞命运。为了确定潜在的蛋白-蛋白相互作用,作者进行了免疫共沉淀试验。使用质谱(MS)分析洗脱液和差异丰度条带。质谱结果确定了10个潜在转录辅因子的富集(图4B)。作者将DNA探针与磁珠偶联,并使用未偶联的磁珠作为阴性对照。DNA下拉分析显示,在CSF2启动子区域P1和P1-4中,在60和75 kDa之间发现了相同的差异表达条带,但在P2、P3和P4中没有(图4C)。因此,作者认为P1区域可能与BHLHE22结合有关。此外,细胞IF染色也显示了BHLHE22和PRMT5在细胞核中的共定位(图4D)。为了进一步验证BHLHE22是否结合到CSF2启动子的P1区域来激活基因转录,作者构建了3个CSF2荧光素酶启动子载体:pGL4-FL-BBS(全长BBS)、pGL4-P1-BBS-Wt(野生型P1区域)和pGL4-P1-BBS-Mut(突变BBS)。将其转染RM-1-BHLHE22细胞和HEK293T细胞。荧光素酶分析表明P1区域的突变显著降低了CSF2启动子活性(图4E)。为了进一步确定BHLHE22和PRMT5之间的相互作用,作者进行了内源性和外源性免疫共沉淀(IP)实验。值得注意的是,两种IP检测均显示BHLHE22与PRMT5相互作用(图4F, G)。
接下来,作者研究了转录复合体是如何与靶基因结合的,以及转录复合体中Bhlh以RM-1-vector、RM-1-BHLHE22和RM-1-BHLHE22-PRMT5-sh 3种RM-1细胞株为研究对象进行芯片定量PCR(chip-qPCR)。作者发现PRMT5在RM-1-Vector细胞中不能与CSF2启动子结合。而在RM-1-BHLHE22和RM-1-BHLHE22- PRMT5 -sh细胞中,ChIP-qPCR显示BHLHE22与CSF2启动子的结合能力相似。然而,在RM-1-BHLHE22细胞中,PRMT5显示出与CSF2启动子的强结合能力(图4H)。在BHLHE22缺失的情况下,PRMT5不能与CSF2启动子结合(图4H)。因此,PRMT5结合CSF2启动子的能力依赖于BHLHE22。这些结果表明BHLHE22与CSF2启动子结合并招募PRMT5形成一个转录复合物,从而激活CSF2的转录。
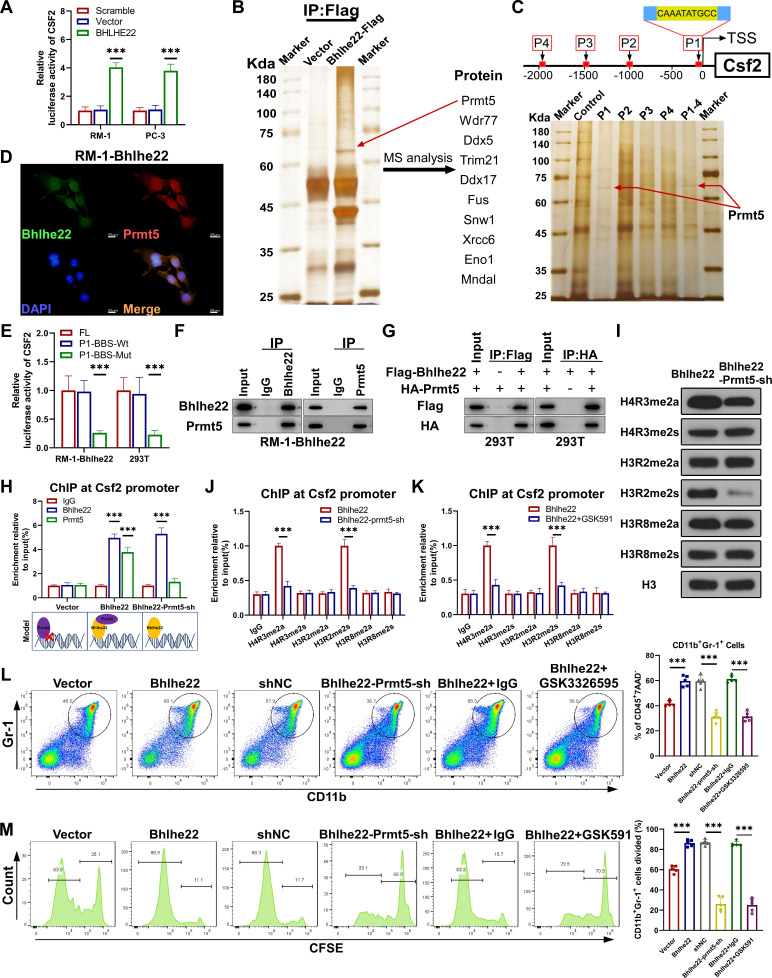
图4 BHLHE22和PRMT5形成一个转录复合物并转录激活CSF2
6. PRMT5表观遗传激活CSF2表达
据报道,PRMT5作为一种表观遗传修饰因子,通过甲基化组蛋白来调节基因表达。此外,PRMT5通过不同组蛋白的对称二甲基化在转录激活或抑制中发挥作用。在RM-1-BHLHE22细胞中敲低PRMT5后,作者通过蛋白质印迹法和实时定量反转录PCR检测CSF2的表达水平。作者还检测了各种对称甲基化组蛋白的水平,如H4R3, H3R2和H3R8。值得注意的是,PRMT5敲低诱导H4R3me2a和H3R2me2s水平降低(图4I)。既往研究表明,H4R3(H4R3me2a)和H3R2(H3R2me2s)二甲基化在肿瘤中可激活基因转录。随后,为了确定PRMT5是否可以直接甲基化CSF2启动子区域周围的H4R3和H3R2,作者在RM-1-BHLHE22细胞中进行了几次ChIP测定。敲低PRMT5降低了H4R3me2a和H3R2me2s在CSF2启动子上的富集,支持CSF2启动子是PRMT5的一个二甲基化靶点的观点(图4J)。GSK591显著降低RM-1-BHLHE22细胞中CSF2启动子上H4R3me2a和H3R2me2s的富集(图4K)。
为了评估PRMT5对免疫抑制性中性粒细胞和单核细胞浸润的影响,作者进行了体内和体外研究来评估PRMT5抑制剂的治疗效果。PRMT5抑制剂GSK3326595用于体内实验,GSK591用于体外实验。对于体内CD11bGr-1细胞浸润分析,C57BL/6J小鼠被LCV注射RM-1-Vector或RM-1-BHLHE22或RM-1-BHLHE22-PRMT5-sh细胞。另一组RM-1-BHLHE22用GSK3326595处理。采用BLI监测脑转移,micro-CT扫描定量分析溶骨性病变。注射后30 d,取小鼠骨髓进行流式细胞术分析。肿瘤BHLHE22过表达显著促进CD11bGr-1细胞的浸润。然而,敲低PRMT5和PRMT5抑制剂GSK3326595处理显著抑制了CD11bGr-1细胞的浸润(图4L)。在体外,分离的小鼠CD11bGr-1细胞被CFSE标记,并与RM-1-Vector或RM-1-BHLHE22或RM-1-BHLHE22-PRMT5-sh细胞共培养。另加入GSK591处理RM-1-BHLHE22共培养组。在孵育5天后,CFSE实验显示肿瘤BHLHE22过表达显著促进CD11bGr-1细胞的扩增。然而,敲低PRMT5和PRMT5抑制剂GSK591处理显著抑制了CD11bGr-1细胞的扩增(图4M)。综上所述,这些结果表明PRMT5表观遗传激活CSF2的表达,抑制PRMT5可以减少CD11bGr-1细胞的浸润。
7. CSF2中和和ICT联合治疗在体内有效抑制肿瘤浸润的免疫抑制性中性粒细胞和单核细胞以及骨髓
肿瘤内CD4 T细胞的扩增和细胞毒性CD8 T细胞的活化决定了ICT的治疗效果。CD11bGr-1细胞驱动的免疫抑制微环境是骨转移性PCa对ICT反应差的主要原因之一,这促使作者研究是否抑制BHLHE22/PRMT5/CSF2通路可以提高ICT反应。
首先,作者在注射RM-1-BHLHE22细胞的C57BL/6J小鼠模型中验证了作者的假设。注射后3日,作者开始用抗CSF2和/或抗PD -1抗体治疗小鼠(图5A)。使用BLI监测BM,使用micro-CT扫描和TRAP染色测量BM病灶(图5B, C)。
70 d时终止实验,测定BM发生率。在BM发生率方面,单独抗CSF2或抗PD-1抗体与对照组无显著差异。然而,在所有组中,抗CSF2和抗PD-1联合治疗抑制BM的发生最有效(图5D)。尽管如此,与快速进展的对照组相比,单独使用抗CSF2或抗PD-1抗体治疗可减缓肿瘤进展,并缩小BM病变面积;在所有治疗组中,联合治疗组最有效地减缓了肿瘤进展,并减少了BM病变面积(图5E-G)。生存分析表明,联合治疗组显著延长了总生存期和无BM生存期(图5H)。
随后,作者使用流式细胞术进一步检测了骨髓中免疫抑制性中性粒细胞和单核细胞以及T细胞的浸润(图5J)。与对照组相比,单独抗CSF2可减少CD11bGr-1细胞浸润,增加CD4和CD8 T细胞浸润,但不能促进IFN-γCD8 T细胞扩增(图5K-M)。单独抗PD-1促进IFN-γCD8 T细胞的扩增,但对CD11bGr-1细胞、CD4和CD8 T细胞的浸润无明显影响(图5K-M)。值得注意的是,联合治疗显著减少了CD11bGr-1细胞的浸润,增加了CD4和CD8 T细胞的浸润,并促进了IFN-γCD8 T细胞的扩增(图5K-M)。综上所述,这些结果表明,抗CSF2和抗PD-1抗体联合应用可以通过缓解免疫抑制来有效增强ICT对BHLHE22前列腺癌的治疗效果。
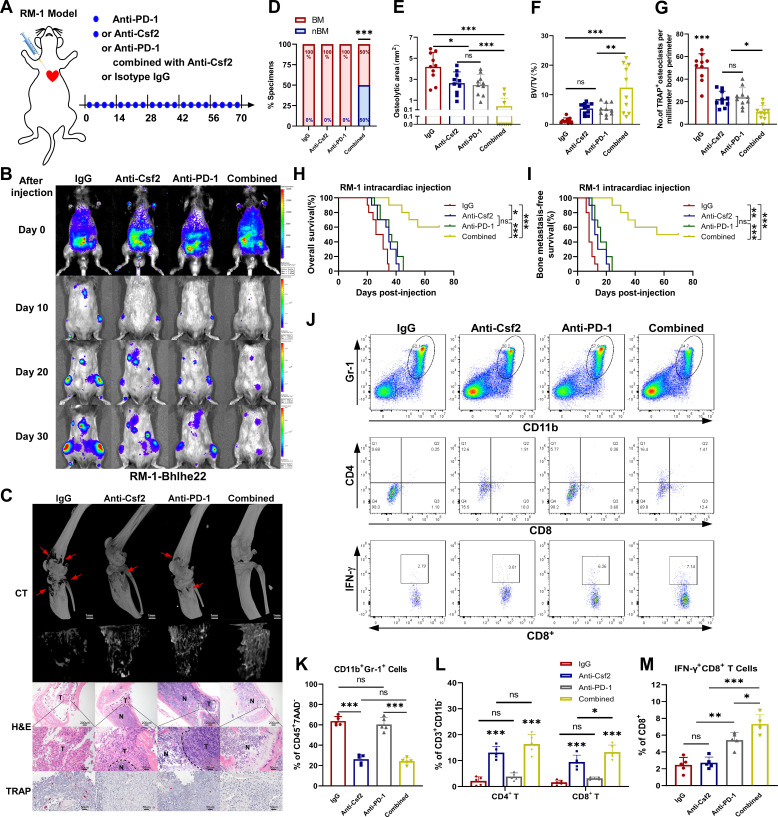
图5 CSF2中和和免疫检查点治疗联合治疗可有效抑制体内肿瘤浸润的免疫抑制性中性粒细胞和单核细胞以及骨转移
8. PRMT5抑制剂联合ICT可有效抑制体内肿瘤浸润的免疫抑制性中性粒细胞、单核细胞和骨髓
抑制PRMT5可显著降低CSF2的表达,减轻免疫抑制性骨TME。因此,作者进一步探索PRMT5抑制剂联合ICT能否提高ICT的疗效。注射后3日,作者开始用GSK3326595和/或抗PD-1抗体治疗小鼠(图6A)。通过BLI监测BM,通过micro-CT扫描和TRAP染色测量BM病灶(图6B, C)。
于70 d时终止实验。在骨髓发生率方面,单独GSK3326595治疗与对照组无显著差异。然而,GSK3326595和抗PD-1的联合治疗有效地抑制了BM的发生(图6D)。与单独抗PD-1治疗相似,单独GSK3326595治疗略微减缓了肿瘤进展,减少了BM病灶面积;联合治疗最有效地减缓了肿瘤进展,减少了BM病灶面积(图6E-G)。生存分析表明,联合治疗显著延长了总生存期和无BM生存期(图6H)。流式细胞术表明,GSK3326595处理减少了CD11bGr-1细胞的浸润,并增加了CD4和CD8 T细胞的浸润(图6J-M)。GSK3326595联合抗PD-1促进IFN-γCD8 T细胞扩增(图6J-M)。GSK3326595联合抗PD-1抗体可通过缓解免疫抑制,有效增强BHLHE22前列腺癌对ICT的应答。
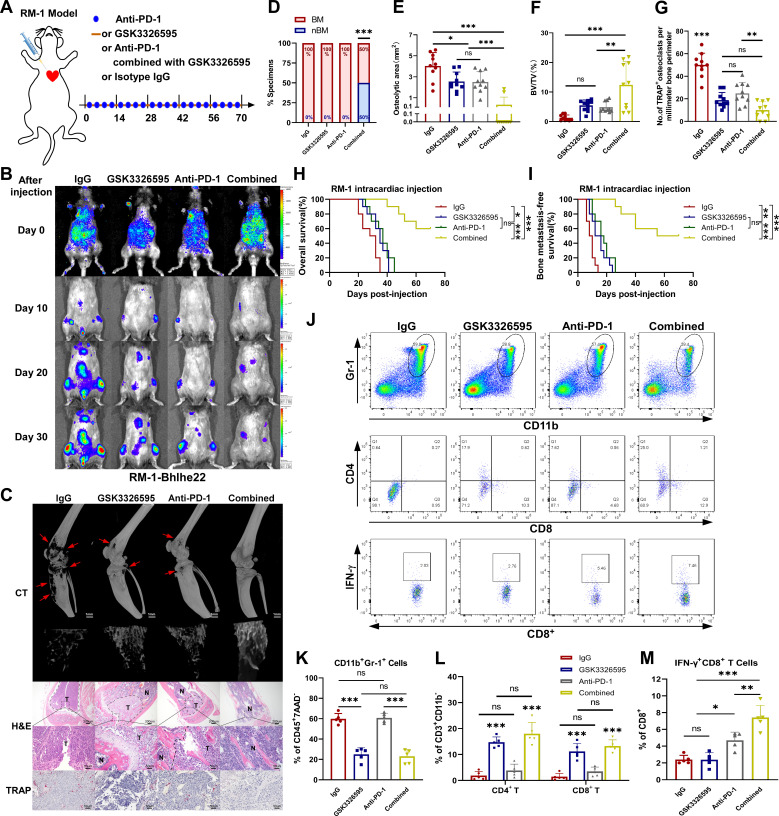
图6 蛋白精氨酸甲基转移酶5抑制剂联合免疫检查点治疗在体内可有效抑制肿瘤浸润的免疫抑制性中性粒细胞和单核细胞及骨转移
9. BHLHE22作为前列腺癌骨转移ICT联合治疗生物标志物的潜在作用
为了评估BHLHE22/PRMT5/CSF2轴与人骨转移性PCa中免疫细胞浸润的潜在相关性,作者使用IHC检测了作者BM组织中BHLHE22、PRMT5和CSF2的表达水平(图7A)。有证据表明,PRMT5在PCa中上调,并作为PCa细胞生长的癌基因33PRMT5在骨髓组织中普遍呈阳性表达。显著地,与BHLHE22-low组相比,BHLHE22-high组的CD33细胞计数较高,每个HPF(400×)的CD4 T和CD8 T细胞浸润较低,CSF2表达较高(图7B, C)。Ki-67增殖标志物的阳性染色表明BHLHE22在其独特的骨TME中促进了BM的生长(图7D)。此外,相关分析显示BHLHE22与CD4呈负相关(图7E)和CD8 T细胞浸润(图7F),与CD33细胞浸润呈正相关(图7G)和CSF2表达(图7h)。总之,作者的研究结果揭示了在PCa中由BHLHE22/PRMT5/CSF2通路驱动的具有免疫抑制作用的骨TME和相关骨髓的分子机制(图7I)。靶向PRMT5/CSF2联合抗PD-1是BHLHE22前列腺癌患者潜在的治疗方法。
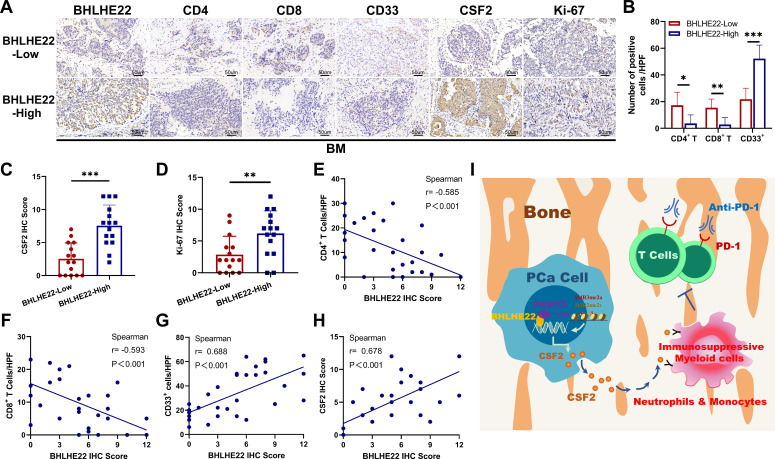
图7 BHLHE22作为免疫检查点疗法联合治疗骨转移性PCa的生物标志物的潜在作用
结论:
综上所述,作者阐明了肿瘤BHLHE22在前列腺癌骨转移中的免疫抑制机制。BHLHE22与PRMT5偶联形成转录复合物,表观遗传激活CSF2表达,CSF2是参与免疫抑制性中性粒细胞和单核细胞积累的关键抑制性细胞因子。肿瘤BHLHE22是一种很有前景的生物标志物,可用于增强抗PD-1治疗的疗效。抗CSF2 /抗PRMT5和抗PD-1的联合治疗代表了具有BHLHE22和骨转移的PCa患者的前瞻性治疗。
参考文献:
Yin C, Wang M, Wang Y, et al. BHLHE22 drives the immunosuppressive bone tumor microenvironment and associated bone metastasis in prostate cancer. J Immunother Cancer. 2023 Mar;11(3):e005532.






