单细胞转录组学揭示了 横纹肌肉瘤中的免疫抑制和与患者预后相关的细胞状态
横纹肌肉瘤(RMS)是一种起源于间充质的软组织恶性肿瘤,被认为是肌原性分化异常的结果。尽管有密集的治疗方案,高危患者的预后仍然令人沮丧。RMS的细胞分化状态及其与患者预后的关系在很大程度上仍然不清楚。在这项研究中,作者使用单细胞mRNA测序技术生成了横纹肌肉瘤的转录组图谱。对横纹肌肉瘤肿瘤微环境的分析显示其存在免疫抑制的迹象。作者还发现,在更具侵袭性的融合阳性(FP)RMS亚型中,NECTIN3和TIGIT之间可能存在相互作用,这可能是肿瘤引起T细胞功能障碍的潜在原因。在恶性横纹肌肉瘤细胞中,作者定义了反映正常肌原性分化的转录程序,并且证明这些细胞分化状态对FP RMS和更不具侵袭性的融合阴性亚型的患者预后有预测性。作者的研究揭示了针对横纹肌肉瘤免疫微环境的治疗潜力,并建议评估肿瘤分化状态可以实现更精细的风险分层。
该研究于2023年5月发表发表在《Nature communications》,IF:17.694。
技术路线:

实验方法:单细胞RNA测序、免疫组织化学和H&E染色、RNA荧光原位杂交、细胞分类、免疫微环境分析、免疫细胞类型鉴定、GSEA、配体-受体相互作用分析、Logistic回归分析、基因集富集分析、差异化轨迹建模、转录因子活性分析、生存分析。
1、横纹肌肉瘤(RMS)肿瘤的单细胞图谱
作者采用基于板的单细胞mRNA测序(SORT-seq)协议,对活体冷冻原发RMS肿瘤标本和最近建立的患者来源的肿瘤器官模型进行了操作(图1a)。选择基于板的方法可以从低活性的原始样本或样本物质有限的情况下生成高质量的单细胞转录组。从作者的27个RMS样本(包括19个原发样本和8个先前建立的肿瘤器官样模型),涵盖主要的分子和组织亚型(FP,FN,肺泡和胚胎,图1b、c),作者获得了10216个通过质量阈值的高质量单细胞转录组。
为了区分原发样本中的RMS细胞和组成肿瘤微环境的非恶性细胞类型,作者采用了两种互补的方法。首先,使用SingleR评估了每个单细胞转录组与来自健康细胞类型和横纹肌肉瘤的批量转录组的参考集之间的相似性。通过对相似性得分进行聚类,可以明确区分与批量横纹肌肉瘤具有高相似性的细胞(恶性细胞)和类似于多种免疫或基质细胞类型的细胞。其次,对每个肿瘤基础上的单细胞拷贝数变异(CNV)进行推断和聚类。在所有肿瘤中,可以区分出具有一致的全染色体和亚染色体CNV的细胞(恶性细胞)和那些看起来是拷贝中性的细胞。总体而言,单细胞来源的CNV图谱与大量肿瘤样本的全基因组测序结果高度相似。使用两种方法分类为“恶性”或“正常”的细胞被保留,而分类不一致的细胞则被排除在进一步分析之外。每个原发样本中的恶性细胞百分比的中位数为56%,尽管变化很大(2%-97%),但在分子亚型之间没有显著差异(图1f)。如预期的一致,疑似恶性细胞表达DES、MYOD1和MYOG等典型的横纹肌肉瘤标记基因(图1e)。然后,使用SingleR细胞类型相似性得分和已知标记基因的表达来确定非恶性细胞的身份(图1e)。与恶性细胞的整体百分比一样,每种非恶性细胞类型的比例在肿瘤之间变化很大,但根据融合状态没有显著差异(图1f)。
将分类的原发性单细胞转录组在均匀流形逼近与投影(UMAP)空间中进行投影显示,肿瘤间的异质性和分子亚型分类(FN或FP)驱动了恶性细胞的聚类,而非恶性细胞则按细胞类型进行聚类(图1d),这与先前对其他肿瘤实体的描述相符。基于分子亚型和肿瘤间异质性进行的聚类也观察到了肿瘤器官样细胞中的情况,支持在体外扩增后保留了亚型特异性转录组差异的存在。

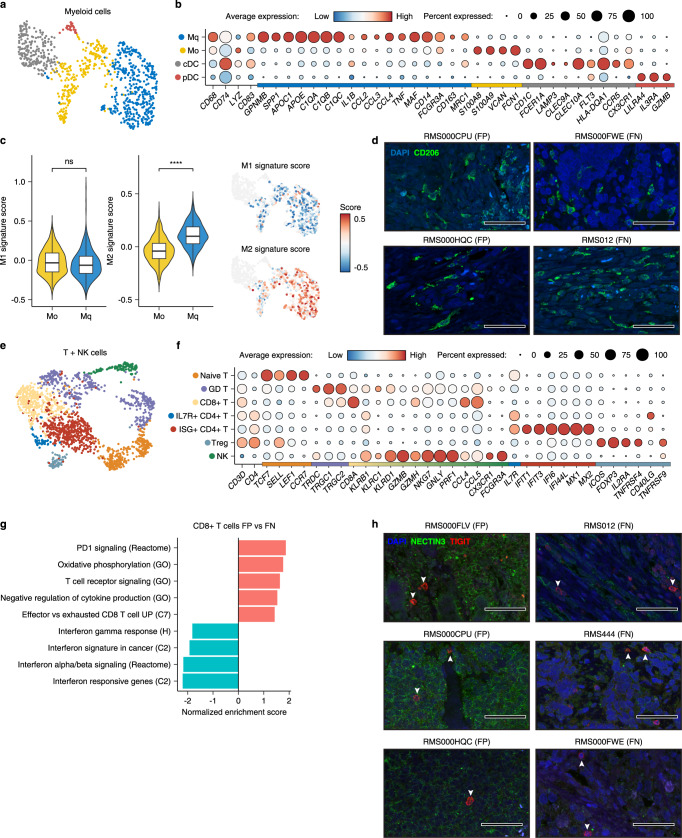
2、RMS微环境的特征揭示了一般和亚型特异性的免疫功能障碍
了探索肿瘤浸润性免疫细胞的组成和功能特征,对原始RMS样本的髓系和T/NK亚群进行了基于图的聚类(图2a、e)。对髓系聚类中标记基因的表达进行检查,发现存在未分化(M0)和分化(Mq)巨噬细胞,以及传统型(cDC)和浆细胞型(pDC)树突状细胞(图2b)。对分化巨噬细胞进行M1/M2特异性基因特征进行评分,显示它们主要处于M2极化状态(图2c),它与几种促肿瘤功能相关,包括抑制炎症和促进血管生成。原发肿瘤组织的免疫荧光(IF)显微镜显示CD206+和CD163+细胞在多个患者样本中的渗透(图2d)支持这一发现。
在T/NK细胞聚类中,可以区分出几个亚型,包括原始和gamma delta(GD)T细胞、调节性T细胞(Tregs)、细胞毒性(CD8 +)T细胞和多个亚型的CD4 + T辅助细胞(IL7R +和ISG +)(图2f)
基因集富集分析(GSEA)比较RMS亚型之间的CD8 + T细胞表明,FP样本中的功能障碍更为普遍,这些样本富集了与PD-1信号传导、氧化磷酸化和T细胞衰竭相关的基因集,而来自FN肿瘤的细胞富集了干扰素应答和刺激特征(图2g)。为了定义调节免疫功能的潜在细胞间相互作用,作者使用CellChat模拟TME内恶性细胞、每种亚型和细胞类型之间的配体-受体相互作用。
该分析强调了FP肿瘤特有的一种可能存在的相互作用,即恶性细胞表达的NECTIN3与Tregs和CD8 + T细胞上的TIGIT受体之间的相互作用。这种相互作用的特异性是由于FP肿瘤细胞中NECTIN3的显著高表达,而TIGIT在Tregs和CD8+T细胞中的表达在不同亚型之间是相似的。支持这一发现的是,原发性肿瘤组织的免疫荧光显微镜检查显示两个亚型中都存在TIGIT阳性细胞,并且FP RMS中观察到一致更普遍的NECTIN3染色模式(图2h)。综上所述,对RMS中的肿瘤微环境的分析突出了普遍的免疫功能障碍,如M2极化的巨噬细胞的普遍存在,以及FP特异性的T细胞衰竭表型,这部分可能受到NECTIN3和TIGIT之间的相互作用的调节。
3、RMS中的恶性细胞状态反映了正常肌肉发育过程的特征
虽然有人提出RMS肿瘤是由于肌肉发育出现问题而产生的,但RMS确切的发育起源仍然是一个积极研究的领域。为了将原发性RMS肿瘤细胞置于正常肌肉发育的背景下,作者训练了一系列Logistic回归模型,来预测恶性单细胞转录组与最近发表的人类胎儿和出生后肌肉发育单细胞图谱定义的主要细胞类型的相似性。这项分析显示,平均而言,FN RMS细胞类似于肌肉前体细胞和肌肉间充质细胞,而FP细胞与成肌细胞最接近。这符合FN肿瘤通常呈现出未分化的“胚胎型”组织学特征的概念,而FP则更广泛地表达了负责协调终末分化的关键肌肉调控因子MYOD1和MYOG6(图1b、c)。然而,当以单细胞分辨率进行分析时,作者发现每个亚型和肿瘤的单个细胞都覆盖了肌肉发育的各个阶段,表明在细胞分化状态中存在大规模的肿瘤内和肿瘤间异质性。
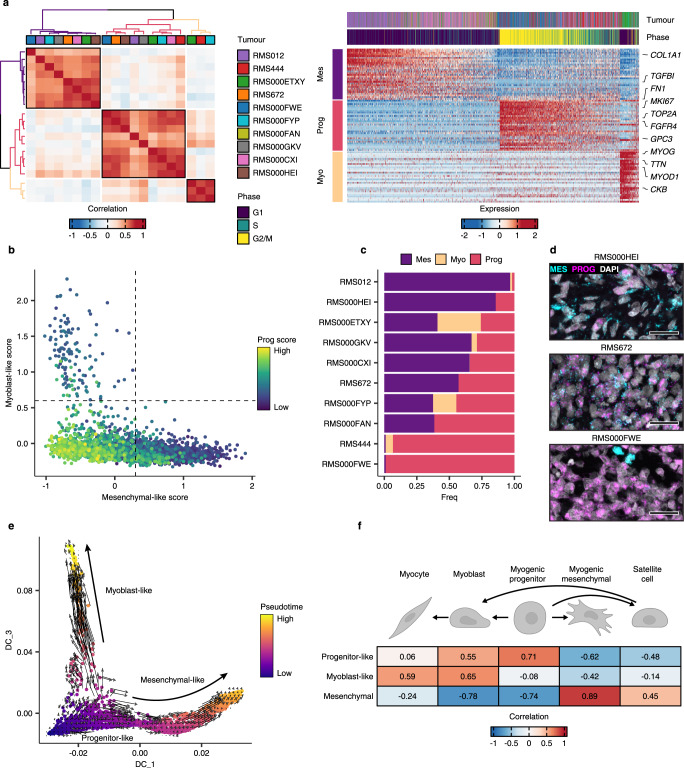
4、FN RMS中的NMF定义的分化轨迹反映了早期肌肉发育
为了探索异质性的潜在来源,在作者的RMS scRNAseq队列中,针对每个分子亚型独立地应用了非负矩阵分解(NMF)来定义恶性细胞中活跃的基础转录程序。在FN RMS样本中,这种分析揭示了三个高度相关的转录程序簇,作者将其合并为三个元程序(图3a-左侧)。值得注意的是,构成每个元程序的基础程序来自多个肿瘤样本,这表明聚类不是由肿瘤间的差异驱动的。为了解释每个元程序的生物学相关性,作者评估了其具有最高权重的基因的表达(图3a-右侧)。第一个程序被称为“类间质样”程序,富含与细胞外基质(ECM)组织相关的基因,包括FN1、TGFBI和几个编码胶原蛋白的基因等。第二个程序被称为“前体样”程序,包括在早期肌肉发育中表达的基因,例如FGFR4和GPC3,以及增殖标记物,包括MKI67和TOP2A。正如所暗示的那样,具有高表达前体样程序基因的细胞被推测具有高细胞周期活性(图3a-右侧面板)。最后,“肌母细胞样”程序由参与调控末端肌肉分化的基因组成,包括MYOD1、MYOG、MEF2C和CDH15,以及编码终端分化纹状肌的结构和功能组分的基因,例如TTN和CKM。对FN细胞进行每个元程序的评分显示,肌母细胞样和类间质样程序的表达是互斥的,而高度增殖的前体样状态的表达仅限于得分低于类间质样和肌母细胞样程序的细胞(图3b)。这些关联结果在来自最近发表的独立单核RNA-seq队列的RMS肿瘤数据集中得到了验证。
然后,使用元程序评分来定义每个细胞的离散“状态”。这种分析揭示了细胞状态在肿瘤之间的分布存在很大的变异性(图3c)。有趣的是,某些肿瘤(例如RMS012和RMS000HEI)主要由类间质样细胞组成,而其他肿瘤(例如RMS444和RMS000FWE)几乎完全包含前体样细胞。利用RNA荧光原位杂交验证了每个细胞状态的存在以及前体样和类间质样状态在个体肿瘤内的分布(图3d)。
为了研究FN RMS中细胞状态的层次结构,将数据建模为扩散图空间中的分化轨迹,并使用伪时间和RNA速度评估方向性(图3e)。这一分析表明,细胞从高增殖的祖细胞样状态转变为分化程度更高的间充质样或成肌样细胞状态。当将恶性细胞状态评分与正常肌源性细胞类型的相似性评分进行比较时,分化状态的差异也很明显。这表明,祖细胞样评分与未分化的肌源性祖细胞密切相关,而间充质样评分和成肌样评分分别与分化程度较高的正常细胞类型,即肌源性间充质细胞和成肌细胞/肌细胞密切相关。(图3f)。然后,作者利用SCENIC pipeline进行研究,以调查转录因子(TF)活性与轨迹特定伪时间的关系。这种分析显示,随着细胞向类间质样状态进展,几个已知在上皮-间质转化(EMT)中发挥作用的转录因子的活性增加,包括TWIST1和ZEB1。相反,向肌母细胞样状态进展的细胞表现出调节末端肌肉分化的关键调节因子活性上调,包括MYOD1、MYOG和MYF6(MRF4)。最后,高度增殖的祖细胞样细胞(在两个轨迹中的早期沿着伪时间)显示细胞周期进程调节因子的活性增加,包括几个E2F转录因子以及肌肉前体标记物SOX8。综上所述,FN RMS细胞中的转录细胞状态可以按照反映早期成肌分化的分化轨迹组织起来,在这种分化轨迹中,祖细胞样细胞可以产生类似于终末分化的成肌细胞的细胞,或者向类似于成肌间充质细胞的间充质状态发展。
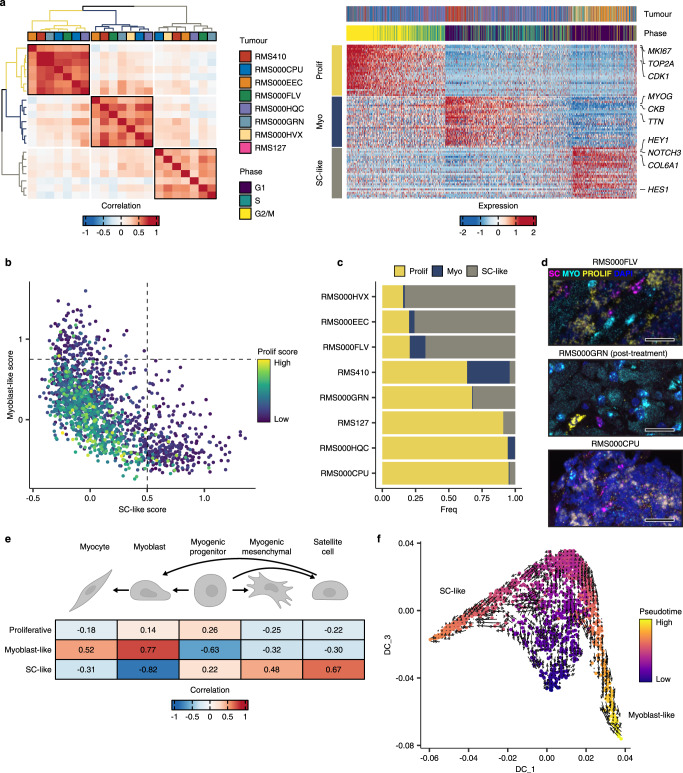
5、FP RMS中的分化状态反映了骨骼肌再生过程
通过扩展NMF分析,作者发现三个特定于FP RMS的元程序,其定义为在肿瘤样本间相关的转录程序(图4a-左图)。几乎所有被推测处于S期或G2/M期的细胞在这个元程序中得分较高(图4a-右图)。与在FN RMS肿瘤中发现的一样,成肌样细胞的程序以MYOG、TTN和CKB等终末成肌分化基因的表达为标志。最后,被称为"卫星细胞样"(SC-like)的程序的特征NOTCH3受体基因、Notch通路靶标,包括HEY1和HES1,以及编码V型和VI型胶原蛋白的基因的表达。这些基因在肌肉中的卫星细胞中具有特定调控静止、自我更新和激活的作用。对每个元程序对单个细胞的评分显示了类似肌母细胞和SC-like程序之间的相互排斥关系,而增殖性程序与两者都不相关,并且通常限制在对前两个程序得分较低的细胞中(图4b)。
与FN样本类似,肿瘤之间的离散细胞状态比例有很大的差异,特别是在增殖期和SC样状态之间(图4c)。使用RNA-FISH验证了每个元程序的表达以及类似肌母细胞和SC-like程序的相互排斥关系(图4d)。将元程序评分与逻辑回归定义的细胞相似性评分进行比较显示,类似肌母细胞的程序与正在进行终末分化的细胞类型(肌母细胞和肌细胞)强相关,而SC-like程序与出生后的卫星细胞最为相似(图4e)。增殖性程序评分与任何正常肌肉细胞类型的相关性不强,支持这个程序仅仅是细胞周期活动的指标。轨迹推断表明,得分高的类似肌母细胞或SC-like程序的细胞位于分化连续体的两个极端,而增殖性细胞则表现为一个未分化的中间状态(图4f)。然而,在这种情况下,RNA速度的结果并没有明确地暗示轨迹的严格方向性(图4e)。最后,TF活性分析显示,朝着类似肌母细胞状态发展的细胞具有较高的MYOG和MYOD1活性,而增殖状态的细胞则表现出较高的E2F TF活性。值得注意的是,除了NOTCH信号通路效应因子TF HEY1的高活性外,SC-like状态还与关键的卫星细胞调节因子PAX7的活性上调相关,进一步支持FP RMS中SC-like细胞状态与正常卫星细胞的相似性。总的来说, FP RMS中共享的细胞状态异质性形成了一个类似于骨骼肌再生的分化轨迹,其中SC-like细胞通过增殖、未分化的细胞状态连接到类似终末分化肌母细胞的细胞状态。
6、在RMS肿瘤器官模型中验证亚型特异性的恶性细胞状态
为了确定上述亚型特异性细胞状态是否与肿瘤细胞本身相关,作者试图将肿瘤微环境(TME)的影响与恶性细胞分开。作者对使用NMF定义的每个亚型特定的Meta程序的肿瘤类器官细胞进行了评分。在FN肿瘤器官细胞中,3个程序之间的关系与原发性RMS肿瘤观察到的类似:表达mesenchymal-like程序和myoblast-like程序是互斥的,而对progenitor-like程序得分较高的细胞在其他两个程序中得分较低。同样,在FP肿瘤器官细胞中,myoblast-like和SC-like程序之间存在强烈的负相关性,而高得分的proliferative程序在较低得分的这两个程序中更常见。接下来,为了评估是否保留了患者特异性的细胞状态异质性,作者直接比较了来自原发性肿瘤和衍生肿瘤器官的细胞的元程序得分,其中有4个患者有匹配的样本。总体而言,亚型特异性的元程序得分在原发性肿瘤和肿瘤器官样本之间有重叠。在RMS012中,与原发性肿瘤细胞相比,肿瘤器官中的细胞通常对mesenchymal-like程序得分较低,这可能是由于体外选择对较不增殖的mesenchymal-like状态细胞的影响。综上所述,原发肿瘤中存在的亚型特定细胞状态也反映在RMS肿瘤器官模型中,这表明这种异质性确实在很大程度上是恶性细胞固有的,而不是由TME诱导的。
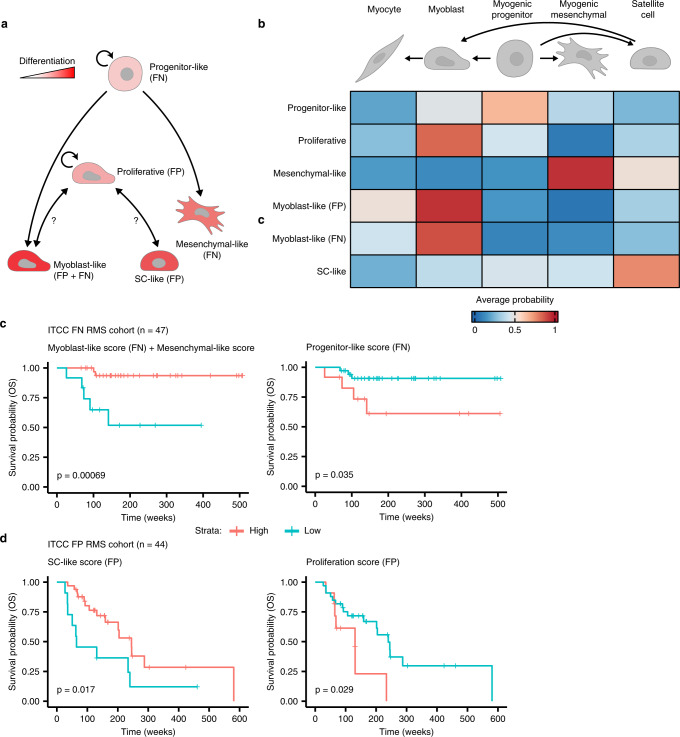
7、恶性细胞状态与患者预后密切相关
综上所述,NMF定义的转录程序的分析结果使作者能够提出FN和FP RMS肿瘤的细胞状态和分化轨迹的统一模型(图5a,b)。FN肿瘤是一种高度增殖的细胞,具有早期成肌祖细胞(祖细胞样细胞)的特征,可分化为两种类型:肌源性间充质细胞(间充质样细胞)或终末分化成肌细胞/肌细胞(成肌细胞样细胞)。另一方面,在FP肿瘤中,高增殖细胞(增殖期)是类似分化的肌细胞(肌母细胞样)或出生后骨骼肌驻留卫星细胞(SC样细胞)之间的中间细胞。为了研究RMS肿瘤的分化状态是否会影响它们的临床行为,作者对一组已发布的肿瘤样本的基因表达谱进行了评分,以获得每个元程序的分数。值得注意的是,分化程度高的FN RMS患者(间充质样+成肌样)的OS概率明显好于分化程度低的患者(p = 0.00069,图5c左图)。这一结果特别耐人寻味,因为细胞状态程序本身都不能预测结果。相反,未分化祖细胞样瘤的高分意味着OS明显比低分的FN瘤差(p = 0.035,图5c右图)。作者比较了分化和祖细胞样评分与先前验证的元基因评分对FN RMS患者分层的预测能力。虽然使用MG5.FN分数区分高风险和低风险病例的效果略微更显著,但分化分数预测了一组预后明显较差的患者(图5c)。值得注意的是,MG5.FN分数中没有一个基因与构成任何元程序分数的基因重叠。在FP RMS患者中,SC样程序的高表达与OS的延长有关(p=0.017),而高增殖评分表明OS较短(p = 0.029,图5d)。成肌样细胞程序在FP肿瘤中的差异表达并不能预测患者的存活率。总之,这些数据表明,在FN和FP两种RMS亚型中,具有更多分化状态细胞比例的肿瘤表现出比高水平增殖、较低分化细胞更好的预后。
参考文献:
DeMartino J, Meister MT, Visser LL, Brok M, Groot Koerkamp MJA, Wezenaar AKL, Hiemcke-Jiwa LS, de Souza T, Merks JHM, Rios AC, Holstege FCP, Margaritis T, Drost J. Single-cell transcriptomics reveals immune suppression and cell states predictive of patient outcomes in rhabdomyosarcoma. Nat Commun. 2023 May 27;14(1):3074.






