单细胞分析显示与肺癌的分子和免疫亚型有关的预后成纤维细胞亚群
成纤维细胞是一类未充分表征且在肿瘤进展中具有多样影响的细胞。本研究利用单细胞RNA测序、多重免疫组织化学和数字细胞学(CIBERSORTx)技术,在人类非小细胞肺癌中鉴定和表征了三个主要的成纤维细胞亚群:外膜、泡状和肌成纤维细胞。泡状和外膜成纤维细胞。肺泡和外膜成纤维细胞(在对照组织样本中丰富)定位于组织学正常肺组织中离散空间小生境,并在肺腺癌(LUAD)中存在时表明改善了总体生存率。轨迹推断确定了控制组织成纤维细胞激活的三个阶段,导致肿瘤样本中肌成纤维细胞的富集:首先炎性细胞因子的上调,然后应激反应信号的激活,最终导致纤维蛋白原胶原的表达增加。肌成纤维细胞与LUAD的较差总体生存率相关,与上皮分化丧失、TP53突变、近端分子亚型和髓系细胞募集有关。在鳞癌中,肌成纤维细胞尽管在转录水平上是相同的,但并无预后价值。这些发现对开发成纤维细胞靶向癌症治疗策略具有重要意义。
该研究于2023年1月发表在《Nature communications》,IF:17.694。
技术路线:

1、scRNA-seq数据计算鉴定成纤维细胞
我们对人类肺组织样本进行了scRNA-seq(n = 18;六个对照组、七个鳞状细胞癌[LUSC]和五个腺癌[LUAD];图1a),在组织解聚过程中富集成纤维细胞。鉴于样本是从手术切除中获取的,并非同时处理,我们评估了这是否在scRNA-seq数据中产生批次效应,通过对来自各个患者收集的细胞之间的k最近邻重叠进行分析。结果发现明显增加的重叠,因此会影响聚类结果。为了减轻这个问题,我们应用了基于互补PCA(reciprocal PCA, rPCA)的数据整合方法。然后进行聚类和差异基因表达分析。这识别出多个不同的间质、免疫和上皮细胞群体(图1c)。间质细胞包括两个单独的簇:内皮细胞(通过VWF等经典标记物标记)和基质细胞(通过DCN和DPT标记)(图1c)。
为了研究成纤维细胞,我们检查了基质细胞簇。鉴于壁细胞是肺组织中突出的基质细胞类型,并且在我们最初的聚类中没有被鉴定出来,我们尝试确定基质细胞簇是否包含了成纤维细胞和壁细胞。这是很重要的,因为肌成纤维细胞通常通过表达参与细胞收缩的蛋白编码基因(例如ACTA2 [编码αSMA的基因])来鉴定,这些基因在壁细胞中高度表达。为了区分这些细胞,我们使用人类肺细胞图谱(HLCA)的scRNA-seq数据,识别在人类肺组织中成纤维细胞和壁细胞之间差异表达的基因(图1e)。我们将这些标记限制为先前描述的在多个小鼠器官中界定成纤维细胞和壁细胞的基因的人类同源基因,生成了成纤维细胞和壁细胞的一致基因标记(图1e)。为了确定这些基因标记是否能够有效区分壁细胞和成纤维细胞,我们计算了它们在HLCA数据集中每个细胞的平均表达,显示出99%的准确性来识别这两种细胞类型(图1f、g)。然后,我们检查了这些基因标记在我们的数据集中的表达情况(图1h-j),证明在基质细胞簇中检测到了壁细胞(n = 69)和成纤维细胞(n = 885)。为了进一步测试在分析整个组织均质化的肿瘤样本时,成纤维细胞和壁细胞是否常常聚集在一起,我们在多个公开可用的数据集上重复了这个分析,始终观察到类似的结果。
总之,我们已经确定了一种广泛适用的方法,可以在scRNA-seq数据集中区分成纤维细胞和壁细胞,这是表征肿瘤微环境中成纤维细胞(或壁细胞)异质性的关键步骤。

2、NSCLC中存在三种成纤维细胞亚群
由于成本、样本可用性以及从组织中分离这些细胞的困难导致在scRNA-seq数据集中获得足够的样本以实现成纤维细胞亚群的人群水平(跨多个患者)表征具有挑战性,导致不同组织中的比例不一致。为了克服这个挑战并全面研究非小细胞肺癌中成纤维细胞的异质性,我们在来自人类非小细胞肺癌和对照组织样本的另外六个scRNA-seq数据集上重复了体外成纤维细胞分选的过程(排除壁细胞)。这产生了一个包含9673个成纤维细胞的数据集(图2a;其中5183来自39个对照组织;3440来自46个LUAD样本和654来自16个LUSC样本)。为了整合和校正数据集之间的批次效应,我们使用了经典相关分析。然后,我们使用共享最近邻模块化优化算法进行了无监督聚类。为了确定最具生物学信息的聚类解决方案,我们在不断变化的分辨率参数下运行了这个分析,以逐步增加确定的聚类数,并检查了每个聚类中识别的标记基因的数量(样本水平的平均对数折叠变化 > 1,调整p值 < 0.01,并由至少50%的样本表达)。结果显示出三个主要聚类一致地被确定,而更高分辨率的聚类则导致识别到不符合这些标准的聚类或只有极少数标记基因(图2b)。
所确定的三个聚类与先前在对照肺组织中描述的成纤维细胞亚群一致(外膜、肺泡和肌成纤维细胞)。为了全面表征这些成纤维细胞亚群的人群水平特征,我们首先计算了每个亚群的样本级基因表达谱,然后进行差异基因表达分析(图2c);使用REACTOME通路进行基因集变异分析(GSVA)(图2d)以及使用先前描述的成纤维细胞亚群的基因标记进行GSVA。
使用单细胞数据进行差异表达分析发现了622个被肌成纤维细胞上调的基因,其中188个在样本级别分析中仍具有显著性(adj.P < 0.01)。从单细胞分析到样本级别分析中标记物识别的 减少表明,在样本数量方面,确保scRNA-seq数据集具有足够的能力来检测人群水平的差异是非常重要的。肌成纤维细胞亚群的关键标记物包括MMP11、POSTN、CTHRC1、COL1A1、ACTA2和COL3A1。GSVA显示这些细胞在多个与生成胶原基质相关的通路中显著上调(图2d),这与肌成纤维细胞在纤维化和肿瘤中的重要作用一致。除了涉及基质生物合成的通路外,还有多个涉及细胞-基质相互作用的通路上调,包括整合素细胞表面相互作用和突触蛋白相互作用(图2d)。这些细胞还上调了多个先前描述的肌成纤维细胞和myoCAF基因标记。
差异表达分析使用单细胞数据发现了481个在外膜成纤维细胞中上调的基因,与其他亚群相比,其中73个基因在跨样本的差异表达分析中仍然显著——包括PI16、IGFBP6、MFAP5、APOD、PLA2G2A和GSN。GSVA确定了涉及前列腺素I2合酶(PTGIS)的多个通路的表达上调,包括前列腺素和胆酸/盐的合成(图2d),这对于从肺吞噬细胞中释放胆固醇至关重要。另外,替代补体激活通路也显著上调,涉及C3和CFD(图2d)。周边成纤维细胞还上调了与COL14A1 + 基质成纤维细胞、PI16 + 'universal'成纤维细胞群以及胰腺癌和乳腺癌中描述的iCAF亚群相关的基因标记物。
对于肺泡成纤维细胞,单细胞差异表达分析发现了672个上调基因,其中78个在样本级别分析中仍具有显著性,包括MACF1、RGCC、INMT、LIMCH1、A2M和GPC3。GSVA确定了TRP通道的上调(图2d),这些通道可以检测和传导感觉信号(如氧化应激、pH和热量),将其转化为化学或电信号来调节细胞反应。涉及SLIT和ROBO基因家族成员的通路也上调(图2d),这些通路在调节纵向轴突路径选择中发挥了重要作用,但也已被证明在关节炎中调节成纤维细胞迁移。肺泡成纤维细胞还上调了与COL13A1+基质成纤维细胞群和肺特异性NPNT+成纤维细胞群相关的基因标记。
细胞外基质(ECM)的生成和重塑是所有组织中成纤维细胞的关键功能。与此一致的是,差异表达的基因在ECM成分中显著富集(Fisher精确检验p = 1.34e-62),其中31%的差异表达基因与基质组分相关。因此,我们检查了每个成纤维细胞亚群是否上调了与特定基质组分相关的基因(基底膜、间质胶原、ECM糖蛋白和蛋白聚糖;图2e)。结果显示,肌成纤维细胞在每个基质组分中上调了多个基因,包括大部分上调的间质胶原基因(图2e);肺泡成纤维细胞上调了与基底膜和ECM糖蛋白相关的多个基因;周边成纤维细胞上调了多个ECM糖蛋白和蛋白聚糖(图2e)。为了进一步研究这些差异,我们计算了每个基质组分的模块分数,并比较了它们在不同成纤维细胞亚群中的整体表达水平(图2)。结果显示,与周边和肺泡成纤维细胞相比,肌成纤维细胞显著上调了间质胶原的表达(图2f);而肺泡和肌成纤维细胞相比,周边成纤维细胞显示出基底膜基因的显著增加表达(图2g)。众所周知,过度的胶原沉积是肌成纤维细胞的主要功能。为了确定这是否是这些细胞的病理特异性功能,我们检查了从对照组织或肿瘤组织中分离的成纤维细胞亚群中特定基质组分的表达是否存在差异。结果显示,间质胶原的表达在肿瘤样本中的三个亚群中均显著增加(图2h)。
这些结果表明,不同病理条件可能会导致成纤维细胞亚群内的变异,这可能反映了它们的活化水平。为了进一步研究这一点,我们在每个亚群中对对照样本和肿瘤样本之间进行了差异表达分析。这一分析确定了在与肿瘤相关的外膜成纤维细胞中下调的多个基因,包括IGFBP6、FABP4和DCN。相反,与对照组相比,与肿瘤相关的肌成纤维细胞中上调了多个基因,包括SULF1、COL11A1和LRRC15。我们还检查了之前描述的CAF亚群的基因标记是否在来自对照或肿瘤样本的成纤维细胞中差异表达。预期的是,无论肿瘤亚型如何,肿瘤样本中的myoCAF基因标记都显著上调(图2i)。然而,与此相反,与肿瘤相关的成纤维细胞中iCAF基因标记显著下调,与对照组织相比(图2j)。
总而言之,这些数据显示,在非癌性肺组织中识别出的三个主要亚群与NSCLC中的成纤维细胞一致,并且可能对ECM的维持/重塑具有不同的调控作用。这些数据还表明,与NSCLC肿瘤的相互作用导致了每个亚群内基因表达的显著变化,其中除了亚群特异性的表型变化外,还始终涉及间质胶原的上调。此外,我们还表明,在NSCLC中,myoCAF基因标记在肺成纤维细胞中上调,而iCAF基因标记在对照肺组织中上调。
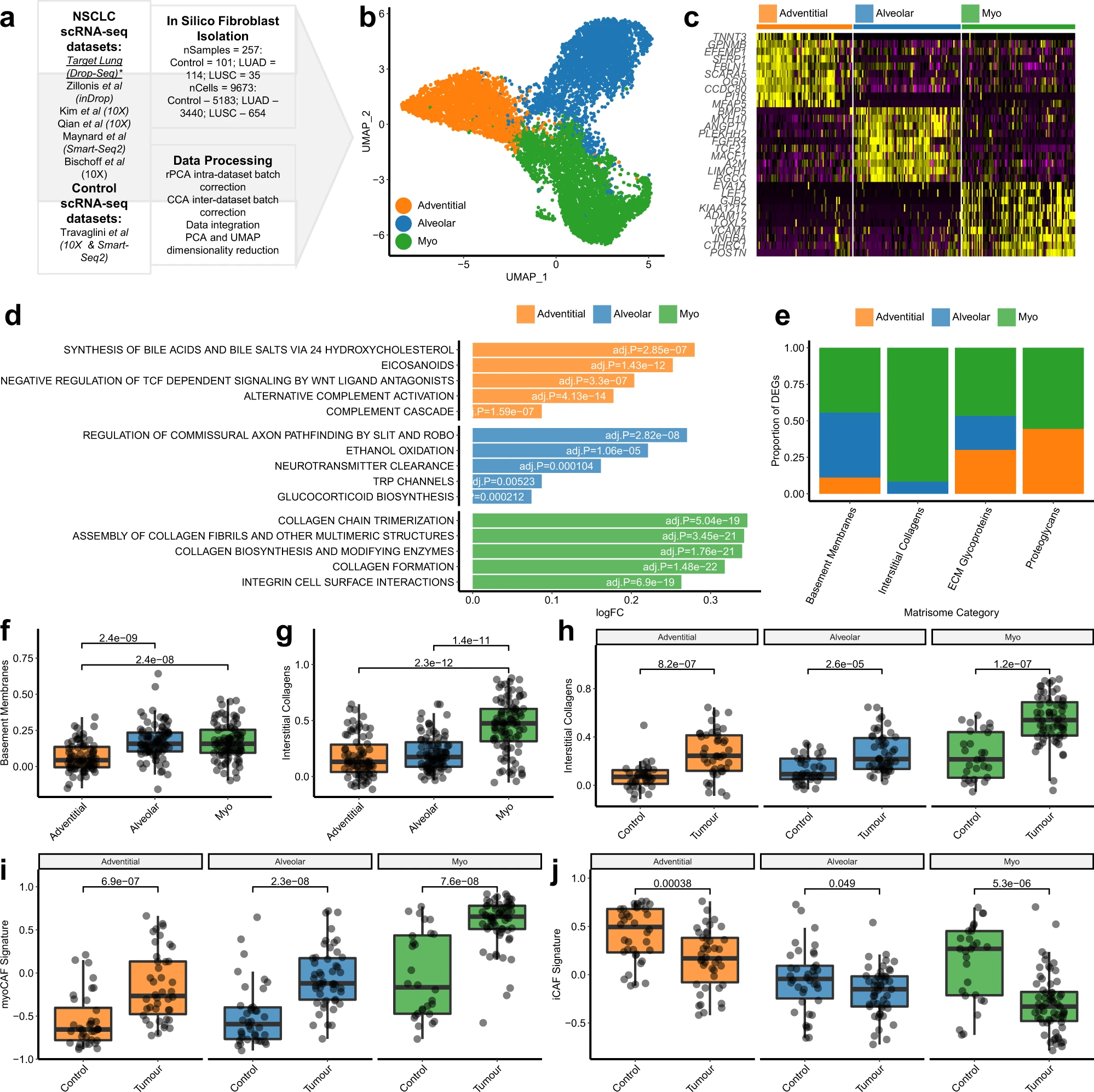
3、查看不同亚型的空间分布和丰度
为了对通过scRNA-seq鉴定的三个成纤维细胞亚群进行正交验证,我们设计了一个多重免疫组织化学(mxIHC)面板。在这项分析中,我们使用人类蛋白质图谱数据库(Human Protein Atlas)来确定每个亚群的标记基因,这些基因具有“增强型”抗体验证,表示在免疫组织化学或RNA测序中测量时具有一致的表达水平;并且已有文献证明该蛋白质在细胞内可检测(图3a)。通过人类蛋白质图谱的图像,经咨询病理学家筛选通过这些标准的基因在成纤维细胞中的表达情况,选择CD34、AOC3和POSTN或ACTA2(α-SMA)作为外膜、肺泡和肌成纤维细胞的最佳免疫组织化学标记(图3a)。此外,排除标记物Pan-CK、CD31和MCAM(分别为上皮、内皮和腔内细胞标记物)也被纳入到mxIHC面板中。
与先前定义的肺成纤维细胞表型命名一致,我们的mxIHC显示肺泡和外膜亚群存在于对照(组织学正常)肺组织的这些区域(图3b)。值得注意的是,AOC3+(肺泡)成纤维细胞也观察到存在于间质性肺组织中(图3b),而CD34+(外膜)成纤维细胞也观察到存在于周围支气管区域(图3b)。然后,我们将该mxIHC面板应用于NSCLC组织的整块切片(15个LUAD和10个LUSC,包括我们的scRNA-seq队列中的十个样本)。如预期的一样,我们鉴定出的三个成纤维细胞亚群显示出离散的成纤维细胞亚群,并且每个亚群在分析的三种组织类型中均存在(对照、LUAD和LUSC;图3c、d)。
随后,我们将该mxIHC面板应用于NSCLC组织的整块切片(15个LUAD和10个LUSC,包括来自我们的scRNA-seq队列的十个样本)。如预期的一样,我们鉴定出的三个成纤维细胞亚群显示出离散的成纤维细胞亚群,并且每个亚群在分析的三种组织类型中均存在(对照、LUAD和LUSC;图3c、d)。
为了在更大的队列中研究这些成纤维细胞表型,使用CIBERSORTx介导的数字细胞计数法进行分析,使用scRNA-seq数据生成了一个签名矩阵,包括每个成纤维细胞亚群、内皮细胞、腔内细胞、上皮细胞和免疫细胞。使用组合单细胞转录组生成的伪批量数据集测试了该方法的准确性,为每个伪批量样本提供了基准真值。这证实了对所有细胞类型的准确计数,包括三个成纤维细胞亚群(R2 = 0.81 [外膜],0.91 [肺泡]和0.92 [肌];p < 3.53e-76)。
我们检查了对照、LUAD和LUSC组织样本中每个亚群的相对丰度。在scRNA-seq数据集中,与LUAD和LUSC相比,外膜成纤维细胞在对照组织样本中显著更丰富(图3e)。肺泡成纤维细胞在对照组织中同样最丰富,但在一些LUAD样本中也检测到高水平,并且在LUSC中很少存在(图3e)。相反,肌成纤维细胞在LUAD和LUSC中丰度增加,但在LUSC中相对于LUAD显著更丰富(图3e)。通过使用CIBERSORTx分析TCGA RNA-seq数据集(图3g)来确认这些成纤维细胞亚群与组织类型之间的关联。然后通过mxIHC进一步验证(图3f),在分析中排除了组织块中被困的非肿瘤组织(如图3c所示)
考虑到LUSC肿瘤中肌成纤维细胞的水平高于LUAD肿瘤,我们假设肿瘤亚型可能也会对相邻组织产生不同的影响。为了验证这一点,我们使用mxIHC数据集比较了LUSC和LUAD病例的肿瘤邻近组织区域。结果显示,类似于肿瘤内区域,与LUSC相邻的肺部区域中的肌成纤维细胞增多,肺泡成纤维细胞减少,相比之下与LUAD相邻的肺组织。然后,病理学家评估了这些肿瘤邻近区域,以确定是否存在炎症和/或纤维化的证据,发现55%的LUSC病例存在炎症和/或纤维化,而LUAD中则不存在。当按炎症和/或纤维化的存在将这些对照组织区域分组时,肺泡和肌成纤维细胞的丰度也存在显著差异。然而,在任何比较中,外膜成纤维细胞的丰度均没有显著差异。
总之,对照肺组织富集了外膜和肺泡成纤维细胞亚群,而这些亚群在NSCLC中被肌成纤维细胞取代。此外,成纤维细胞亚群的丰度在NSCLC亚型之间也存在差异,LUAD肿瘤在这三个亚群之间的异质性更大,而LUSC肿瘤的肌成纤维细胞水平始终较高。
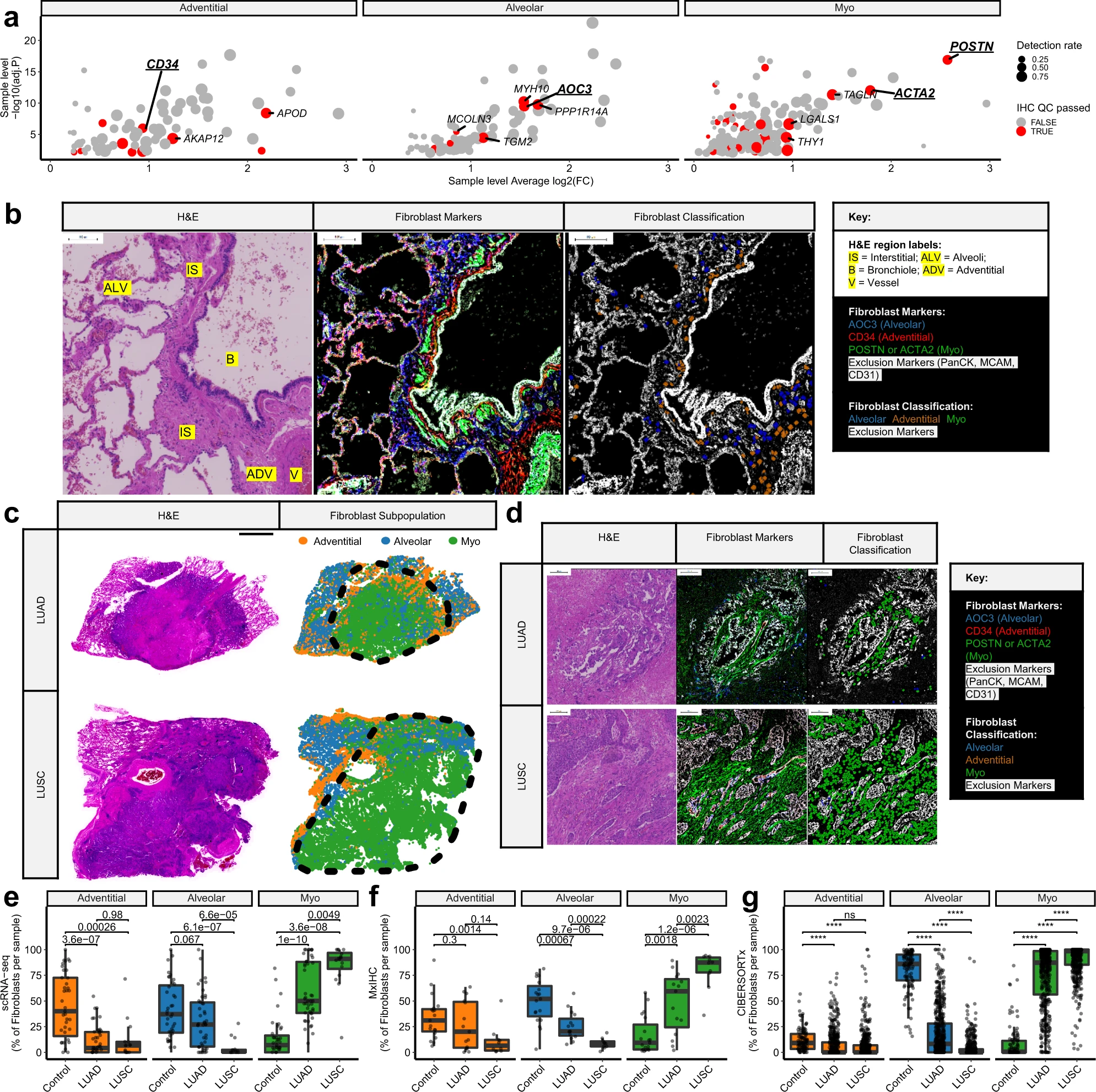
4、用轨迹推断研究MyoCAF的激活
为了研究从富集于对照组织的肺泡和外膜成纤维细胞亚群向富集于肿瘤组织的肌成纤维细胞转分化的过程,我们对scRNA-seq数据集进行了轨迹推断,使用扩散映射降维方法。结果显示,外膜和肺泡成纤维细胞可能作为独立的祖细胞,可以进行向肌成纤维细胞的转分化(图4a,b)。然后,我们将细胞按照“伪时间”排序,表示它们相对于肌成纤维细胞表型的进展(图4c)。通过分别检查每个数据集,并使用Stouffer方法计算元p值,识别了伪时间上差异表达的基因。然后,基于在“伪时间”上的相关表达,将具有显著差异表达的基因(经过调整的元p值< 1 × 10−10,并且在至少三个数据集中的名义p值< 0.05)聚类成模块。这在两个轨迹上识别出了四个模块,代表了转分化的不同阶段:祖细胞、早期激活、原始分化和分化(图4d,e)。将分配给每个模块的基因进行比较,发现两个轨迹之间存在显著的重叠,表明无论前体亚群如何,肌成纤维细胞的转分化过程是相似的(Fisher精确p值< 1.03e-10)。
为了对这些转分化阶段进行功能注释,我们使用REACTOME通路数据库进行富集分析(图4h)。早期激活模块显著富集了已知参与细胞因子信号传导的基因(图4h),并且还包含多个先前描述的iCAF标记基因(例如IL6和CCL2)。值得注意的是,当分析仅包含对照样本或包含对照样本和NSCLC样本的数据集时,发现类似的表达模式(图4f),这表明转分化过程的这个阶段可能独立于与NSCLC肿瘤相关的刺激。为了验证这一点,我们根据细胞在伪时间中的位置,将scRNA-seq数据集中的所有成纤维细胞分为五个区间,然后计算每个模块的表达的样本平均值。结果显示,与转分化过程的所有阶段相比,对照样本中的早期激活模块在成纤维细胞中显著增加,而在肿瘤样本中显著降低(图4g)。
相比之下,对于原始分化和分化模块,伪时间上的表达趋势在仅包含对照样本或包含对照样本和NSCLC样本的数据集之间存在定性差异(图4f)。因此,我们采用相同的方法来确定样本类型对Proto-differentiation模块的表达是否有影响。结果发现,在转分化的中间阶段,肿瘤样本中这个模块的表达显著增加(图4g)。这个模块富集了许多编码核糖体蛋白的基因(图4h),这是肌成纤维细胞的一个良好描述的超结构特征,可能表明这些细胞具有增加的蛋白质翻译能力。热休克家族基因参与了HSF1转录激活(例如HSPA1A、DNAJB1和HSP90AB1),在这个模块中也显著富集(图4h),先前的研究已经显示它们调节了肿瘤介导的成纤维细胞活化。此外,与氧化应激反应有关的基因(如HIF1A、GGT和SERPINE1),这是热休克应激和成纤维细胞活化的已知驱动因素,在这个模块中也被发现。为了进一步研究热休克/应激反应在肌成纤维细胞活化中的作用,我们使用mxIHC检查了HSPA1A/Hsp70的表达。结果显示,在将位于肿瘤内的细胞与肿瘤旁对照区域的细胞进行比较时,每个成纤维细胞亚群中的HSPA1A/Hsp70表达显著增加(图4i),确认与NSCLC肿瘤相关的刺激引起的热休克反应比来自对照组织的刺激更为明显。
与对照组织相比,分化模块在所有转分化阶段的肿瘤组织中显著增加(图4g)。该模块富集了参与胶原形成和细胞外基质组织的基因(图4h),与肌成纤维细胞表型一致,以及上述数据显示与对照组织样本相比,肿瘤样本中纤维蛋白胶原的上调。
综上所述,这些结果表明,对照组织富集的两个成纤维细胞亚群(外膜和肺泡)可能作为组织内驻地的肌成纤维细胞的祖细胞。这些数据还表明,不考虑祖细胞亚群,转分化的过程是相似的:涉及短暂的炎症基因上调阶段,与肿瘤的直接相互作用无关;随后是通过与肿瘤的相互作用增加的热休克反应信号介导的原始分化;最后形成完全分化的肌成纤维细胞表型,具有增强的细胞外基质组织和胶原形成能力,该过程受到肿瘤相关刺激的显著增强。
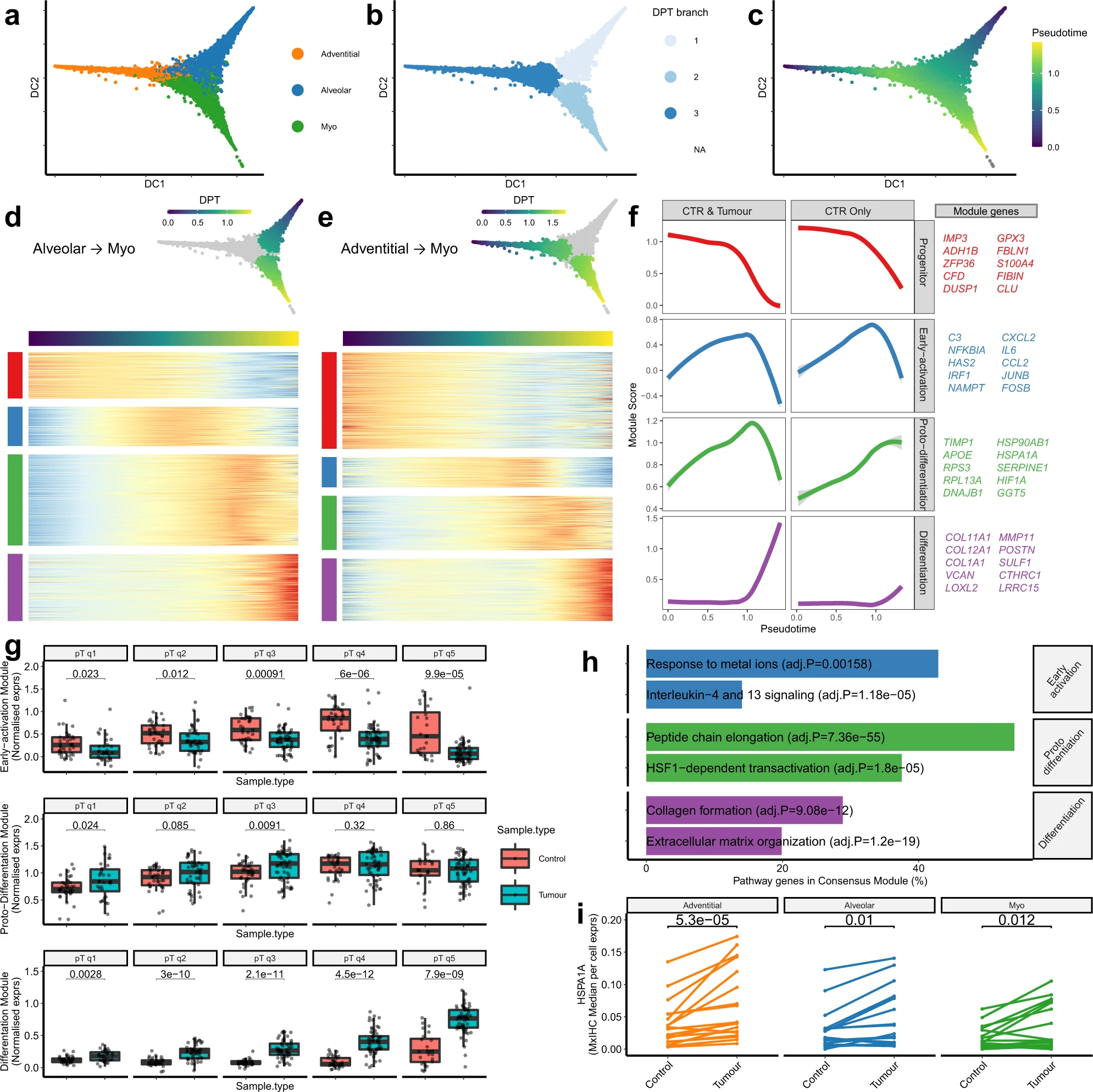
5、成纤维细胞表型的跨组织分析
为了确定这些成纤维细胞表型是否在不同的癌症类型中保持一致,我们分析了公开可用的胰腺导管腺癌(PDAC)、头颈部鳞状细胞癌(HNSCC)和结直肠癌(CRC)的数据。在每种情况下,通过无监督聚类和Mural cell的排除来识别成纤维细胞,如上所述(图5a)。然后使用概率机器学习模型将这些细胞分类为在NSCLC中识别出的三个亚群(图5b,c)。结果显示,无论是PDAC(冠状动脉中位数概率=0.67),HNSCC(0.75),还是CRC(1),冠状动脉和肌成纤维细胞人群在所有分析的癌症类型中都保持高度一致(肌中位数概率=1)。然而,被归类为肺泡亚群的成纤维细胞具有更低的概率分数(PDAC中位数概率=0.49,HNSCC=0.52,CRC=0.56),这表明它们与肺之间存在更大程度的表型分化。
然后,我们通过将我们的多重免疫组织化学(multiplex IHC)面板应用于由PDAC、HNSCC和CRC的肿瘤和对照组织核心组成的组织微阵列,来验证这些结果。与单细胞转录组测序结果一致,这显示冠状动脉和肌成纤维细胞是每种癌症类型中主要识别出的亚群(图5d)。此外,与我们在NSCLC中发现的结果一样,无论是PDAC、HNSCC还是CRC,冠状动脉成纤维细胞在对照组织中明显更丰富,而肌成纤维细胞在肿瘤组织中更丰富(图5e和图5f)。
为了测试肺泡表型是否特异于肺组织,我们对由特发性肺纤维化(IPF)样本[15](即非癌性肺病理)生成的单细胞转录组测序数据进行了类似的分析。结果显示,在所有三个亚群中都高概率地识别出特发性肺纤维化样本(中位数概率=0.95 [冠状动脉],0.88 [肺泡],0.90 [肌])。值得注意的是,这种分析还显示,与癌症数据集中的肌成纤维细胞分类相比,IPF中的肌成纤维细胞分类概率较低,这表明癌症和纤维化中的肌成纤维细胞可能存在细微的差异。
6、应用多个非小细胞肺癌队列进行生存分析
为了研究成纤维细胞亚群在非小细胞肺癌(NSCLC)中的临床相关性,我们利用CIBERSORTx介导的数字细胞学的计算细胞丰度,对大规模的临床注释的NSCLC队列进行了分析(四个LUAD队列,n = 1669;四个LUSC队列,n = 1104)。我们使用每个成纤维细胞亚群的相对丰度进行Cox比例风险回归建模。结果显示,在LUAD中,肌成纤维细胞与较差的总体生存率之间存在一致的关联(p < 0.01),但在LUSC中没有发现显著相关性。鉴于肌成纤维细胞在这两种NSCLC亚型中丰度高,我们推测这种差异可能是由于亚型之间的表型变化。然而,通过样本水平的分析未能发现任何显著差异表达的基因,这表明这两种NSCLC亚型中的肌成纤维细胞在转录组水平上的表型差异很小。
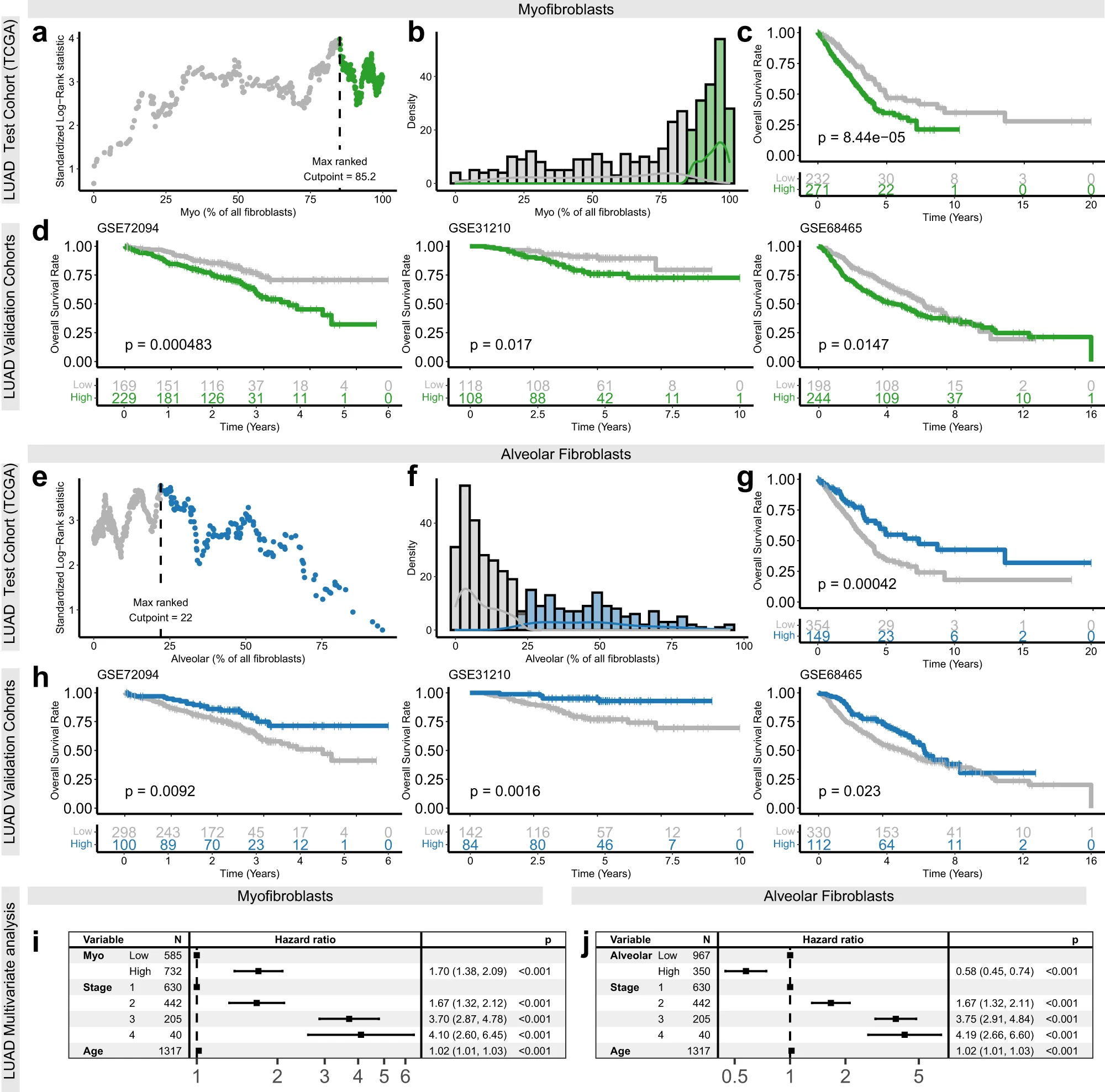
为了研究在LUAD中使用肌成纤维细胞丰度作为患者分层的预后生物标志物的潜力,我们使用TCGA-LUAD数据集作为测试队列,确定将样本分为肌成纤维细胞高(> 85.2%)和低(< 85.2%)的最佳阈值(图6a-c)。然后将这个阈值应用于三个验证队列,结果显示始终存在显著的患者分层效果(log-rank p ≤ 0.02;图6d)。多变量Cox回归分析还表明,这些预后相关性与疾病阶段和患者年龄无关(p < 0.0001,HR [95% CI] = 1.70 [1.38, 2.09];图6i)。
相反,肺泡和冠状动脉成纤维细胞的丰度与多个LUAD数据集中更好的总体生存率相关。这种关联尤其在肺泡成纤维细胞中非常一致,在所有分析的数据集中都显著(p < 0.01)。因此,我们采用上述相同的方法,测试将LUAD队列作为肺泡成纤维细胞高(> 22.0%)或低(< 22.0%)进行分组的潜力作为预后标志物(图6e-g)。结果同样显示,将LUAD队列按肺泡成纤维细胞的丰度分为高和低,能够有效地分层总体生存率(log-rank p < = 0.02;图6h);并且这种关联与疾病阶段和患者年龄无关(图6j)。
7、研究LUAD与关键预后特征的相关性
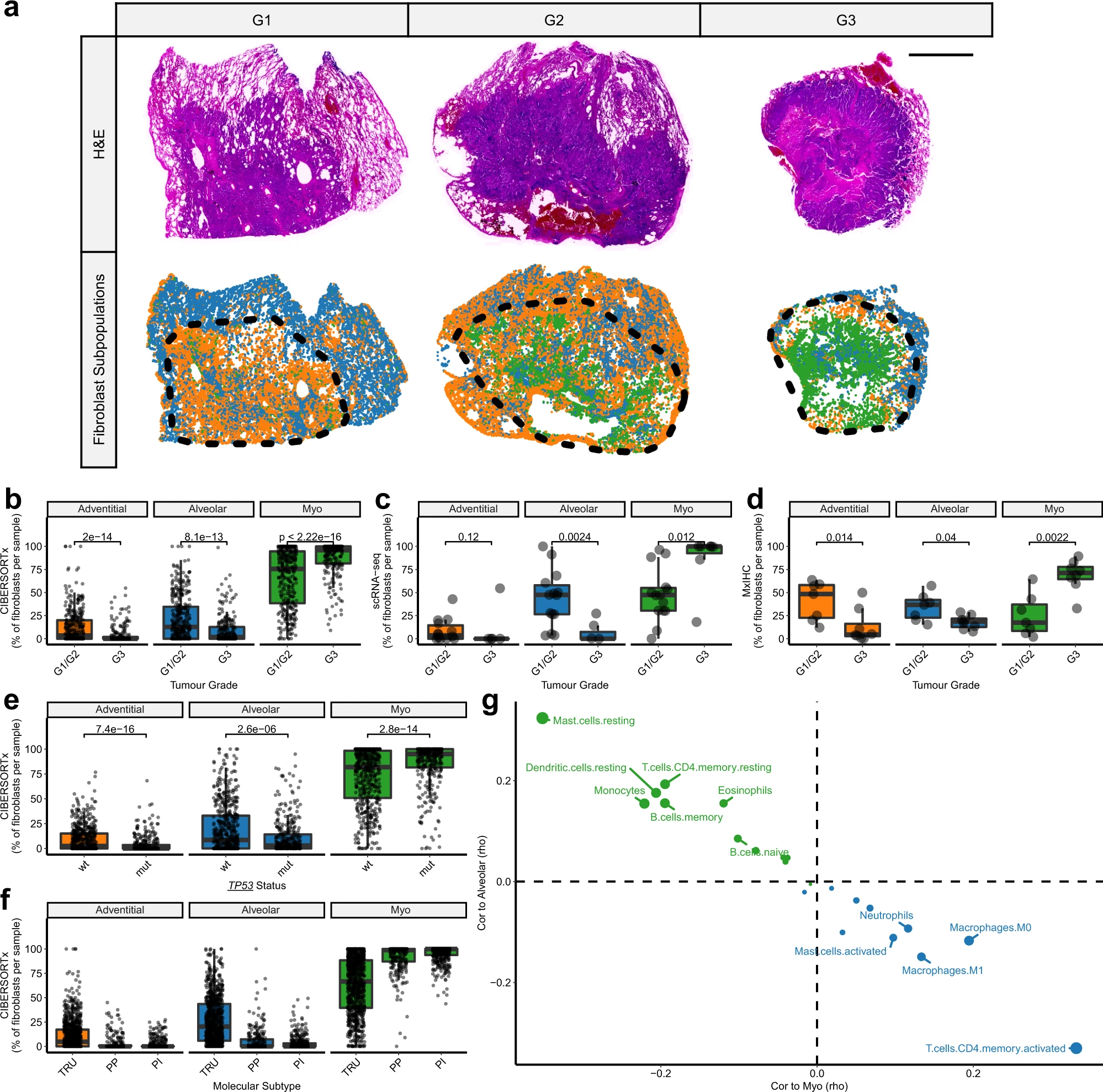
已知,LUAD肿瘤的形态亚型与患者的生存率相关。根据CIBERSORTx(n = 623,p < 0.0001;图7b)、scRNAseq(n = 21;图7c)和mxIHC(n = 15;图7a,d)的结果显示,成纤维细胞亚群的丰度在LUAD的形态亚型之间存在显著差异。与中度/良分化(G1/G2;鳞状、腺泡和乳头状)的肿瘤相比,肌成纤维细胞在差分化较差(G3;实性或微乳头状)的肿瘤中增加。尽管存在这种关联,成纤维细胞亚群的丰度仍然是多元Cox回归中的一个重要独立预后指标,包括年龄、分期和分级作为协变量(肌成纤维细胞:HR [95% CI] = 1.44 [1.07, 1.95],adj.P = 0.015;肺泡成纤维细胞:HR [95% CI] = 0.67 [0.46, 0.96],adj.P = 0.028;n = 601)。
LUAD肿瘤内部的形态可以具有异质性。因此,我们利用我们的MxIHC数据集来研究成纤维细胞亚群与特定形态模式之间的关联。结果发现,肌成纤维细胞与实性生长模式在肿瘤中所占比例之间存在显著相关性(rho = 0.60,p < 0.01);肌成纤维细胞明显是混合形态肿瘤实性区域中的主要基质细胞类型。与微乳头状生长模式之间存在较弱且不显著的相关性(rho = 0.44,p = 0.07)
先前的研究已经描述了LUAD的形态亚型和分子亚型(近端-炎症性[PI]、近端-增殖性[PP]和末端呼吸单位[TRU])之间的关联。我们在大样本组织数据集中验证了这一关联,发现77%的TRU肿瘤为中度/良分化(G1/G2),而69%的PP肿瘤为差分化较差(G3)。符合这种关联的预期,肌成纤维细胞在PP肿瘤中丰度最高,而肺泡和外膜成纤维细胞在TRU肿瘤中最为突出(图7f)。此外,与先前描述的PP肿瘤与TP53突变之间的关联一致,我们还发现在携带TP53突变的LUAD肿瘤中,肌成纤维细胞的丰度增加(图7e)。
我们还使用CIBERSORTx来检查免疫细胞亚群(LM22-57)的丰度以及它们与成纤维细胞亚群之间的相关性。这显示了与肌成纤维细胞和肺泡成纤维细胞相关的免疫细胞之间的反向关系,在所有分析的LUAD转录组数据集中一致观察到(图7g)。结果显示,肺泡成纤维细胞与多个静息型免疫细胞亚群呈正相关(图7g,例如肥大细胞、CD4 + 记忆T细胞和树突状细胞),还包括单核细胞和B细胞(记忆型和未经刺激的亚群)。相反,肌成纤维细胞与巨噬细胞、中性粒细胞、活化肥大细胞和活化CD4 + 记忆T细胞呈正相关(图7g)。这表明,在肿瘤微环境中,肌成纤维细胞的分化也与辅助T细胞和髓系细胞的激活/分化相关联。
实验方法
scRNA-seq数据处理与分析、成纤维细胞的鉴定、多重免疫组织化学(MxIHC)、多重序列优化和验证、多重图像生成、多重图像分析、基质细胞鉴定和组织细胞计数法、空间分析、批量转录组数据分析、利用CIBERSORTx进行数字细胞学分析、生存分析、统计分析。
参考文献
Hanley, C.J., Waise, S., Ellis, M.J. et al. Single-cell analysis reveals prognostic fibroblast subpopulations linked to molecular and immunological subtypes of lung cancer. Nat Commun 14, 387 (2023).






