牙髓干细胞来源的外泌体通过GPER介导的cAMP/PKA/CREB信号通路激活NOD小鼠的唾液腺上皮细胞功能

干燥综合征(SS)是一种以口干和眼干为特征的慢性、全身性自身免疫性疾病,好发于绝经期女性。口干症是一种临床常见的由唾液分泌不足引起的疾病,可导致吞咽困难、龋齿、牙周病等。随着疾病发展,约2/3的SS患者出现全身免疫功能紊乱。外泌体是一种直径40~150nm的细胞外囊泡,携带多种生物分子,可以转移到受体细胞。据报道,间充质干细胞来源的外泌体(MSC-Exos)有助于细胞间通讯,已显示出治疗包括SS在内的各种炎症性疾病的潜力。牙髓干细胞(DPSCs)是从牙髓组织中分离得到的一种间充质干细胞,具有高度增殖和较低的免疫原性。过去几年中,研究人员主要利用DPSCs来源的外泌体(DPSC-Exos)来治疗系统性疾病,因为它们具有抗凋亡、抗炎和再生等特性。然而,DPSC-Exos在缓解SS患者口干和恢复涎腺功能方面的疗效尚不明确。该研究发表在《Journal of Translational Medicine》,IF:7.4。
技术路线

示意图
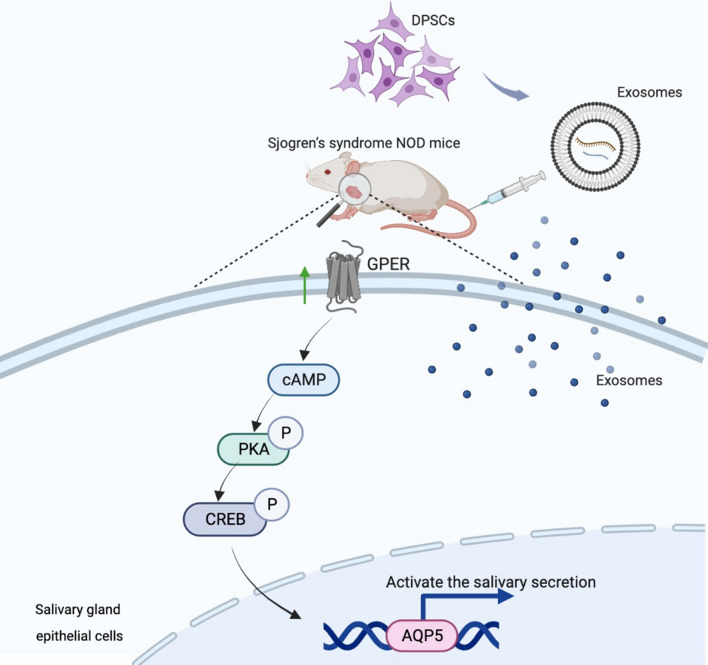
主要研究结果
1. 牙髓干细胞(DPSCs)的分离、培养和鉴定
分离人DPSCs,并在倒置相差显微镜下观察不同代次的培养和细胞膜片培养(图1A)。DPSCs呈成纤维样细胞形态。DPSCs高表达MSCs表面标志物CD29(99.9%)、CD90(99.9%)、CD105(99.9%)和CD44(99.5%)。造血细胞标志物CD34、CD45、CD19和HLA-DR表达<1%(图1B),表明DPSCs具有低免疫原性。多谱系分化实验显示了DPSCs的成骨(图1C)、成脂(图1D)和软骨分化(图1E)潜能。作者的结果证实了该研究中使用的DPSCs的MSC表型。
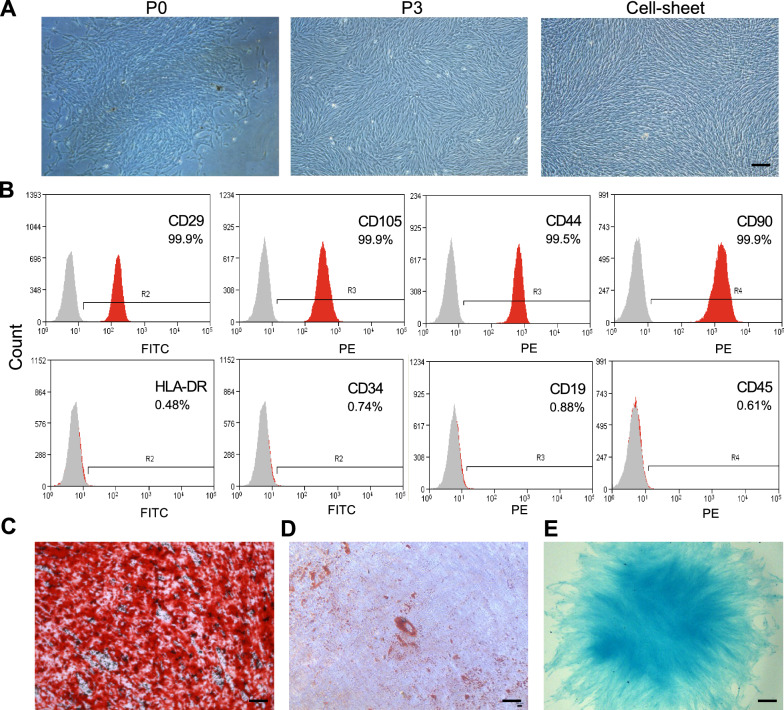
图1 DPSCs的分离和鉴定
2. DPSC-Exos的分离和鉴定
采用超速离心法从DPSCs细胞片层条件培养基中分离DPSCs-exos。透射电镜显示,DPSC-Exos呈现典型杯状形态的双层膜结构(图2A)。NTA显示了DPSC-Exos在30-150nm的粒径分布(图2B)。DPSC-Exos表达典型的外泌体标志物ALIX、TSG101和CD63(图2C)。在共培养的4小时内,DPSC-Exos很容易在SGEC中内化(图2D)。总之,这些数据表明成功分离出了可内化于SGEC中的DPSC-Exos。

图2 DPSCs膜片释放外泌体(DPSC-Exos)的分离和鉴定
3. DPSC-Exos部分恢复了IFN-γ诱导的SGEC死亡和AQP5的下调
浸润淋巴细胞分泌的IFN-γ可诱导SS相关的导管细胞凋亡,从而损害腺体分泌功能。因此,IFN-γ通常在体外用于模拟SS期间唾液腺的炎症条件。在这项研究中,IFN-γ处理12 h显著抑制了SGEC的增殖(图3A)。为验证DPSC-Exos对IFN-γ诱导SEGC死亡的影响,在SGEC中分别加入不同浓度(5、20、80 g/ml)的DPSC-Exos处理24、48、72 h。与IFN-γ组相比,20、80μg/ml DPSC-Exos处理组在48、72 h增殖逐渐增加(图3A)。这些结果表明,DPSC-Exos具有减轻SS期间炎症抑制的SGEC增殖的潜力。
RT-qPCR检测不同浓度DPSC-Exos处理SGEC 48 h后内源性AQP5转录水平的变化。IFN-γ组AQP5 mRNA相对表达量显著降低。DPSC-Exos恢复了IFN-γ对AQP5表达的抑制作用(图3B)。在蛋白质印迹分析中,与IFN-γ处理组相比,DPSC-Exos(20 μg/ml)处理组AQP5表达较高(图3C,D)。在免疫荧光分析中,与IFN-γ处理组相比,DPSC-Exos(20 μg/ml)组AQP5的荧光强度显著增加(图3E,F)。这些数据表明,在SS期间,DPSC-Exos具有上调SGEC中AQP5表达的潜力。
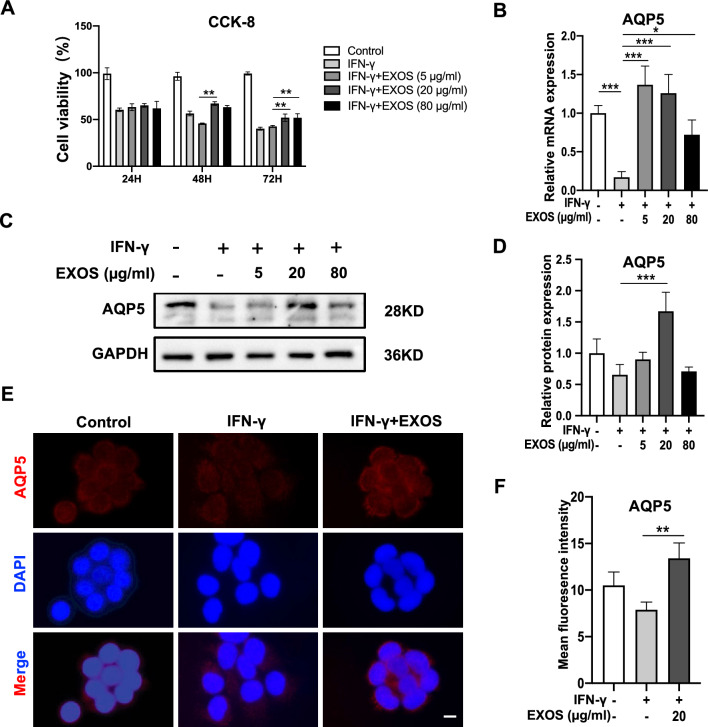
图3 DPSC-Exos挽救了IFN-γ引起的唾液腺上皮细胞(SGEC)死亡和AQP5下调
4. IFN-γ预处理的SGEC和DPSC-Exos的转录组分析
在IFN-γ预处理的SGEC中加入或不加入DPSC-Exos(20 μg/ml)进行RNA测序,以鉴定差异表达基因(DEGs)。首先,主成分分析(PCA)显示了组间数据的独立性,说明数据具有可比性(图4A)。与IFN-γ组相比,DPSC-Exos组共发现304个DEGs,其中142个上调,162个下调。GPER是DPSC-Exos组中上调的DEGs之一(图4B)。根据基因本体(GO)富集分析,GPER在SGEC中的雌激素16-α-羟化酶活性中起作用(图4C)。根据京都基因与基因组百科全书(KEGG)分析,GPER在cAMP信号通路、唾液分泌和雌激素信号通路中起作用(图4D)。DEGs与STRING数据库的交互关系分析显示,唾液分泌、cAMP信号通路、雌激素信号通路之间存在相互作用(图4E)。此外,重叠分析显示GPER是参与这3条信号通路相互作用的关键DEG(图4F)。这些数据表明,DPSC-Exos组过表达的GPER可能在改善SGEC活性中发挥作用。
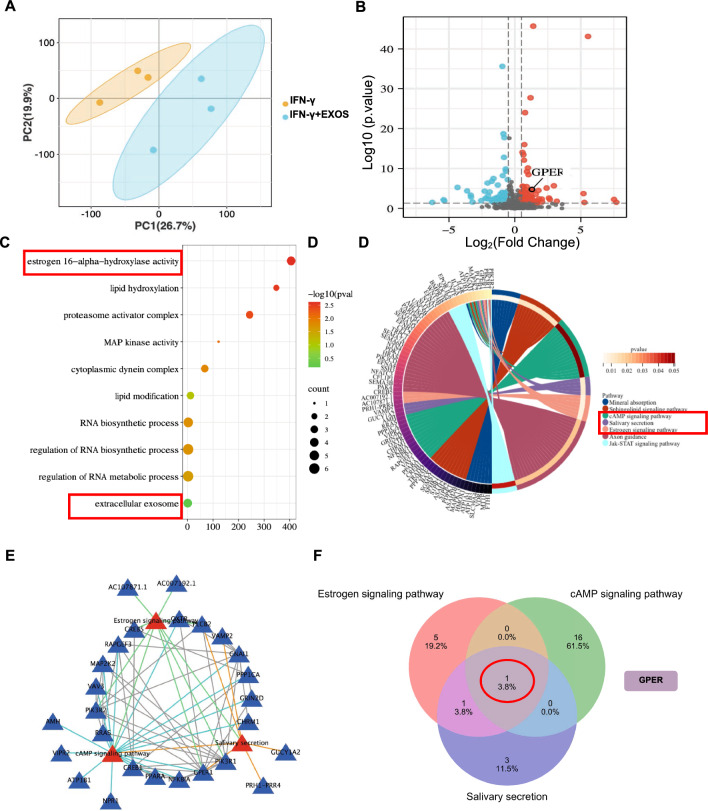
图4 经或不经DPSC-Exos处理的唾液腺上皮细胞的转录组分析
5. DPSC-Exos组GPER表达量较高
热图显示DPSC-Exos处理的SGEC中GPER上调(图5A)。相关热图显示GPER与唾液分泌相关的DEGs密切相关(图5B)。免疫荧光分析显示,IFN-γ组中GPER表达下调,DPSC-Exos恢复了IFN-γ抑制的SGEC中GPER表达(图5C,D)。蛋白质印迹分析分析证实,与IFN-γ组相比,DPSC-Exos组中GPER表达较高(图5E,F)。这些数据表明,DPSC-Exos具有上调IFN-γ处理的SGEC中GPER表达的潜力。

图5 DPSC-Exos诱导唾液腺上皮细胞GPER表达
6. DPSC-Exos治疗减轻了NOD/ltj小鼠的口干症并恢复了唾液腺功能
作者使用NOD/ltj小鼠作为初级SS模型,该模型独特地表现出唾液腺功能障碍,伴有外分泌腺中白细胞浸润的出现和许多已知遗传差异的同源品系。按照图6A中所示进行动物研究。16周龄NOD/ltj小鼠的唾液流率较6周龄NOD/ltj小鼠降低。10周的DPSC-Exos治疗稳健地促进了NOD/ltj小鼠的唾液流率(图6B)。DPSC-Exos治疗对唾液流率的影响甚至比羟氯喹治疗(阳性对照组)更明显。HE染色显示,NOD/ltj小鼠腺管周围腺泡空泡化明显,腺体严重萎缩。与PBS处理的NOD/ltj小鼠相比,在HCQ和DPSC-Exos处理的NOD/ltj小鼠中,唾液腺中淋巴细胞浸润灶的数量和面积显著减少(图6C)。基于DPSC-Exos改善了NOD/ltj小鼠的唾液分泌障碍,作者接下来研究了参与唾液分泌的关键蛋白AQP5和GPER在下颌下腺中的表达。免疫组织化学(图6D,E)显示,与PBS组相比,DPSC-Exos组腺泡细胞膜上的AQP5免疫染色,特别是顶端膜上的AQP5免疫染色强增强。与PBS组相比,DPSC-Exos组的GPER表达也上调(图6F,G)。相反,GPER常在基底膜中着色,这与AQP5免疫染色不同。抗SSA/Ro和抗SSB/La抗体与SS患者较高的发病率相关。因此,对SS的临床诊断具有重要价值。DPSC-Exos和HCQ处理可下调NOD/ltj小鼠的抗SSA/Ro和抗SSB/La血清水平(图6H)。作者进行了蛋白质印迹测定(图6I,J)和RT-qPCR实验(图6K)来检测AQP5在小鼠下颌下腺中的表达水平。与PBS组相比,DPSC-Exos组和HCQ组AQP5的mRNA和蛋白表达水平均上调。这些数据表明,DPSC-Exos可上调下颌下腺中AQP5和GPER的表达。
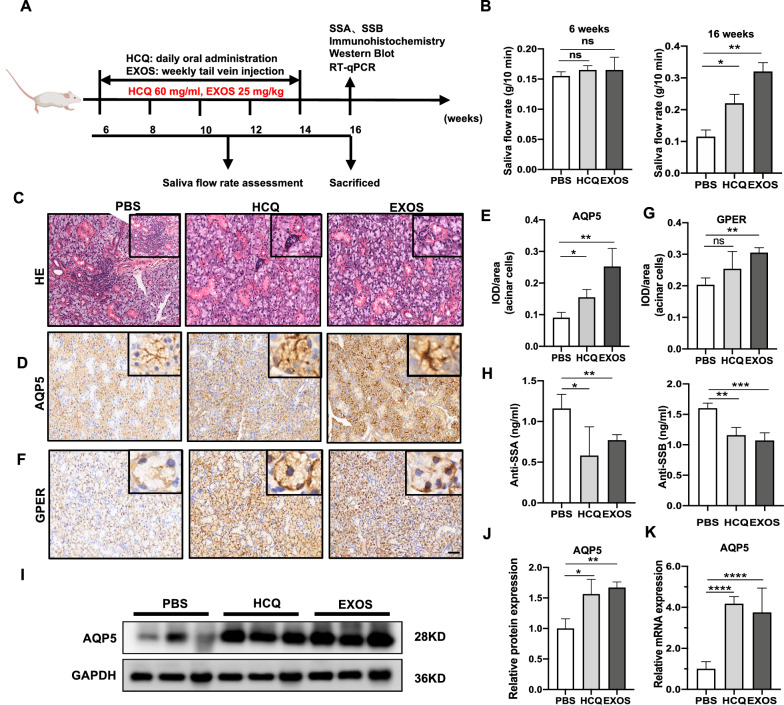
图6 DPSC-Exos治疗减轻了NOD/ltj小鼠的SS样症状
7. DPSC-Exos通过GPER介导的cAMP/PKA/CREB信号通路上调SGEC中AQP5的表达
GPER的激活刺激cAMP的产生和细胞内钙动员。作者分析了不同处理条件下SGEC中cAMP/PKA/CREB信号通路中AQP5、GPER、PKA(p-PKA)和CREB(p-CREB)4种显著蛋白的表达。与IFN-γ组相比,DPSC-Exos组AQP5、GPER、PKA和CREB表达量较高(图7A-E)。这一作用可被G15(GPER抑制剂)消除。不同处理条件下SGEC中cAMP水平的结果与蛋白质印迹分析结果一致(图7F)。AQP5在非刺激条件下存在于脂筏中,当细胞内钙离子浓度升高时,AQP5可以移动到顶端质膜。因此,钙信号是AQP5短期调控的核心信号。流式细胞术结果显示,DPSC-Exos组的细胞内Ca2+水平比IFN-γ组高约4倍,而G15处理消除了DPSC-Exos对细胞内Ca2+水平的影响(图7G)。这些结果表明,DPSC-Exos通过GPER介导的cAMP/PKA/CREB信号通路恢复了IFN-γ对SGEC的抑制功能。

图7 DPSC-Exos通过GPER介导的cAMP-PKA-CREB通路减轻了IFN-γ引起的唾液腺上皮细胞(SGEC)中AQP5的表达下调
结论
DPSC-Exos部分挽救了SS相关的炎症诱导的SGEC死亡。SS相关炎症降低了SGEC中唾液分泌标志物AQP5的表达,而DPSC-Exos逆转了这一作用。DPSC-Exos治疗减轻了NOD/ltj小鼠的腺体炎症并增加了唾液流率。DPSC-Exos处理上调SGEC中的GPER,进一步激活cAMP-PKA-CREB信号通路,促进唾液分泌。该研究结果表明DPSC-Exos可能用于SS治疗。
实验方法
动物实验,免疫组织化学,CCK-8检测,实时定量PCR(RT-qPCR),蛋白质印迹,免疫荧光,mRNA测序,生物信息学分析,酶联免疫吸附测定(ELISA)
参考文献
Hu S, Chen B, Zhou J, Liu F, Mao T, Pathak JL, et al. Dental pulp stem cell-derived exosomes revitalize salivary gland epithelial cell function in NOD mice via the GPER-mediated cAMP/PKA/CREB signaling pathway. J Transl Med. 2023 Jun 3;21(1):361.






