m6A甲基化阅读器IGF2BP2促进肺腺癌血管生成和转移
肺腺癌(LUAD)是一种常见的肺癌类型,具有较高的转移风险,但转移的确切分子机制尚不清楚。我们构建了来自原发性和转移性LUAD的93,610个细胞的总体单细胞景观,发现IGF2BP2在LUAD细胞亚群(称为LUAD_IGF2BP2)和内皮细胞亚群(称为En_IGF2BP2)中都有特异性表达。LUAD_IGF2BP2亚群在转移进化过程中逐渐形成并主导转移性LUAD的生态。IGF2BP2优先由LUAD_IGF2BP2亚群中的外泌体分泌,在肿瘤微环境中被En_IGF2BP2亚群吸收。随后,IGF2BP2通过m6A修饰提高FLT4的RNA稳定性,从而激活PI3K-Akt信号通路,最终促进血管生成和转移。临床数据分析显示,IGF2BP2与LUAD患者较差的总生存期和无复发生存期有关。总的来说,这些发现为原发性和转移性LUAD的多细胞生态系统提供了新的见解,并证明了特定的LUAD_IGF2BP2亚群是促进血管生成和转移的关键协调者,对LUAD转移进化的基因调控机制具有意义,代表它们是潜在的抗血管生成靶点。本文于2023年6月发表于“Molecular Cancer”(IF=37.3)上。
技术路线

结果
1)原发性和转移性LUAD的单细胞景观
在本研究中,CD34的表达被用来表征肿瘤血管生成的病理状态。免疫荧光结果显示,CD34在转移性LUAD中的表达高于原发性LUAD(图1A)。本研究的分析流程如图1B所示。我们从GSE131907数据集中获得了11个远端正常肺组织、11个原发性LUAD组织和4个转移性LUAD组织的scRNA-seq数据,以进一步探索原发性和转移性LUAD的生态图谱。经过数据预处理和质量控制,共捕获93,610个优质单细胞,并将其聚类为19种细胞类型,包括LUAD细胞(LUAD)、内皮细胞(En)、巨噬细胞(Mac)等(图1C)。在细胞簇中阳性表达的标记与近期scRNA-seq和实验室研究等发表的基因特征一致,也与相应细胞的表型特征一致(图1D)。LUAD肿瘤细胞发生多重或低拷贝数事件(图1E)。进一步的分析显示,转移性LUAD代表了一个不同于对照肺和原发性LUAD的多细胞生态系统(图1F)。值得注意的是,在转移性LUAD中观察到LUAD细胞丰度的急剧增加。综上所述,我们通过单细胞分析初步构建了原发性和转移性LUAD的总体单细胞景观,并探索了不同样本类型中细胞生态的改变。

2)转移性LUAD肿瘤细胞的克隆进化轨迹
肿瘤细胞的克隆进化过程往往是肿瘤发展的关键。因此,为了探索转移性LUAD细胞的克隆进化轨迹,我们首先分析了LUAD细胞的类型。值得注意的是,与原发性肿瘤相比,LUAD细胞在转移性LUAD中非常丰富,因此我们对LUAD细胞进行了亚群分析,并构建了单细胞图谱(图2A)。在探索原发性和转移性LUAD中LUAD细胞亚群的细胞生态学中,LUAD_FAM83A和LUAD_IGF2BP2亚群的丰度在转移性LUAD中明显高于原发肿瘤(图2B)。随后在单细胞谱中证实了FAM83A和IGF2BP2的表达(图2C),荧光结果证明IGF2BP2在CD34高表达的LUAD肿瘤中的表达明显高于CD34低表达的LUAD肿瘤(图2D),揭示了IGF2BP2与血管生成之间的密切关系。为了进一步探索潜在的转移分子机制,我们鉴定了原发性和转移性LUAD之间LUAD细胞亚群中的DEGs(图2E)。根据LUAD细胞的拟时间轨迹分析(图2F),确定了从原发性LUAD到转移性LUAD的进化趋势,这表明LUAD细胞亚群从原发性LUAD到自然选择和转移性疾病的潜在结构变化(图2G)。通过功能富集分析,探索了所提出的与时间相关的DEGs所涉及的信号通路和生物学功能。LUAD_IGF2BP2亚群通过囊泡合成和信号分泌显著富集(图2H)。综上所述,本研究推断了转移性LUAD细胞亚群的起源和克隆进化轨迹,鉴定了参与进化过程的基因及其生物学功能。
3)转移性LUAD的内皮细胞景观
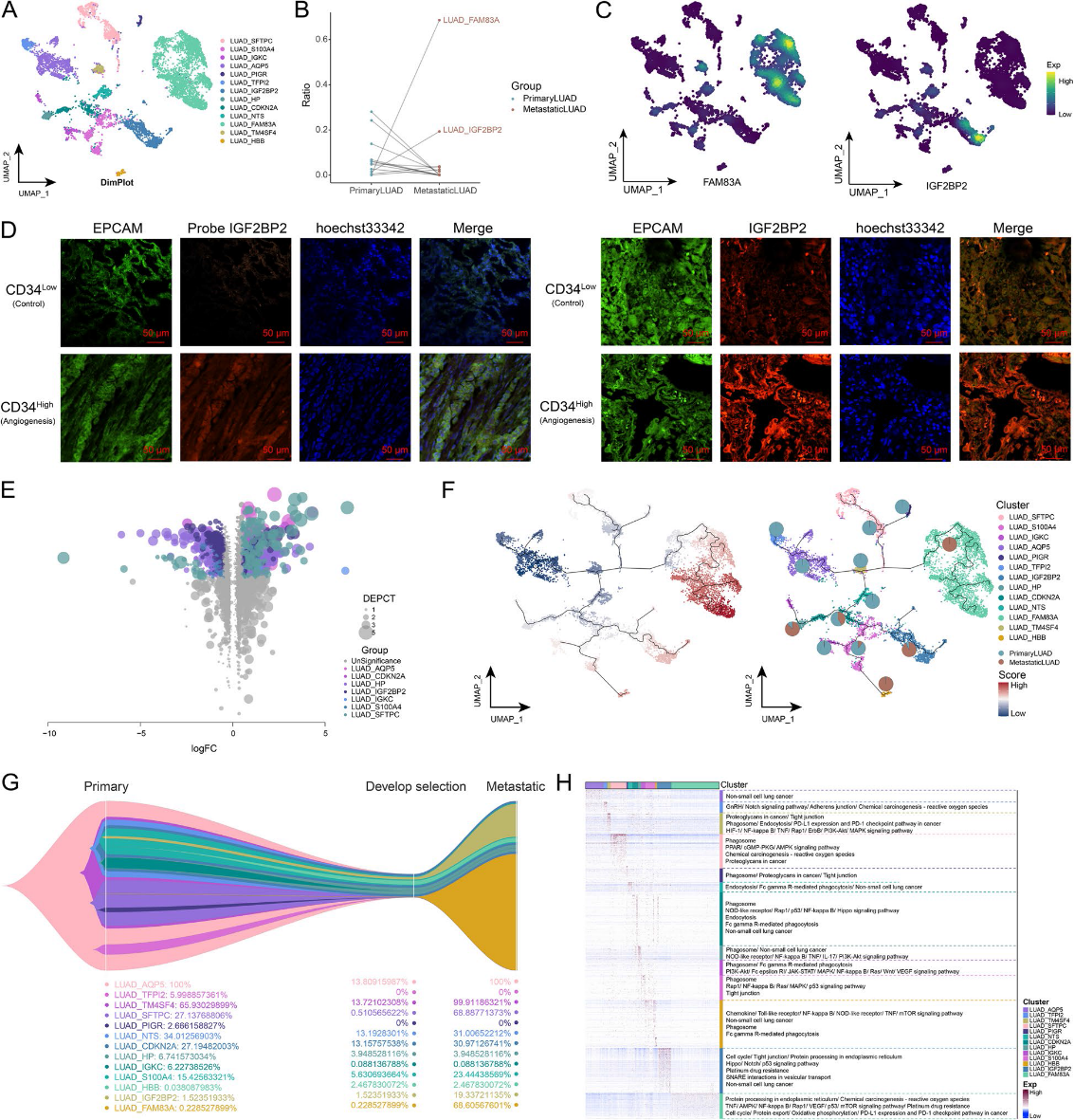
癌症进展的特点是内皮细胞的激活,这反过来又促进了肿瘤血管生成。因此,在单细胞图谱中鉴定了内皮细胞亚群(图3A),并且在原发性和转移性LUAD中观察到每个内皮细胞亚群的独特细胞生态。值得注意的是,在原发性LUAD向转移的过程中,En_S100A9、En_ KRT19和En_IGF2BP2亚群显著增加(图3B)。IGF2BP2在LUAD_IGF2BP2和En_IGF2BP2亚群中同时表达(图3C、D),表明这两个亚群之间存在相互作用。随后,LUAD_IGF2BP2和En_IGF2BP2亚群共享的标记基因被进一步鉴定,包括IGF2BP2、IGF2BP3、SOX4、ID1、WASF2、ADGRG6和FKBP1A(图3E)。富集分析(图3F、G)显示,这些特定的细胞亚群表现出重要的生物功能激活,如内吞作用。进一步的GSEA分析显示,血管生成、外泌体、上皮间质转化(EMT)和m6A在特定细胞亚群中显著富集(图3H)。基于这些发现,我们初步构建了转移性LUAD的内皮细胞景观。
4)靶向IGF2BP2可减轻LUAD细胞的迁移、侵袭和血管生成
接下来,我们研究了IGF2BP2对LUAD细胞生物学行为的影响。为了实现瞬时转染,我们设计了3种靶向IGF2BP2的特异性siRNA,其中si-IGF2BP2#1对A549和NCI-H1299细胞的干扰效果最佳(图4A-C)。根据伤口愈合实验,si-IGF2BP2显著降低了A549和NCI-H1299细胞的迁移(图4D-F)。此外,我们的transwell实验结果表明,si-IGF2BP2显著抑制A549和NCI-H1299细胞的侵袭(图4G, H)。将si-IGF2BP2转染的A549细胞的条件培养基培养HUVECs后,分支点和毛细血管长度都显著减弱(图4I-K),表明LUAD细胞中IGF2BP2的下调抑制了血管生成。

5)LUAD细胞来源的外泌体介导IGF2BP2转移到微环境内皮细胞,激活PI3K-Akt信号,促进血管生成
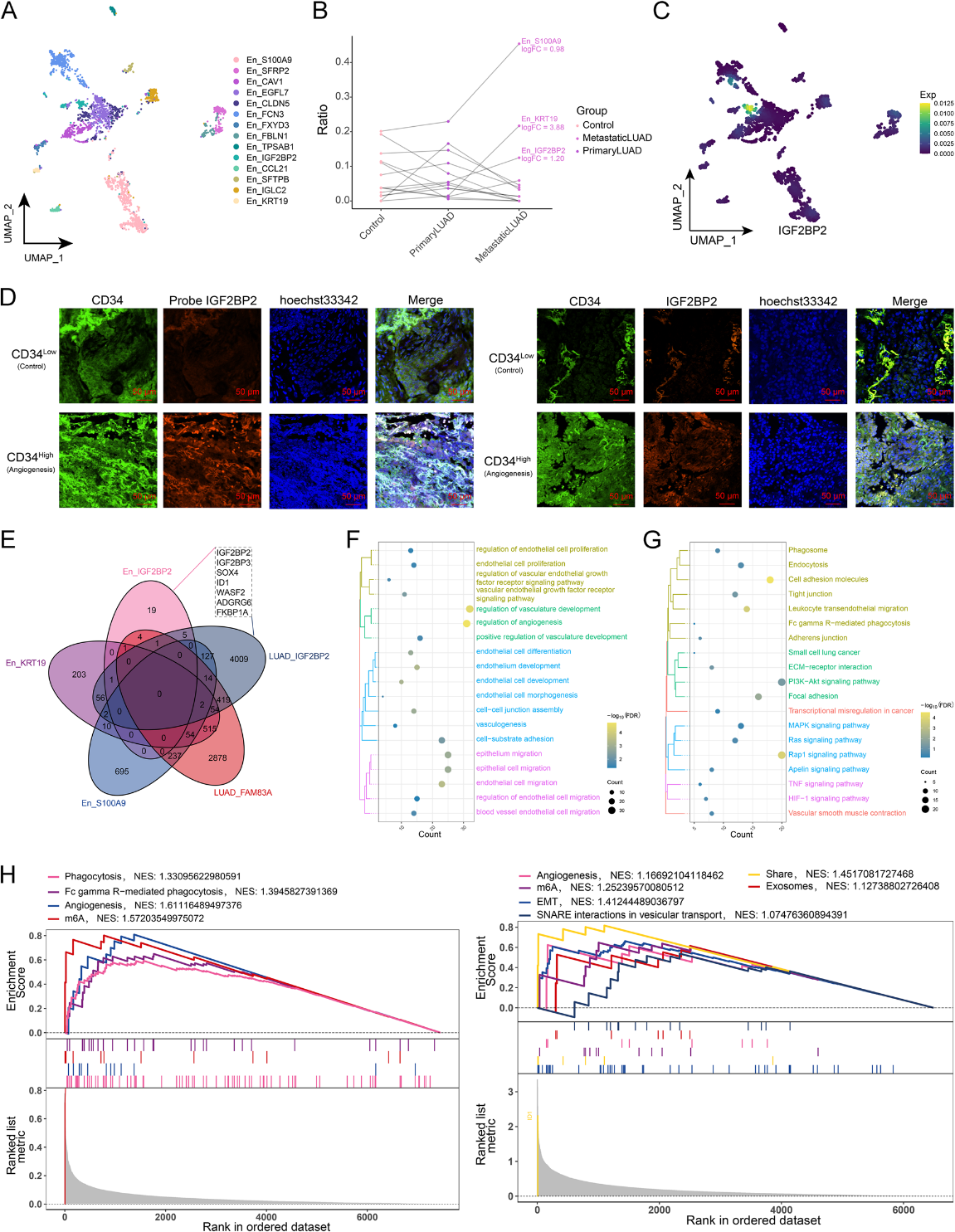
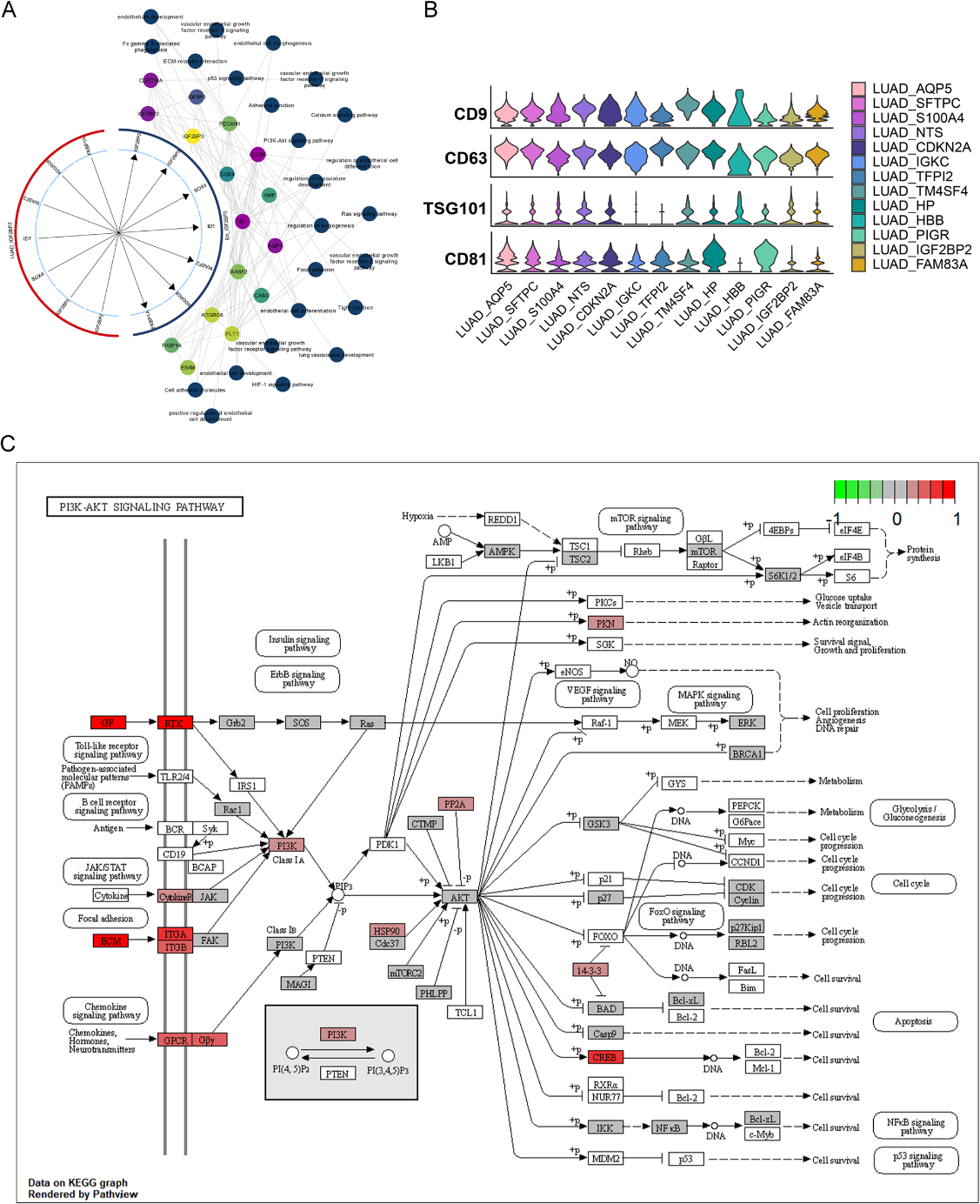
我们的上述研究表明转移性LUAD可能通过外泌体实现血管生成。因此,为了研究LUAD细胞源性外泌体在肿瘤微环境中向内皮细胞转移的机制,我们构建了血管生成特异性生态型的总体调控格局,并获得了从LUAD_IGF2BP2到En_IGF2BP2亚群的综合调控网络(图5A)。随后,外泌体标记基因(CD9、CD63、TSG01和CD81)均在所有LUAD亚群中高表达。证实了LUAD细胞中外泌体的形成(图5B)。结合IGF2BP2在LUAD_IGF2BP2和En_IGF2BP2亚群中的表达,推断LUAD细胞来源的外泌体IGF2BP2细胞内化进入内皮细胞。此外,研究发现,在En_IGF2BP2亚群中激活了LUAD血管生成和转移的PI3K-Akt信号通路(图5C)。这些结果表明LUAD细胞可能将外泌体IGF2BP2传递给内皮细胞,激活PI3K-Akt信号,最终促进血管生成。
6)IGF2BP2介导FLT4的m6A修饰,激活PI3K-Akt信号通路
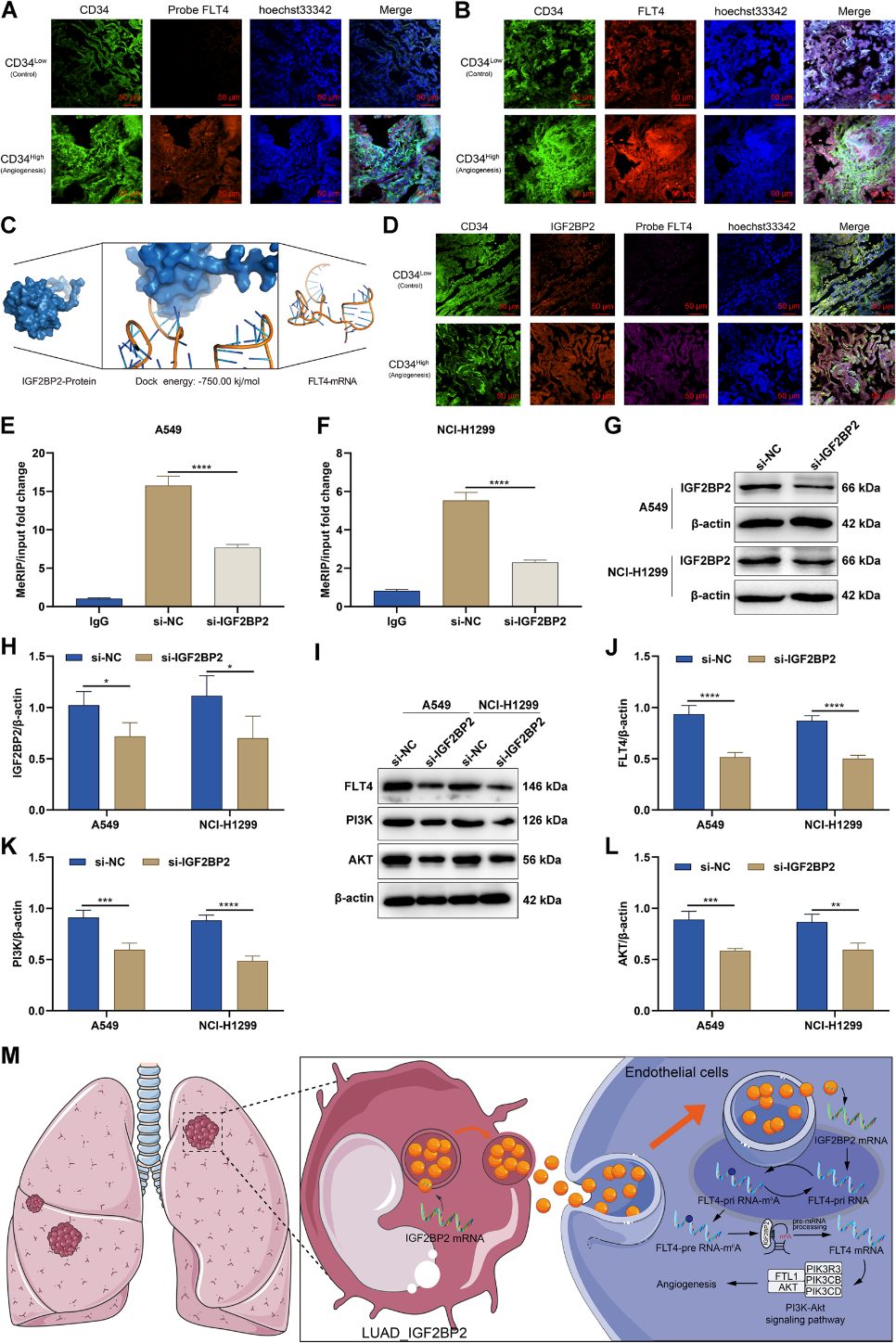
我们进一步探讨IGF2BP2如何激活PI3K-Akt信号从而促进血管生成。FLT4被确定为IGF2BP2可能靶向激活PI3K-Akt信号通路的基因。免疫荧光实验显示,CD34高表达的LUAD样本局灶内皮细胞中FLT4的RNA水平(图6A)和蛋白水平(图6B)明显高于CD34低表达的LUAD样本。通过分子对接预测了IGF2BP2蛋白与FLT4 mRNA的结合潜力,对接能量为-750 kj/mol,表明两者之间有很大的靶向结合潜力(图6C)。多重免疫荧光也显示了FLT4 RNA与IGF2BP2蛋白的共表达(图6D)。IGF2BP2的敲低显著降低了A549和NCI-H1299细胞中FLT4的m6A水平(图6E, F)。在IGF2BP2敲除的A549和NCI-H1299细胞中,FLT4蛋白水平显著下调(图6G-J)。这说明IGF2BP2可以通过介导FLT4的m6A修饰而上调FLT4的表达。此外,IGF2BP2敲低的A549和NCI-H1299细胞中PI3K和AKT蛋白水平显著降低(图6K, L),表明IGF2BP2参与了PI3K-AKT信号通路的激活。这些结果表明,在转移性LUAD的克隆进化过程中,IGF2BP2过表达的LUAD细胞亚群将IGF2BP2扩散到肿瘤微环境中,并通过细胞内化被内皮细胞吸收,进而通过m6A修饰增强FLT4的RNA稳定性,从而激活PI3K-Akt信号通路,促进血管生成(图6M)。
7)基于IGF2BP2的LUAD预后评分系统的构建
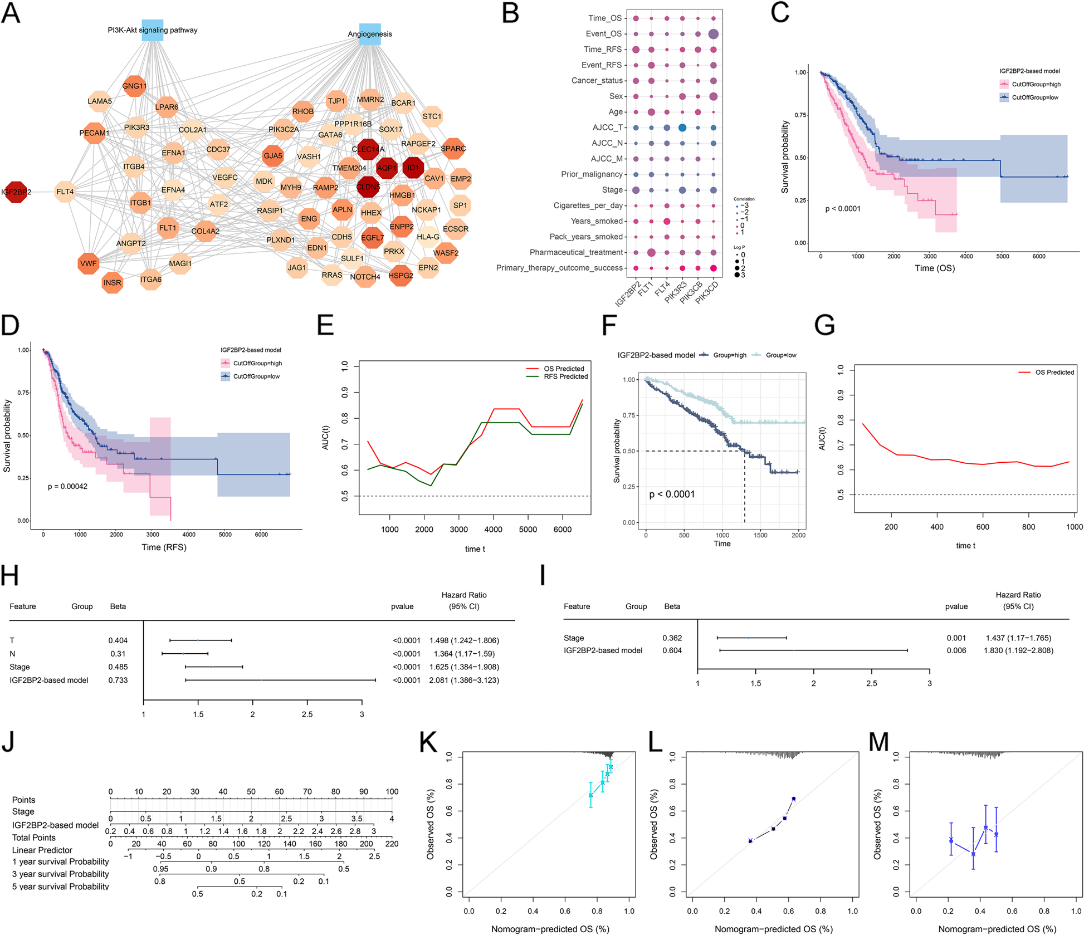
我们进一步构建了IGF2BP2-FLT4-PI3K-Akt信号通路-血管生成的总体调控网络(图7A)。然后评估这些网络基因预测LUAD预后的潜力。在TCGA-LUAD数据集中探讨了关键网络基因与临床指标的相关性,发现它们与临床参数,特别是OS和无复发生存率(RFS)显著相关(图7B)。基于关键网络基因(包括IGF2BP2、FLT1、FLT4、PIK3R3、PIK3CB和PIK3CD),建立了基于IGF2BP2的多变量cox回归模型,即基于IGF2BP2的预后评分系统。并根据中位值将患者分为低、高分组。生存分析显示,低评分组的OS和RFS结果明显优于高评分组(图7C, D)。时间无关的ROC曲线显示了该模型在预测OS和RFS方面的出色性能(图7E)。基于IGF2BP2的预后评分系统在外部验证数据集(GSE72094)中得到了验证(图7F, G)。结合单变量和多变量cox回归分析,发现基于IGF2BP2的模型和分期是LUAD预后的独立危险因素(图H, I)。我们建立了包含两个独立危险因素的nomogram(图7J)。校准曲线表明,nomogram可以准确预测1年、3年和5年的OS结果(图7K-M)。这些结果表明IGF2BP2-FLT4-PI3K-Akt信号-血管生成网络在LUAD预后中起着至关重要的作用,为LUAD患者的准确风险分层提供了理论依据。
结论
本研究通过单细胞转录组学分析构建了原发性和转移性LUAD的总体单细胞格局,揭示了基于IGF2BP2的LUAD血管生成和转移机制,为阐明LUAD转移的相关细胞动力学和分子特征提供了机会。
实验方法
免疫荧光,原位杂交,单细胞测序分析,RT‑qPCR,伤口愈合试验,transwell,管形成实验,MeRIP‑qPCR,WB。
参考文献
Fang H, Sun Q, Zhou J, Zhang H, Song Q, Zhang H, Yu G, Guo Y, Huang C, Mou Y, Jia C, Song Y, Liu A, Song K, Lu C, Tian R, Wei S, Yang D, Chen Y, Li T, Wang K, Yu Y, Lv Y, Mo K, Sun P, Yu X, Song X. m6A methylation reader IGF2BP2 activates endothelial cells to promote angiogenesis and metastasis of lung adenocarcinoma. Mol Cancer. 2023 Jun 23;22(1):99. doi: 10.1186/s12943-023-01791-1.






