B4GALT1通过多水平调控PD-L1的表达来促进肺腺癌的免疫逃逸

随着肺癌筛查的普及和计算机断层扫描在临床实践中的应用,检出的肺结节数量明显增加,其中许多为原位腺癌(AIS)、微浸润性腺癌(MIA)和浸润性腺癌(IAC)。手术切除后,AIS和MIA的5年生存率均接近100%,而IAC则没有如此好的生存获益。多个专业学会修订了肺腺癌(LUAD)及其癌前病变的分类,包括从不典型腺瘤样增生(AAH)到AIS、MIA和最终IAC的逐步进化谱。之前的研究描述了AIS、MIA和IAC的基因组、免疫和代谢情况,这可能有助于早期癌症的检测和预防。然而,对于早期肺腺癌从MIA到IAC的发展轨迹,仍然缺乏深入的分子事件。多原发肺癌(MPLC)是指同一患者存在多个独立来源的肿瘤,常以多个肺结节的形式出现,多为MIA或IAC。同一肿瘤龛内不同病灶的比较可以排除患者遗传背景差异造成的偏倚,从而更深入地了解MIA向AIS进展过程中肿瘤内部的分子改变。β-1,4-半乳糖基转移酶1(B4GALT1),一个与N-糖合成相关的基因,在早期肺腺癌的进展中至关重要。N-糖基化模式有助于许多致癌蛋白的稳定性和活性,从而促进癌症进展。B4GALT1通过将β-1,4链半乳糖转移到受体糖,参与N-糖基化的形成,越来越多的证据表明该蛋白与肿瘤的生物学和进展相关。然而,B4GALT1在肺癌中的作用及其潜在的分子机制尚不清楚。该研究发表在《Journal of Experimental & Clinical Cancer Research》,IF:11.3。
技术路线

主要研究结果
1. B4GALT1是早期肺腺癌发生的关键因子
作者收集了4例MPLC患者的8例LUAD样本,图1A总结了其影像组学特征和临床病理特征。每例患者的两个原发肿瘤病理类型不同,MIA或IAC。然后,作者进行了RNA测序,以探索驱动这些样本中侵袭前LUAD进展为侵袭性LUAD的关键分子事件(图1B)。随后,作者利用UMAP对RNA测序数据进行了无监督聚类,发现了与这4例患者的MIA和IAC病变完全对应的两个聚类(图1C),提示MIA和IAC具有不同的转录特征。GO和KEGG分析显示,IAC中高表达的基因显著富集于葡萄糖代谢通路(图1D)。此外,随着β-1,4-半乳糖基转移酶活性信号通路的富集,N-糖的生物合成也被发现,表明糖基化在早期肺癌的发展中起关键作用。作为糖基化的一种类型,N-糖基化模式可以调节蛋白质的稳定性,而β-1,4-半乳糖基转移酶是参与N-糖基生物合成的关键酶。B4GALT1,一个编码β-1,4-半乳糖基转移酶的基因,是IAC样本中上调最显著的基因。因此,作者推测B4GALT1可能在早期肺腺癌MIA向IAC演变过程中发挥关键作用。对TCGA-LUAD数据的进一步分析表明,B4GALT1 mRNA表达确实在早期LUAD中随着分期增加而增加,但在晚期LUAD中没有(图1E)。此外,GSE166720数据集根据病理分级将53例早期肺腺癌分为惰性(AIS和MIA)和浸润性肿瘤(IAC),结果显示侵袭性肿瘤中的B4GALT1 mRNA表达高于惰性肿瘤(图1F)。此外,B4GALT1高表达预测TCGA-LUAD患者较差的DFS和OS(图1G-H)。在GSE31210数据集的I期和II期LUAD患者中,高B4GALT1也预示着较差的OS(图1I)。综上所述,B4GALT1可能在早期肺腺癌的发生发展中起重要作用。
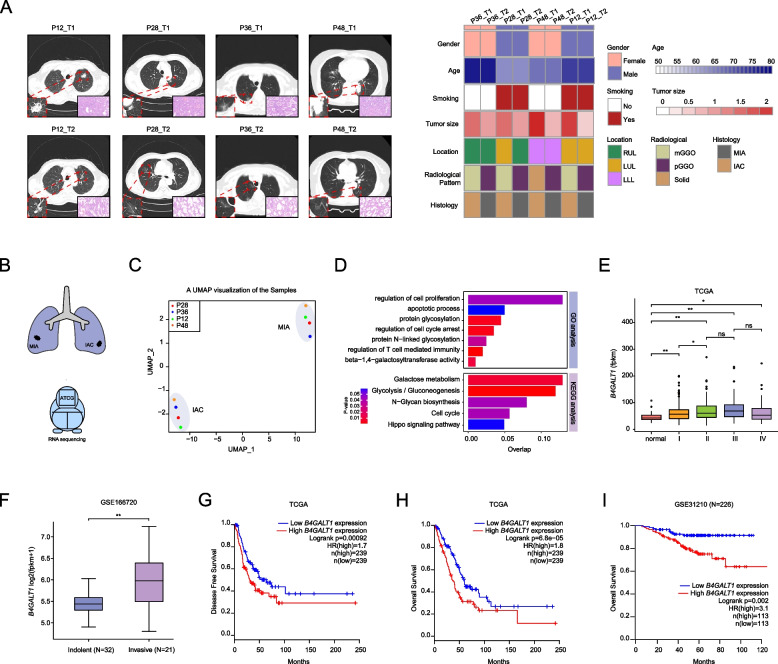
图1 B4GALT1是早期肺腺癌发生的关键因子
2. B4GALT1在体内外调控肺腺癌细胞的增殖和转移
通过MTT实验、克隆形成实验和EdU实验验证B4GALT1对细胞增殖的影响。MTT结果显示,B4GALT1敲低后细胞活力明显下降。相反,B4GALT1过表达增加了细胞活力(图2A)。同样,EdU实验显示B4GALT1对LUAD细胞增殖有显著影响(图2B)。集落形成实验表明B4GALT1表达对克隆形成能力也有影响(图2C)。此外,B4GALT1敲低显著诱导LUAD细胞凋亡(图2D)。然后,作者确定B4GALT1是否通过改变细胞周期影响LUAD细胞增殖。流式细胞术结果显示,B4GALT1敲低伴随着G1/G0期的细胞周期阻滞(图2E)。
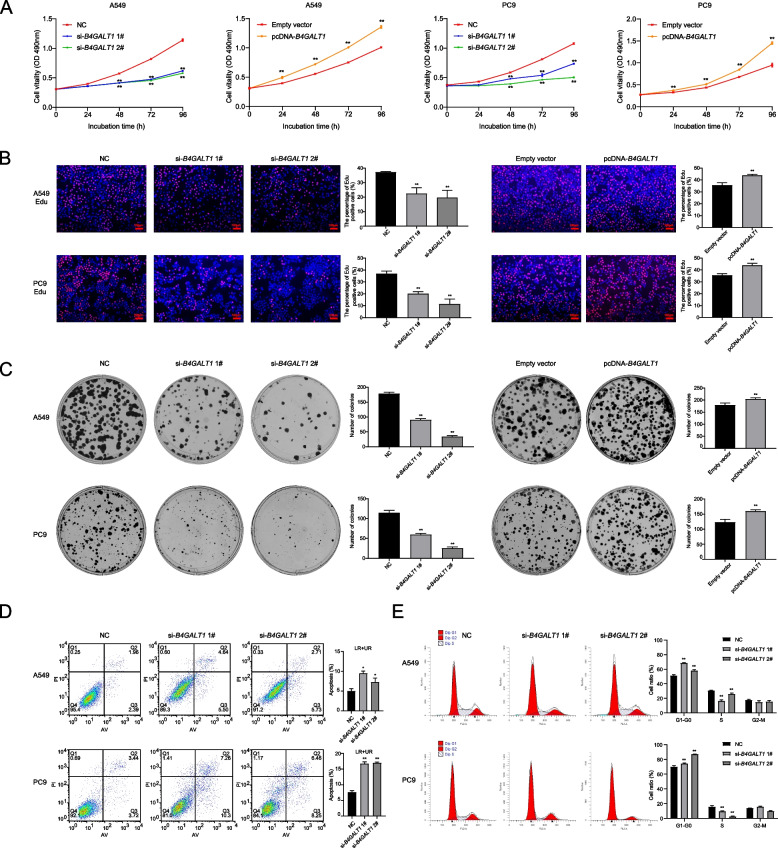
图2 B4GALT1在体内外调节肺腺癌细胞的增殖
接下来,作者检测了B4GALT1对细胞迁移和侵袭的潜在影响。在伤口愈合试验中,B4GALT1表达显著损害了伤口闭合(图3A)。Transwell实验也表明B4GALT1的敲低阻碍了肿瘤的迁移。相反,B4GALT1过表达显著促进细胞迁移(图3B)。此外,B4GALT1敲低抑制了LUAD细胞通过基质侵袭,而B4GALT1过表达促进了LUAD细胞的侵袭(图3C)。
作者将A549细胞注射到BALB/c裸鼠皮下,以确定B4GALT1是否影响体内LUAD肿瘤的生长。B4GALT1敲低组的肿瘤体积较对照组明显减小。在实验终点,B4GALT1敲低组的肿瘤平均重量显著低于对照组(图3D)。此外,Ki67染色显示,在B4GALT1敲低形成的肿瘤中,Ki67阳性细胞的比例降低(图3E)。
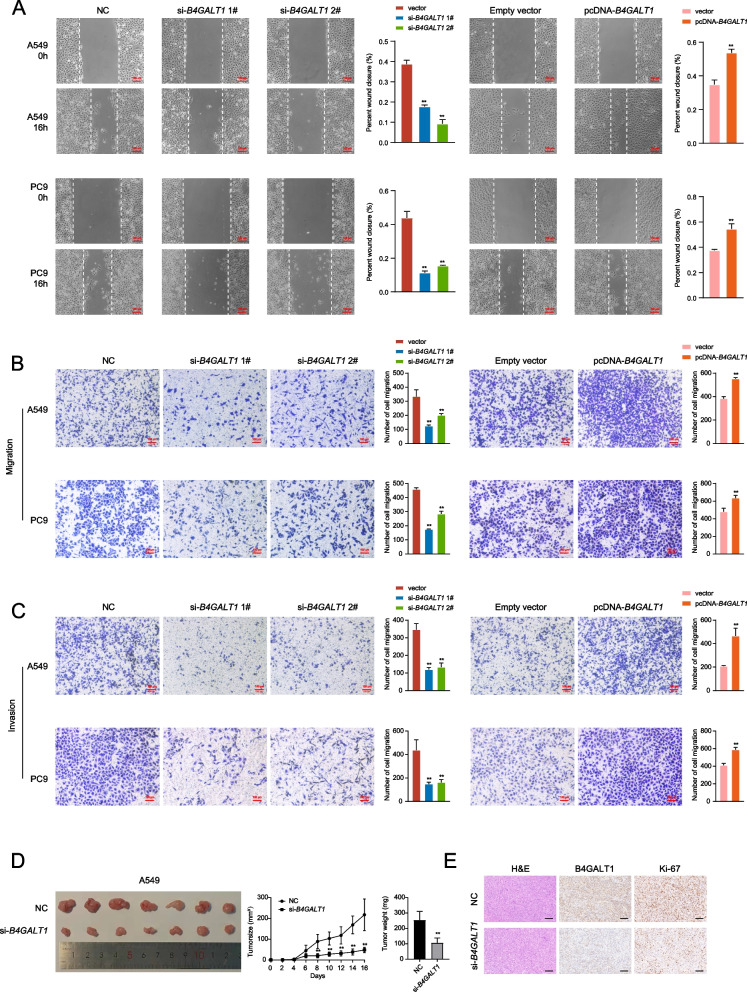
图3 B4GALT1调控肺腺癌细胞的迁移和侵袭
3. B4GALT1限制了CD8+T细胞的浸润和活性
通过对IAC中高表达基因的GO分析,作者还发现了与T细胞免疫应答相关功能的基因的富集(图1D)。既往研究报道,在从MIA到IAC的LUAD进展过程中,免疫抑制增强。因此,作者应用CIBERSORT算法来估计MIA和IAC肿瘤中免疫细胞的相对丰度。作者发现,与MIA相比,IAC的CD8+T细胞浸润较少(图4A)。随后的免疫荧光染色分析也表明,IAC肿瘤中的CD8+T细胞比MIA肿瘤中的少(图4B)。关键CD8+T细胞效应分子GZMB的免疫组织化学染色显示,IAC肿瘤的GZMB水平较低,表明IAC肿瘤中CD8+T细胞的活性减弱(图4C)。为了确定B4GALT1是否引起了这种免疫状态的改变,作者对这些样本进行了BGALT1的免疫组织化学染色(图4D),发现B4GALT1的水平与CD8 +T细胞的数量之间存在明显的负相关,GZMB的水平也存在明显的负相关(图4E)。
为了确定B4GALT1是否为功能失调T细胞的重要调节因子,作者研究了在小鼠癌细胞与特异性靶向癌细胞抗原的小鼠原代T细胞共培养的背景下,公开可用的规律成簇的分散短回文重复序列(CRISPR)筛查的数据。基于5个独立研究中的9个这样的筛选,作者发现靶向B4GALT1的gRNAs一致被负向选择(图4F)。这些结果表明,B4GALT1可能导致CD8+T细胞功能障碍,并可能使肺腺癌细胞在失活时更容易受到CD8+T细胞介导的细胞毒性。为了进一步验证这一结论,作者进行了T细胞介导的肿瘤细胞杀伤试验,以测试B4GALT1表达对CD8+T细胞活性的影响,CD8+T细胞活性是从健康供者的外周血和C57BL/6小鼠的脾脏中分离出来的(图4G)。正如预期,B4GALT1抑制显著增强了CD8+T细胞介导的LUAD细胞死亡,并且在A549和LLC细胞系中,B4GALT1上调使LUAD细胞对CD8+T细胞更具抗性(图4H)。
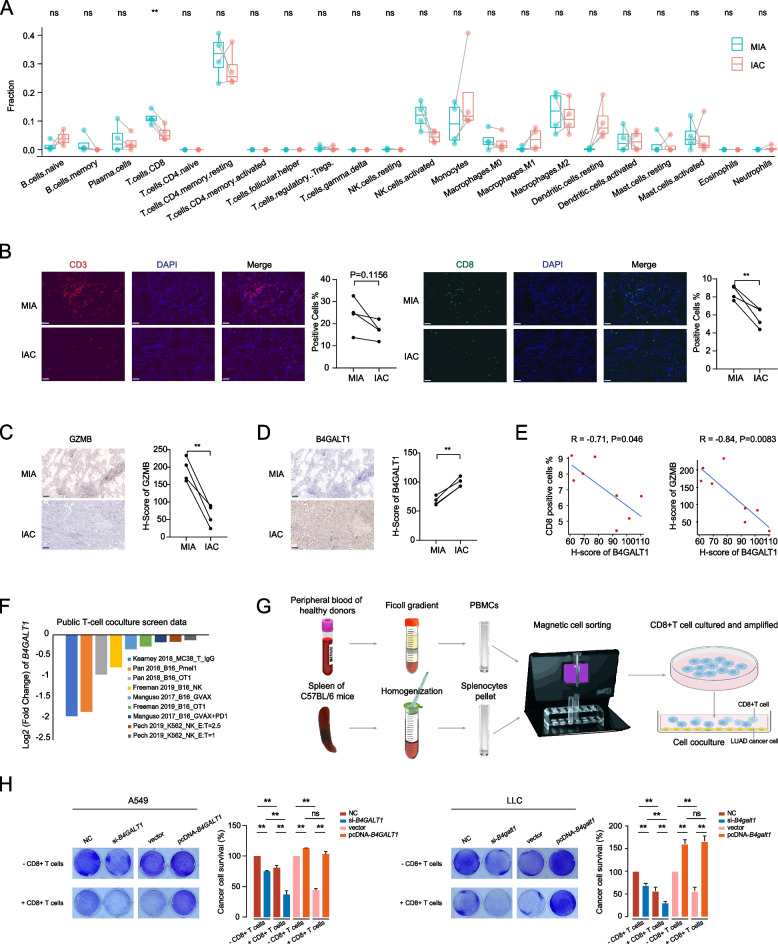
图4 B4GALT1限制了CD8+T细胞的浸润和活性
4. B4GALT1与PD-L1相互作用并通过介导其糖基化增强PD-L1蛋白稳定性,从而促进肺腺癌的免疫逃逸
越来越多的证据表明,免疫抑制与免疫检查点的失调有关。因此,作者在B4GALT1高表达和低表达的肿瘤之间比较了著名的免疫检查点分子的表达水平(图5A)。值得注意的是,CD274(PD-L1)在B4GALT1高表达的肿瘤中比在B4GALT1低表达的肿瘤中表达最显著。在A549和LLC细胞中,敲低或过表达B4GALT1均可引起PD-L1 mRNA和蛋白水平的降低或升高(图5B-C)。因此,作者有理由假设B4GALT1通过影响肺腺癌中PD-L1的表达来介导CD8+T细胞功能障碍。在过表达B4GALT1的LUAD细胞中,敲低CD274可恢复CD8+T细胞杀伤能力,这证实了这一推测(图5D)。
接下来,作者研究了B4GALT1如何影响PD-L1水平。B4GALT1是参与N-糖基生物合成的关键基因,参与N-糖基化的形成。因此,作者推测N-糖基化可能通过涉及翻译后修饰的机制参与B4GALT1介导的PD-L1调控。首先,在CHX处理后,作者发现B4GALT1敲除降低了A549和LLC细胞中PD-L1蛋白的半衰期,而B4GALT1稳定表达显著增加了PD-L1蛋白的稳定性(图5E)。此外,co-IP验证了B4GALT1与PD-L1之间的相互作用(图5F)。为了在生物化学上证实两者的相互作用,作者表达并纯化了含有B4GALT1的GST融合蛋白,并进行了GST pull down实验。结果表明,GST-B4GALT1可以下调A549细胞裂解液中的PD-L1(图5G)。然后,作者试图研究B4GALT1是否通过N-连接糖基化来调节PD-L1蛋白。用衣霉素(N-连锁糖基化抑制剂)处理A549和LLC细胞,与未处理细胞相比,PD-L1表达显著下调,与B4GALT1敲低一致。此外,衣霉素恢复了B4GALT1过表达诱导的PD-L1表达(图5H)。为了进一步鉴定PD-L1的N-连接糖基化位点,作者首先使用NetNGlyc 1.0服务器工具预测了PD-L1的N-连接糖基化基序。然后,使用flag标记的质粒转染B4GALT1过表达细胞,这些质粒携带PD-L1的全长编码序列,或者含有N35、N192或N200处突变的N-连锁糖基化位点的编码序列,用于CHX分析(图5I)。结果显示,即使在B4GALT1过表达的情况下,突变N192和N200的N-糖基化位点也显著降低了PD-L1蛋白的稳定性,提示这些残基是B4GALT1修饰的PD-L1的N-糖基化位点。综上所述,B4GALT1通过介导PD-L1的糖基化与PD-L1相互作用,从而促进肺腺癌的免疫逃逸。
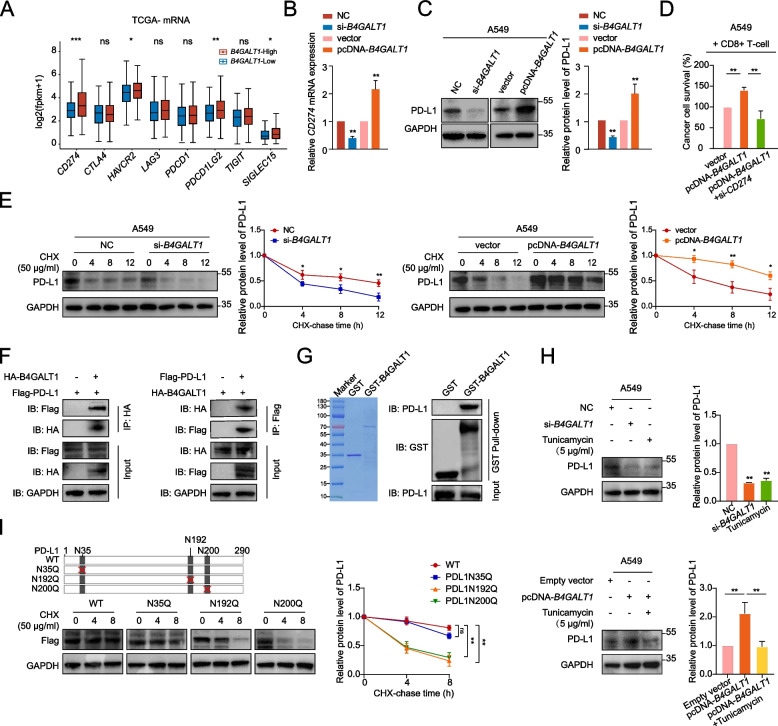
图5 B4GALT1与PD-L1相互作用并通过介导其糖基化增强PD-L1蛋白稳定性,从而促进早期肺腺癌的免疫逃逸
5. B4GALT1通过调控TAZ糖基化促进PD-L1转录
以上数据表明,B4GALT1可以增强PD-L1蛋白的稳定性。此外,作者注意到B4GALT1敲低或过表达后CD274 mRNA的变化(图5B)。这些结果表明,B4GALT1也可能对CD274有转录作用。为了验证这一假设,作者进行了荧光素酶报告基因检测,结果显示B4GALT1过表达增强了CD274启动子活性(图6A)。此外,有趣的是,作者发现IAC肿瘤中高表达的基因在Hippo信号通路中富集(图1D)。在之前的研究中,作者发现Hippo信号通路中一个重要的转录因子——含WW结构域的转录调节因子1(TAZ)可以通过增加CD274启动子的活性来诱导PD-L1的上调。在本研究中,作者还验证了TAZ在肺腺癌中对CD274的调控作用。TAZ敲低导致A549和LLC细胞中CD274 mRNA和蛋白表达水平显著降低(图6B-C)。进一步的报告基因分析表明,TAZ敲低降低了全长CD274启动子的活性,但对缺失区域的启动子结构无影响(图6D)。重要的是,B4GALT1过表达不影响带有缺失区域的CD274启动子结构的活性,表明B4GALT1通过TAZ影响CD274启动子的活性(图6E)。此外,TAZ敲低显著降低了B4GALT1诱导的全长CD274启动子活性和CD274 mRNA水平的增加(图6F-G),表明B4GALT1通过TAZ介导了CD274的转录调控。此外,TAZ敲低逆转了B4GALT1诱导的PD-L1蛋白水平(图6H)。
作者进一步探索了B4GALT1影响TAZ水平的机制。通过对TCGA和GEO数据集的分析,作者观察到B4GALT1的表达在蛋白水平而不是mRNA水平与TAZ水平显著相关,这与qRT-PCR和WB结果一致(图6I-J)。因此,作者怀疑TAZ蛋白可能通过获得N-糖基修饰而在翻译后水平受到B4GALT1的调节。通过CHX分析,作者发现B4GALT1可以增加TAZ蛋白的稳定性(图6K)。此外,co-IP(图6L)和GST pull-down实验(图6M)表明B4GALT1直接与TAZ相互作用。此外,在B4GALT1过表达细胞中,衣霉素处理后TAZ蛋白水平显著降低(图6N),表明TAZ的N-连接糖基化受B4GALT1调节。然后,作者应用NetNGlyc 1.0服务器工具预测TAZ的潜在N-连接糖基化位点,并突变N184和N256位点(图6O)。CHX分析结果表明,B4GALT1过表达不能促进TAZ蛋白稳定性,但N256位点发生了突变,提示N256是B4GALT1修饰的TAZ的N-糖基化位点。
这些结果表明,B4GALT1/TAZ介导了PD-L1的翻译修饰。

图6 B4GALT1通过调控TAZ糖基化促进PD-L1转录
6. 抑制B4GALT1可增强抗PD-1治疗LUAD的疗效
为了评估B4GALT1在体内的免疫调节作用,作者使用LLC小鼠LUAD细胞系在免疫正常的C57BL/6小鼠中构建皮下异种移植瘤,然后使用PD-1 mAb或IgG同型CTRL(IgG2a)处理移植瘤(图7A)。作者发现,与对照组相比,B4GALT1敲低限制了肿瘤生长,这与PD-1单抗治疗一致。此外,与其他组相比,B4GALT1抑制和PD-1阻断联合治疗组的肿瘤负荷下降最显著,且未观察到体重减轻和其他常见毒性作用(图7B-F)。在治疗结束时收集肿瘤样本进行进一步分析,免疫组织化学染色和流式细胞术分析表明,B4GALT1缺陷显著降低了PD-L1水平,增加了CD8+T细胞和CD8+GZMB+细胞密度(图7G-H)。特别是,PD-1 mAb和B4GALT1抑制联合治疗导致了肿瘤区域中活化CD8+T细胞的最显著富集(图7H)。这些结果证实抑制B4GALT1通过下调PD-L1表达增强CD8+T细胞浸润和功能,从而提高抗PD-1治疗的疗效。综上所述,这些结果表明B4GALT1通过上调PD-L1表达和抑制CD8+T细胞浸润促进肿瘤免疫逃逸。
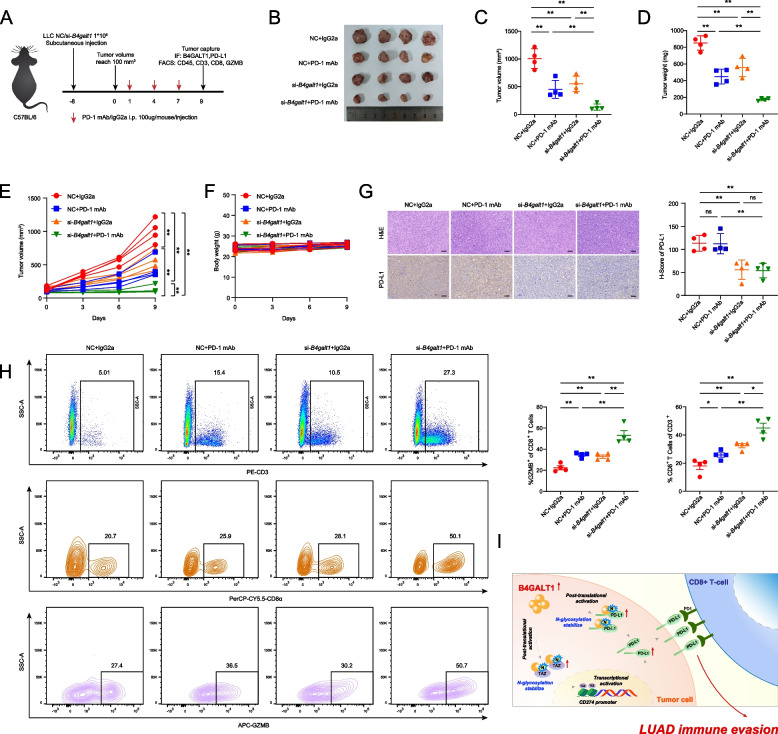
图7 抑制B4GALT1可增强抗PD-1治疗LUAD的疗效
结论
基于独特的MPLC模型,作者揭示了B4GALT1促进了早期LUAD的免疫逃避和肿瘤发生,并确定了B4GALT1在转录水平通过稳定TAZ蛋白调节PD-L1,在翻译后水平直接通过PD-L1的N-连接糖基化蛋白修饰来调节PD-L1的新机制。该研究为将B4GALT1作为LUAD的潜在治疗靶点提供了一定的理论基础。
实验方法
RNA测序,qRT-PCR,蛋白质印迹,MTT增殖测定,菌落形成测定,细胞迁移和侵袭测定,流式细胞术,动物实验,免疫组织化学(IHC),免疫荧光,免疫共沉淀,GST pull-down,双荧光素酶报告基因检测
参考文献
Cui Y, Li J, Zhang P, Yin D, Wang Z, Dai J, et al. B4GALT1 promotes immune escape by regulating the expression of PD-L1 at multiple levels in lung adenocarcinoma. J Exp Clin Cancer Res. 2023 Jun 12;42(1):146.






