HBV感染患者的肝脏和血液免疫细胞景观
HBV感染的综合免疫景观是实现HBV治愈的关键,但目前尚未完全了解HBV感染患者的免疫特征。本文对23个人的46个配对肝脏和血液样本的243 000个细胞进行了单细胞RNA测序,其中包括6个免疫耐受者、5个免疫活性者(IA)、3个急性恢复者(AR)、3个慢性解决者和6个无HBV健康对照者(HC)。流式细胞仪和组织学检测被应用于第二个HBV队列进行验证。基于此,作者剖析了不同HBV感染阶段的协调免疫反应,为全面了解免疫发病机制和开发有效的治疗策略提供了丰富的资源。本文于2023年1月发表在《Gut》IF:24.5期刊上。
技术路线

主要实验结果
1、HBV感染患者的单细胞免疫景观
为更好地了解HBV感染者内部和之间的异质性,应用scRNA-seq来描述IT、IA、AR和CR期个体的肝内免疫细胞以及外周血单核细胞(PBMCs)的转录组状态(图1A)。作为对照,对从肝移植捐赠者(HCs)那里获得的外周血和正常肝脏组织进行分析。详细的临床和病理信息,包括HBV诊断以来的时间、HBsAg水平、HBV DNA水平、ALT和AST,见表1。
经过质量控制和过滤,获得了23个人的243 000个单细胞的转录组。确定了八个主要的细胞集群,包括CD4+T细胞(CD3D+CD4+)、CD8+T细胞(CD3D+CD8A+)、γδT细胞(CD3D+TRDC+)、NKT样细胞(CD3E+KLRF1+)、NK细胞(GNLY+NKG7+)、B细胞(MZB1+CD79A+)、浆B细胞(MZB1+CD38+)和骨髓细胞(LYZ+CD14+)(图1B)。总共确定了10个CD4+T细胞亚群,12个CD8+T细胞亚群,9个γδT细胞亚群,1个NKT样细胞亚群,7个NK细胞亚群,7个B细胞亚群,3个浆B细胞亚群和11个髓细胞亚群(图1B)。根据前排10差异表达基因(DEGs),确定了60个集群中每个集群的独特标志物(图1C)。
这些细胞群显示出不同的组织来源和在疾病阶段的富集(图1D)。为研究不同疾病阶段的独特的免疫谱,分析了每个人的免疫细胞组成。发现CD4+和CD8+T细胞在IA和AR期的肝脏中都很丰富,这两个阶段的特点是肝脏炎症水平升高。骨髓细胞在IT期和IA期的肝脏中显示出优先富集,表明在慢性HBV感染期间骨髓细胞区系发生了改变。γδT细胞和B细胞在CR期的肝脏中增加,这意味着慢性感染对这些细胞的潜在长期影响与已解决的HCV感染相似。值得注意的是,CD8+T和骨髓细胞在不同疾病阶段的趋势在肝脏和血液之间是一致的(图1E)。这些结果表明,HBV感染者的每个疾病阶段可能与一个独特的免疫特征有关。
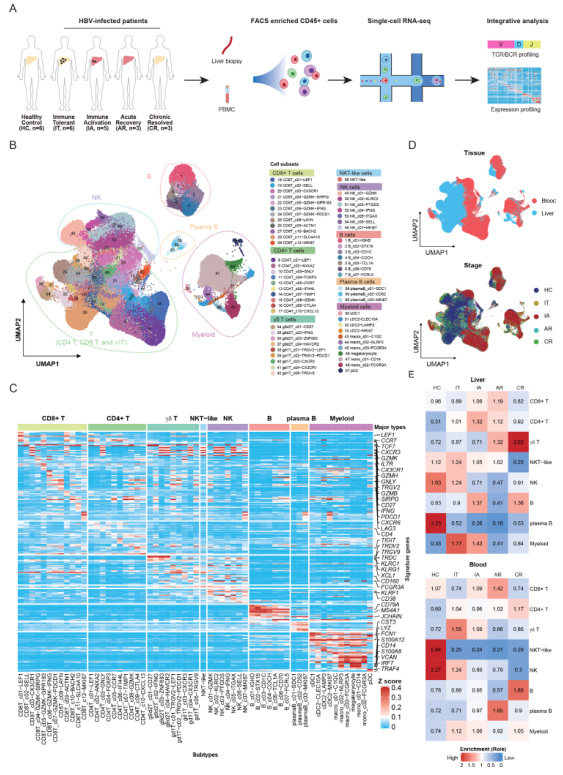
图1 肝脏和血液中免疫细胞的单细胞转录组图谱
2、HBV感染患者中Tex的扩增和MAIT细胞的缺失
如图2A所示,再次聚类CD8+T细胞产生了12个亚群。为了解CD8+T细胞群的潜在发展转变,应用基于分区的图抽象(PAGA)分析来构建12个CD8+T集群的发展轨迹。CD8T_c11-SLC4A10细胞作为一个独特的群体在轨迹之外脱颖而出,与MAIT细胞的注释一致。对于其他CD8+T细胞亚群,Tex(CD8T_c08-LAYN)和Temra(CD8_C03-CX3CR1)亚群被描述为两个不同的分支(图2B)。RNA速度分析进一步支持了Tex和Temra的这种发展特征(图2C)。
此外,每个亚群都显示出不同的组织偏好:CD8T_c01-LEF1、CD8T_c02-SELL、CD8T_c03-CX3CR1、CD8T_c05-GZMK-GPR183和CD8T_c09-ACTN1集群主要来自血液,而CD8T_c04-GZMK-SIRPG、 CD8T_c06_GZMK-IFNG、CD8T_c07-GZMK-PDCD1、CD8T_c08-LAYN、CD8T_c10-BACH2和CD8T_c11-SLC4A10集群主要存在于肝脏(图2D,E)。12个CD8+T细胞亚群显示出阶段性的异质性(图2F)。在CD8+T亚群中,所有四组HBV感染者的肝脏中MAIT群体明显减少,其中IA组最低(图2G)。这些结果与此前的报道一致,该研究报告了HBV相关HCC患者肝脏MAIT细胞的损失。令人震惊的是,CR中的MAIT细胞比例未能恢复到HC的水平(图2G),尽管这些患者已经HBsAg损失超过8个月,这表明HBV感染引起的肝内MAIT的损失是持久的。值得注意的是,CD8T_c08-LAYN细胞的比例在IT、IA和AR患者中有所增加(图2H),其中IA患者的CD8T_c08-LAYN细胞也显示出最高的衰竭得分(图2H)。
由于从scRNA-seq中捕获了TCR序列,这使作者能够通过以前开发的生物信息学指标,即通过RNA测序和TCR追踪(STARTRAC)指数来追踪T细胞的动态,如克隆扩张(expa)、迁移(migr)和发育过渡(tran)(图2I)。STARTRAC-expa指数显示,CD8T_c03-CX3CR1和CD8T_c08-LAYN表现出高度的克隆性扩张,主要是在AR和IA阶段。CD8T_c03-CX3CR1在AR患者中的扩展程度更高,而CD8T_c08-LAYN在IA患者中的扩展程度更高(图2J)。STARTRAC-tran分析表明,CD8T_c08-LAYN与GZMK+亚群高度相关,包括CD8T_c07-GZMK-PDCD1、CD8T_c04-GZMK-SIRPG和CD8T_c06_GZMK-IFNG。与AR患者相比,IA患者的CD8T_c08-LAYN与CD8T_c06_GZMK-IFNG联系更紧密,但与CD8T_c03-CX3CR1联系不紧密(图2K),表明IA和AR患者的CD8+T细胞来源不同。STARTRAC-migr分析显示CD8T_c08-LAYN显示中度的流动性,与肿瘤中的观察相似。然而,与IA患者相比,AR患者的衰竭T细胞表现出更高的STARTRAC-migr分数(图2L)。总之,IA和AR患者的Tex细胞表现出动态差异。
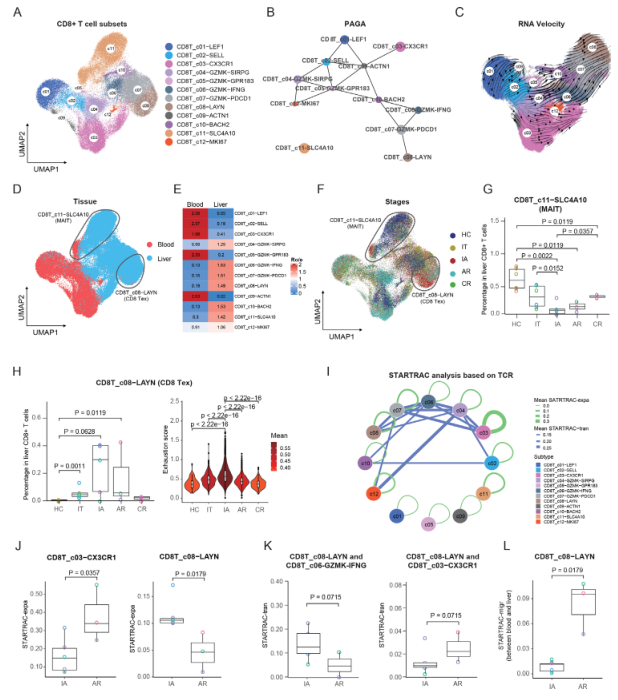
图2 CD8+ T细胞亚群的免疫学特征
3、IT和IA患者的肝内调节性CD4+T细胞增加
如图3A所示,共鉴定了10个CD4+T细胞群。PAGA轨迹分析显示,CD4+T细胞有四种不同的命运,其中CD4T_c02-ANXA2、CD4T_c03-GNLY、CD4T_c04-FOXP3和CD4T_c06-TIMP1是不同的终点(图3B)。朝向效应器和调节子集的进化方向也被RNA速度分析所证实(图3C)。组织偏好分析显示,CD4T_c05-CCR7、CD4T_c07-TIMP1、CD4T_c08-GZMK、CD4T_c09-CTLA4和CD4T_c10-CXCL13聚集在肝脏,其余五个亚群主要存在于血液中(图3D,E)。
然后比较了不同组别中CD4+T细胞(图3F)中的CD4+T细胞亚群的分数。在这些CD4+T亚群中,CD4T_c10-CXCL13亚群在AR患者的肝脏CD4+T细胞(图3G)中被富集。此外,在IT和IA患者的肝脏CD4+T细胞(图3H)中,CD4T_c09-CTLA4,也被称为肝脏驻留调节性T细胞(Treg)亚群,有所增加。此外,各阶段CD4T_c09-CTLA4细胞的调节效应器得分分析显示,IT和IA患者的调节效应器功能水平很高(图3H)。这些结果表明,Treg细胞的免疫调节可能与CHB的免疫耐受和病毒持久性有关。
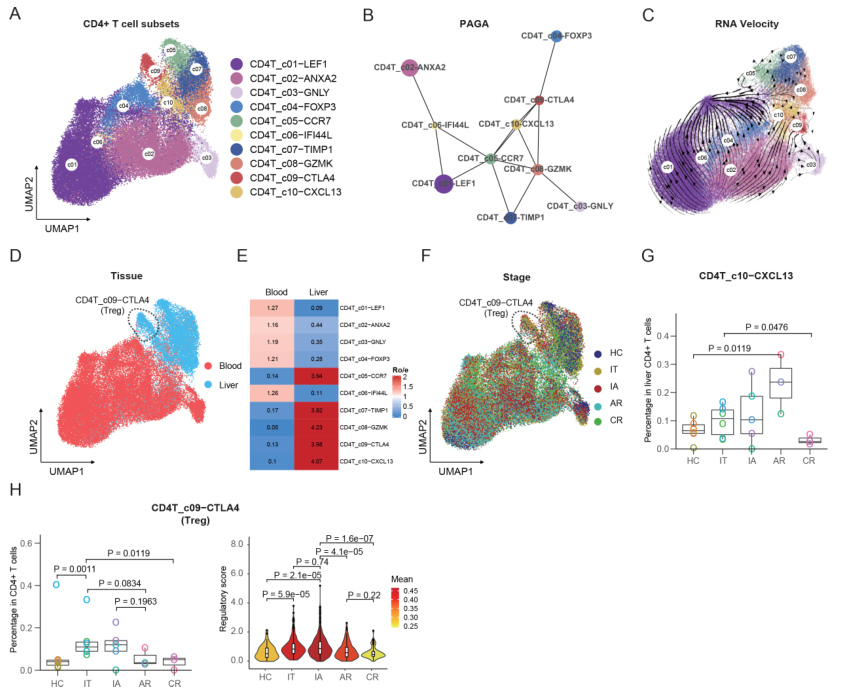
图3 CD4+ T细胞亚群的免疫学特征及其与CD8+ T细胞的相互作用
4、Treg和Tex细胞之间潜在的细胞间相互作用
使用细胞空间组织图(CSOmap),一个推断组织空间组织和细胞相互作用分子决定因素的生物信息学工具,作者估计了CD4+T细胞和CD8+T细胞亚群在计算构建的伪空间中的细胞相互作用潜力。在IT和IA阶段,发现Treg(CD4T_c09-CTLA4)和Tex(CD8T_c08-LAYN)之间有明显的相互作用(图4A)。值得注意的是,Tex和Treg在IT和IA患者的肝脏中被协调性地扩展(图2H)。通过多色免疫组化(IHC)染色,进一步证实了IT和IA患者中Tex(CD8+PD-1+)和Treg(CD4+FOXP3+)细胞之间的相邻空间关系(图4B)。
然后,比较了在IT和IA患者中促成Treg-CD8 Tex相互作用的潜在配体-受体(L-R)对的强度。发现几个L-R对,CD44_VIM、HLA-B_CANX、TNFRSF1A_LTB和CD74_APP,在IT期显示出较高的相互作用潜力,而HLA-A_APLP2、KLRD1_HLA和KLRD1_HLA-E在IA期显示出较高的相互作用潜力(图4C、D)。最近有报道说HLA-B_CANX轴能够抑制T细胞的抗肿瘤免疫。由VIM基因编码的Vimentin是Treg活性的关键代谢和功能控制器,而CD44免疫检查点控制CD8+T细胞的激活。此外,HLA-E_KLRD1信号参与介导慢性HBV和HCV感染的T细胞功能障碍和病毒持久性。总之,这些数据为今后有关免疫发病机制的研究以及CHB的治疗尝试提供了宝贵的功能验证信息。
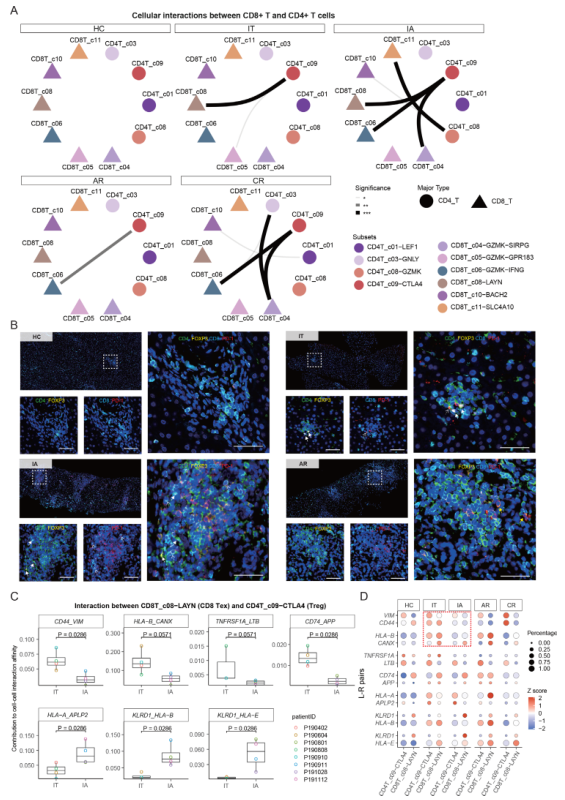
图4肝脏Treg和Tex细胞的多色免疫组化染色
5、HBV感染者的肝内骨髓细胞及其与T细胞的相互作用
如图5A所示,髓细胞被聚类为11个细胞亚群,属于四个共同的系(树突状细胞(DCs)、巨噬细胞、巨核细胞和单核细胞)。DCs进一步分为两个经典的cDC亚群(CLEC9A+cDC1和CLEC10A+cDC2),一个成熟的cDC亚群(cDC2-LAMP3),一个增殖的亚群(cDC2-MKI67)和pDC。所有这五种DC亚群都主要存在于肝脏(图5B,C),并在IT患者中富集(图5D,E),表明这些细胞可能是由IT患者的高水平病毒复制所驱动。巨噬细胞被进一步分为macro_c01-C1QC、macro_c02-NLRP3和macro_c03-FCGR3A。与DCs类似,巨噬细胞亚群也主要分布在肝脏(图5B,C)。在五个病人组中,macro_c01-C1QC和macro_c03-FCGR3A在IT病人的肝脏CD45+细胞中显示出明显的扩展(图5F)。
为了解巨噬细胞亚群的来源,根据报道的标记物定义了关于Kupffer来源(Kupffer score)或单核细胞来源巨噬细胞(MoMF score)的分数。基于与Kupffer/单核细胞来源相关的基因的表达分析并不能完全解释巨噬细胞的异质性(图5G)。进一步比较巨噬细胞群体之间的DEGs发现,macro_c01-C1QC表达了高水平的补体C1Q基因和第二类HLA分子,表明该集群具有吞噬能力(图5H)。Macro_c02-NLRP3表达高水平的促炎症基因,如S100基因、IL1B、VCAN和LYZ,并以高促炎症评分为特征(图5H)。Macro_c03-FCGR3A表达高水平的抗病毒ISG(IFITM2、IFITM3、SPN、WARS和CTSC)和免疫调节基因(SOD1、MT2A、LST1、LYN、MTSS1、PECAM1、LILRB2和LILRA5),表现出高促炎性评分和高抑制T细胞活化的能力(图5H)。
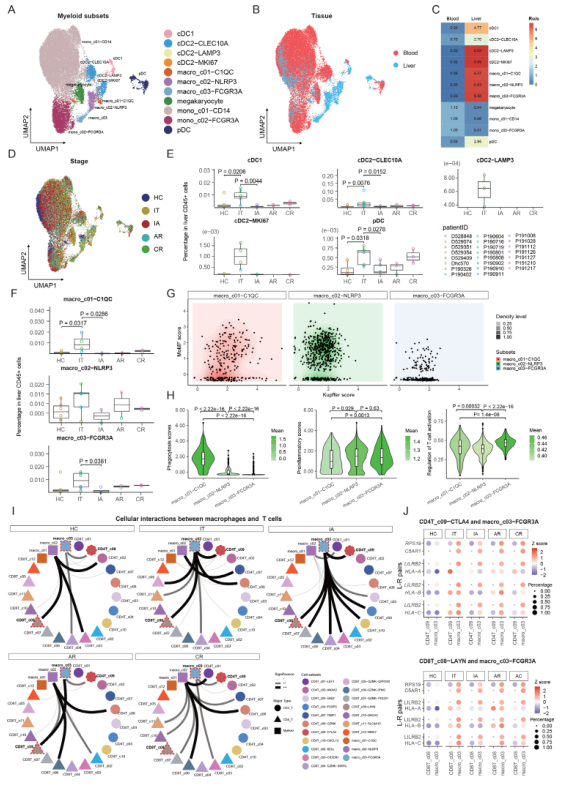
图5 骨髓细胞亚群的免疫学特征及其与T细胞的相互作用
为剖析巨噬细胞和T细胞的潜在串扰,使用CSOmap来推断巨噬细胞亚群和T细胞之间的细胞-细胞相互作用。惊人的是,CSOmap分析显示,macro_c03-FCGR3A在两个慢性期(IT和IA)与T细胞的相互作用中占主导地位,而在两个缓解期(AR和CR)这种相互作用的强度下降,而macro_c02-NLRP3在解决期与T细胞的相互作用占主导地位(图5I)。通过检查macro_03-FCGR3A和CD8T_c08-LAYN之间的L-R对相互作用,HLA一类分子(HLA-I)和白细胞免疫球蛋白样受体(LILR)家族之间的几个L-R对表现出强烈的潜在相互作用(图5J)。一致的是,观察到在IT和IA患者的肝脏中,LILRB2阳性的巨噬细胞与Tex细胞相邻的位置富集(图6)。这些潜在的相互作用可能是功能性的,考虑到以前的研究结果,LILRB1和LILRB2可以通过与CD8+T细胞竞争HLA-I的结合,以及通过其免疫受体酪氨酸为基础的抑制性受体图案招募抑制性分子,促进肿瘤微环境中的免疫逃避。总之,这些结果表明,FCGR3A+巨噬细胞在CHB中调节T细胞反应方面起着核心作用,可能是通过HLA-I_LILRB信号传导。
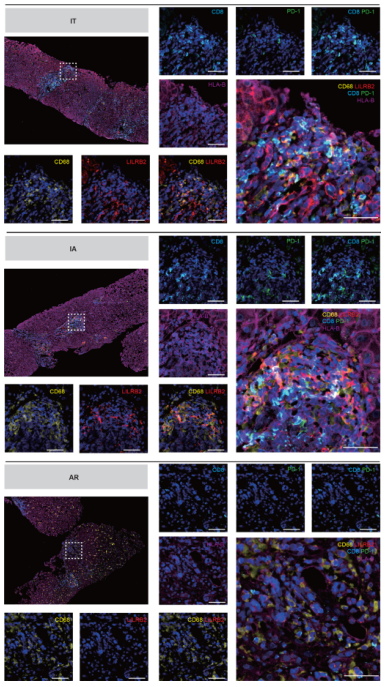
图6 IT组、IA组和AR组大鼠肝脏特克斯细胞和巨噬细胞的多色免疫组化染色
6、肝脏免疫亚群与临床参数的相关性
为了解HBV感染者的肝脏免疫亚群与临床参数的关系,对所有17名HBV感染者的细胞频率与HBsAg、HBV DNA、ALT、AST以及组织学分级和分期的水平进行了相关性分析。年龄和诊断后的时间也被纳入分析,以撇开受这两个参数影响的因素。有趣的是,ALT水平与MAIT细胞的频率呈负相关,与肝脏中CD8+ Tex、Treg和CD4T_c10-CXCL13的频率呈正相关(图7A),表明这些细胞亚群可能是肝损伤的关键执行者或反应者。与ALT类似,观察到MAIT细胞和CD8+ Tex与肝脏活检的组织学分级分数分别负相关和正相关(图7B)。此外,组织学分级与CD8T_c05-GZMK-GPR183的频率呈正相关,与PlasmaB_c01-SDC1和两个骨髓亚群(cDC1和macro_c03-FCGR3A)呈负相关(图7B)。相比之下,组织学分级仅与肝脏CD45+细胞中CD8T_c05-GZMK-GPR183的频率呈正相关。随后作者评估了肝内免疫亚群与血清HBsAg和血清HBV DNA水平的关系。血清HBsAg水平与macro_c03-FCGR3A、macro_c02-NLRP3、cDC-LAMP3和cDC-MKI67的频率成正相关(图7C)。
为剖析血液和肝脏之间是否存在协调的免疫变化,对17名HBV感染者的血液和肝脏之间所有确定的免疫亚群进行了相关分析。在60个亚群中,4个亚群(CD8T_c03-CX3CR1、CD8T_c09-ACTN1、CD8T_c12-MKI67和plasmaB_c03-MKI67)在血液和肝脏之间显示出明显的相关性(图7D)。肝内免疫细胞亚群在不同阶段有明显改变,如MAIT、Treg和CD8+ Tex,在血液中几乎找不到(图7D)。值得注意的是,CD8T_c03-CX3CR1和CD8T_c09-ACTN1的频率在血液和肝脏之间呈现正相关(图7D)。CD8T_c03-CX3CR1(类似于Temra)和CD8T_c09-ACTN1(Tcm亚群)细胞都表现出类似的功能特征,包括低衰竭和高细胞毒性水平(图7E)。通过使用额外的验证队列,作者证实CX3CR1+GNLY+Tcm细胞(CD8T_c09-ACTN1细胞的潜在替代物)在AR患者的血液中优先扩展(图7F)。因此,应研究CX3CR1+GNLY+ CD8+Tcm细胞在治愈HBV中的可能作用。
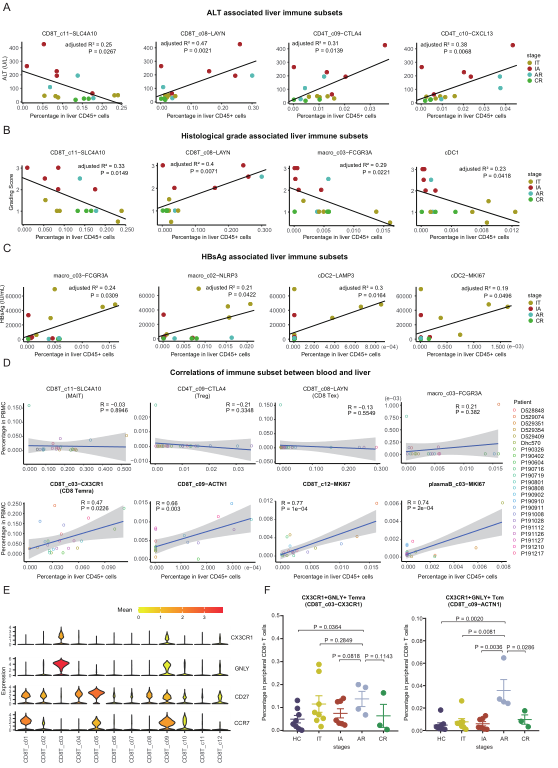
图7 HBV感染患者肝内免疫特征与临床参数的相关性
实验方法
临床样本收集和细胞分离,单细胞RNA测序和数据生物信息学分析,流式细胞术,多色免疫组化,
参考文献
Zhang C, Li J, Cheng Y, Meng F, Song JW, Fan X, Fan H, Li J, Fu YL, Zhou MJ, Hu W, Wang SY, Fu YJ, Zhang JY, Xu RN, Shi M, Hu X, Zhang Z, Ren X, Wang FS. Single-cell RNA sequencing reveals intrahepatic and peripheral immune characteristics related to disease phases in HBV-infected patients. Gut. 2023 Jan;72(1):153-167. doi: 10.1136/gutjnl-2021-325915. Epub 2022 Mar 31. PMID: 35361683; PMCID: PMC9763233.






