circSLC4A7-胃癌的新靶点
胃癌干细胞(GCSCs)在胃癌的发生和发展中起着至关重要的作用。 circRNAs参与多种癌症生物学过程,并作为肿瘤抑制因子或癌基因发挥作用。本研究旨在发现circRNAs在GCSCs中的表达谱和功能作用。对circRNA的全基因组测序显示,一种新的circRNA,circSLC4A7是GCSCs中表达上调最多的circRNA之一。circSLC4A7定位于细胞核,其水平在GC细胞和组织中升高。此外,circSLC4A7增加了CSC样特性,并驱动细胞增殖、迁移和侵袭。机制上,HSP90与circSLC4A7相互作用,通过激活GC中Notch1信号通路介导circSLC4A7的致癌功能。本研究强调了circSLC4A7通过与HSP90结合从而激活Notch1信号通路介导的一种新的致癌功能。本文于2023年7月发表于Cell Death and Disease(IF=9.0)上。
技术路线

结果
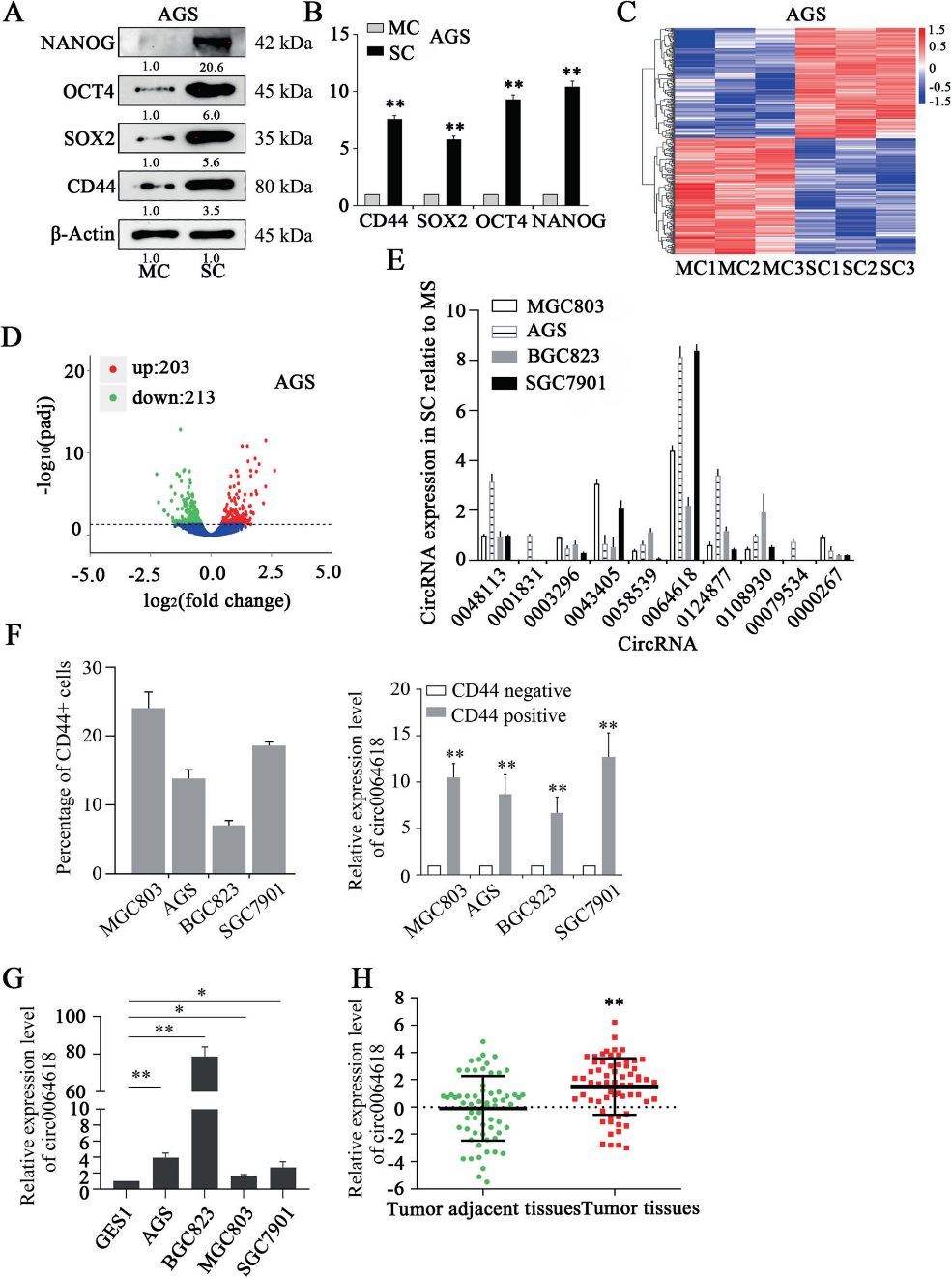
1)circRNA在CSCs和MSCs中的表达谱
我们的研究首先验证了CSC标记物在球体形成实验后获得的细胞中的过表达,并在mRNA和蛋白质水平上与单层细胞(MCs)的标记物丰度进行了比较(图1A, B)。接着,我们从3对GC SCs和MCs中提取总RNA,并进行第二代测序以鉴定差异表达的circRNA(图1C)。基因聚类分析显示,203个circRNA表达上调,213个circRNA表达下调(图D)。为了验证基因聚类分析的结果,我们进一步通过qRT-PCR检测了4株GC细胞系(MGC803、AGS、BGC823和SGC7901)中6个上调最多的circRNA和4个下调最多的circRNA的表达。与MCs相比,CircRNA_0064618 (circ0064618)在4种SCs中的过表达水平最高(图1E)。CD44阳性GC细胞中circ0064618的表达水平明显高于CD44阴性细胞(图1F)。而且,在GES1细胞中circ0064168的表达水平远低于GC细胞系(图1G)。GC组织中circSLC4A7的表达水平明显高于肿瘤邻近组织(图1H)。这些结果提示circ0064618可能在GCSCs中发挥关键作用。此外,AGS和BGC823细胞中circ0064618的表达水平高于MGC803和SGC7901细胞。因此,circ0064618在MGC803和SGC7901细胞中异位过表达,而在AGS和BGC823细胞中沉默,以研究其生物学功能。
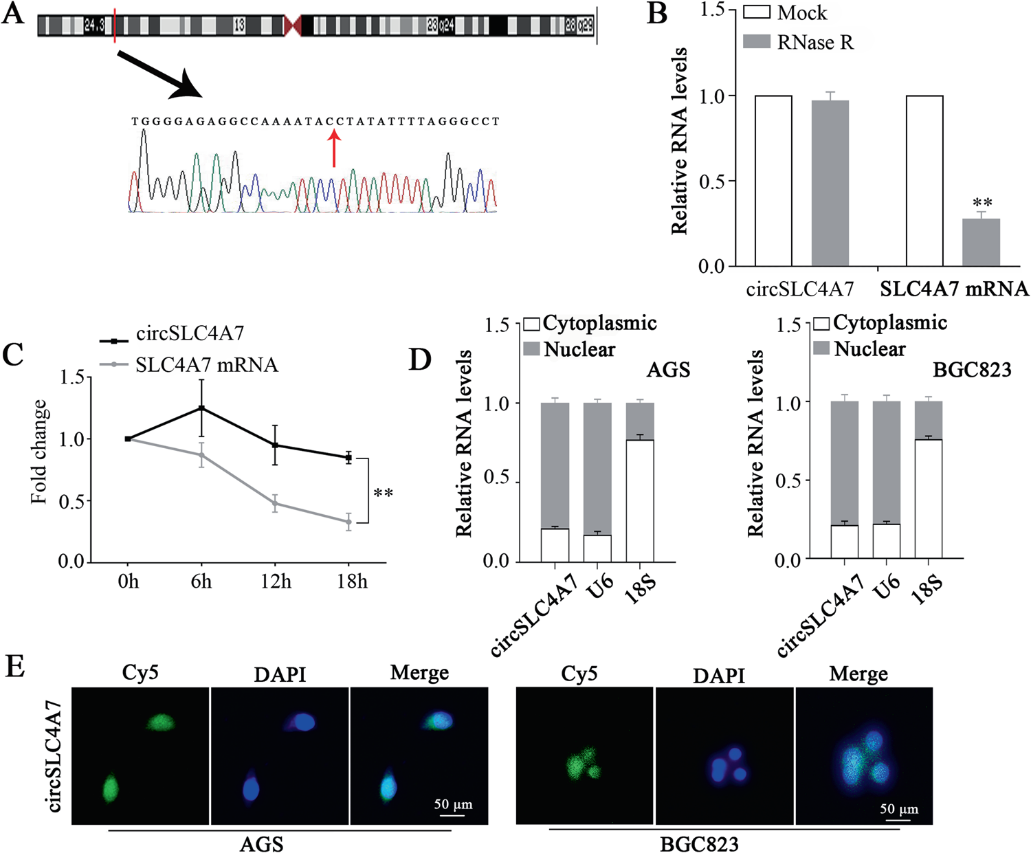
2)circSLC4A7在胃癌细胞中的特异性特征及预后价值
Circ0064618由位于3号染色体的SLC4A7基因编码(图2A),因此,Circ0064618被称为circSLC4A7。对RNase R外切酶的抗性证实了RNA是环状的(图2B)。值得注意的是,在Actinomycin D处理后,circSLC4A7显示出比SLC4A7 mRNA更长的半衰期(图2C)。通过mRNA分离(图2D)和FISH (图2E)的进一步检查表明,circSLC4A7优先定位于细胞核。
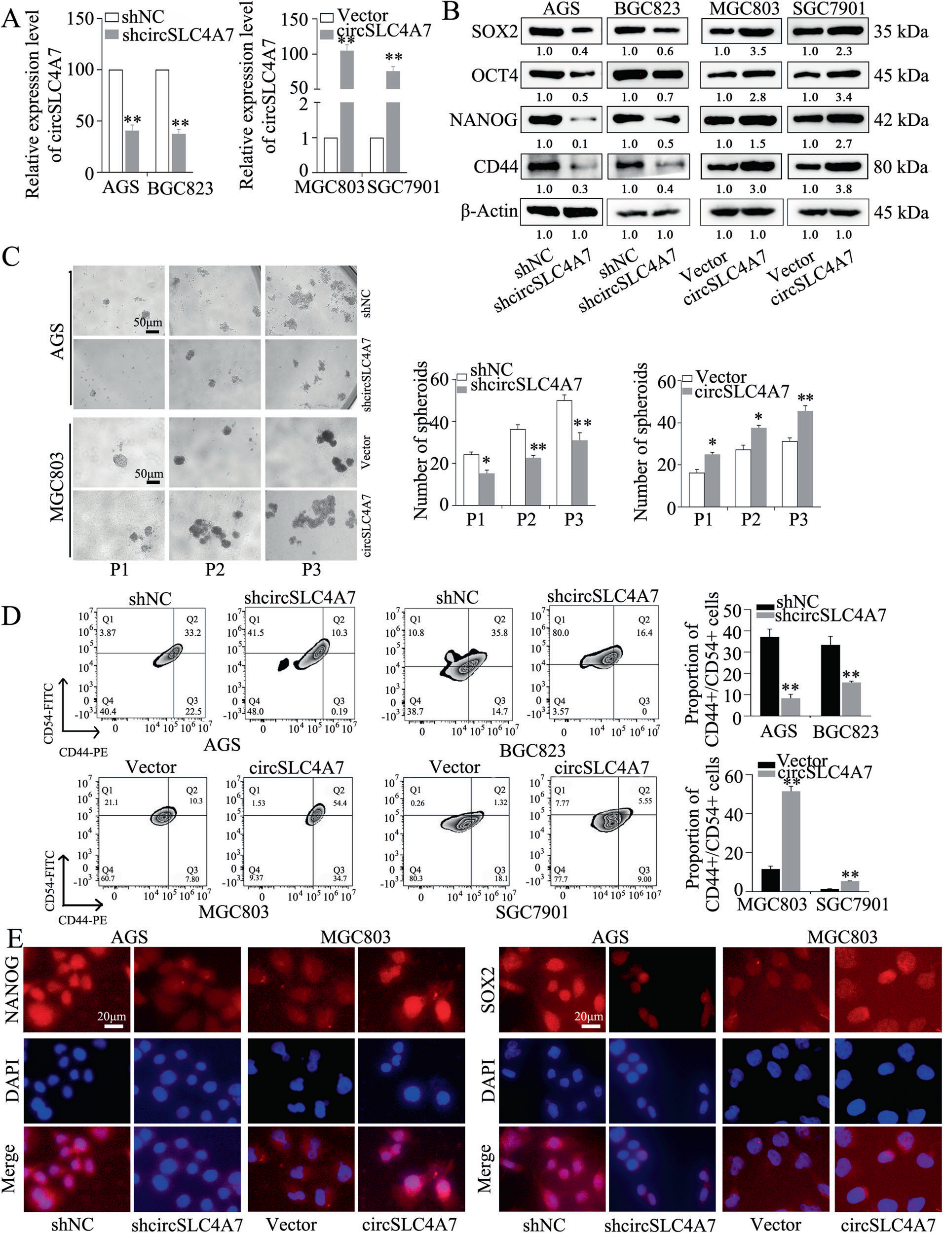
3)circSLC4A7的表达与胃癌的干性呈正相关
我们研究了circSLC4A7在GC中的精确功能。用circSLC4A7 shRNA稳定转染后,在AGS和BGC823细胞中circSLC4A7的表达量大大降低,用过表达载体转染后,在MGC803和SGC7901细胞中circSLC4A7的表达量显著上调(图3A)。我们的研究结果显示,在GCSCs中circSLC4A7的表达显著升高。因此,我们研究了circSLC4A7是否对干细胞潜能有影响。Western blotting检测表明,在AGS和BGC823细胞中沉默circSLC4A7可明显抑制CSC标志物SOX2、OCT4、NANOG和CD44的表达。此外,circSLC4A7过表达增加了CSC标志物的表达(图3B)。此外,在AGS和BGC823细胞中,敲低circSLC4A7显著减少了球体形成实验中肿瘤球体的数量,异位过表达circSLC4A7增加了肿瘤球体形成的数量(图3C)。流式细胞术检测证实,circSLC4A7沉默的细胞中CD44+/CD54+细胞的比例下降。circSLC4A7过表达细胞中CD44+/CD54+细胞比例增加(图3D)。IF实验进一步证实NANOG和SOX2在AGS-shcircSLC4A7细胞和BGC823-shcircSLC4A7细胞中表达下调(图3E),而NANOG和SOX2在MGC803-circSLC4A7细胞和SGC7901-circSLC4A7细胞中表达上调(图3E)。这些结果表明,circSLC4A7增加了GC细胞的CSC容量。
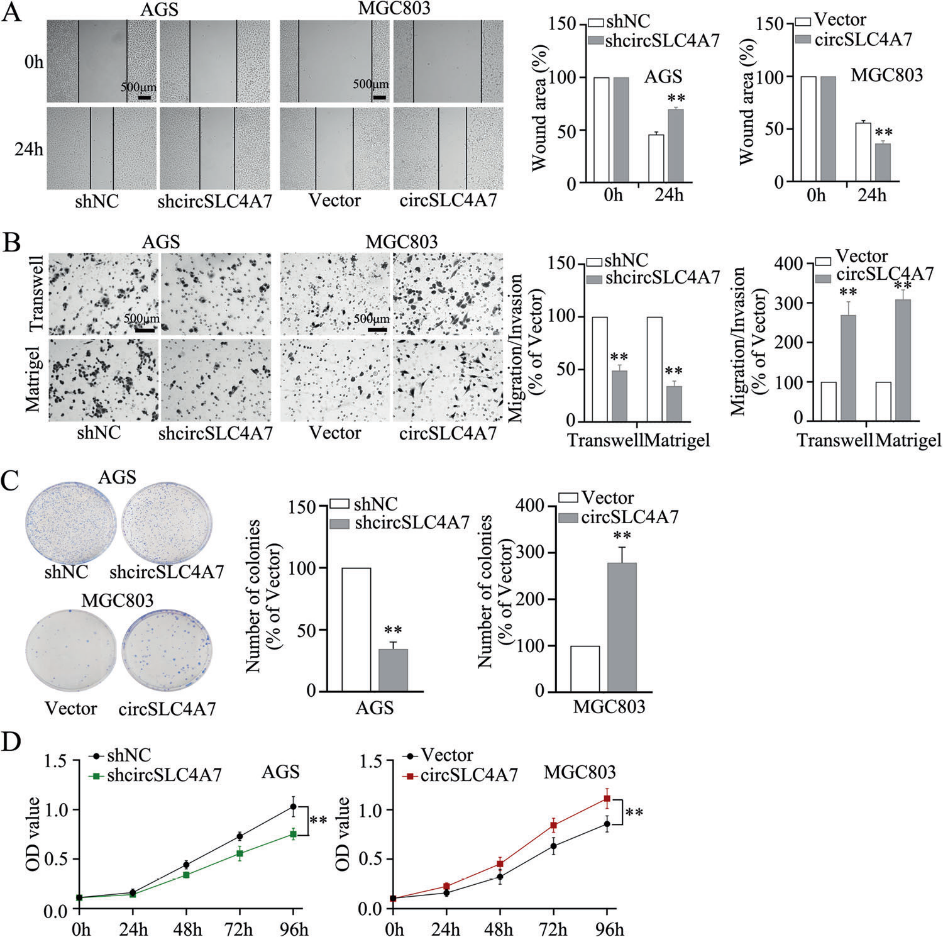
4)circSLC4A7加速GC细胞的迁移、侵袭和增殖
为了检测circSLC4A7在CSC相关行为中的作用,我们研究了GC细胞的转移和增殖能力。一项伤口愈合试验显示敲低circSLC4A7明显阻碍了GC细胞的迁移,异位表达circSLC4A7促进了GC细胞的迁移(图4A)。Transwell实验进一步证实了这些结果(图4B)。此外,我们在集落形成和CCK-8实验中证明了抑制circSLC4A7显著延缓了细胞增殖,过表达circSLC4A7加速了细胞增殖(图4C、D)。综上所述,这些发现表明circSLC4A7促进了GC的迁移、侵袭和增殖。
5)circSLC4A7与HSP90相互作用
随后,我们研究了circSCL4A7在GC进程中发挥作用的机制。为了确定circSLC4A7的蛋白伴侣,我们进行了生物素标记的RNA下拉实验,然后对癌细胞中的RNA相关蛋白复合物进行了蛋白质组学分析。质谱分析显示,BGC823细胞中有169种蛋白可能与circSLC4A7相互作用。HSP90的表达发生了很大的变化(图5A)。Western blotting进一步证实了HSP90的差异表达(图5A)。此外,RIP实验表明在AGS细胞和BGC823细胞中,circSLC4A7在与抗HSP90抗体共沉淀的RNA中内源性富集,证明了circSLC4A7与HSP90之间的相互作用(图5B)。此外,通过双RNA-FISH和免疫荧光法鉴定了BGC823细胞中circSLC4A7和HSP90的重叠定位(图5C)。调节circSLC4A7在AGS和MGC803细胞中的表达后,HSP90的表达不受影响(图5D)。在siHSP90或siNC转染的细胞中,circSLC4A7的相对表达水平也相当(图5E)。在GES1和GC细胞(AGS、BGC823、MGC803和SGC7901细胞)中,HSP90的相对表达与circSLC4A7的相对表达一致(图5F)。结果表明,在GC细胞中,circSLC4A7与HSP90相互作用。
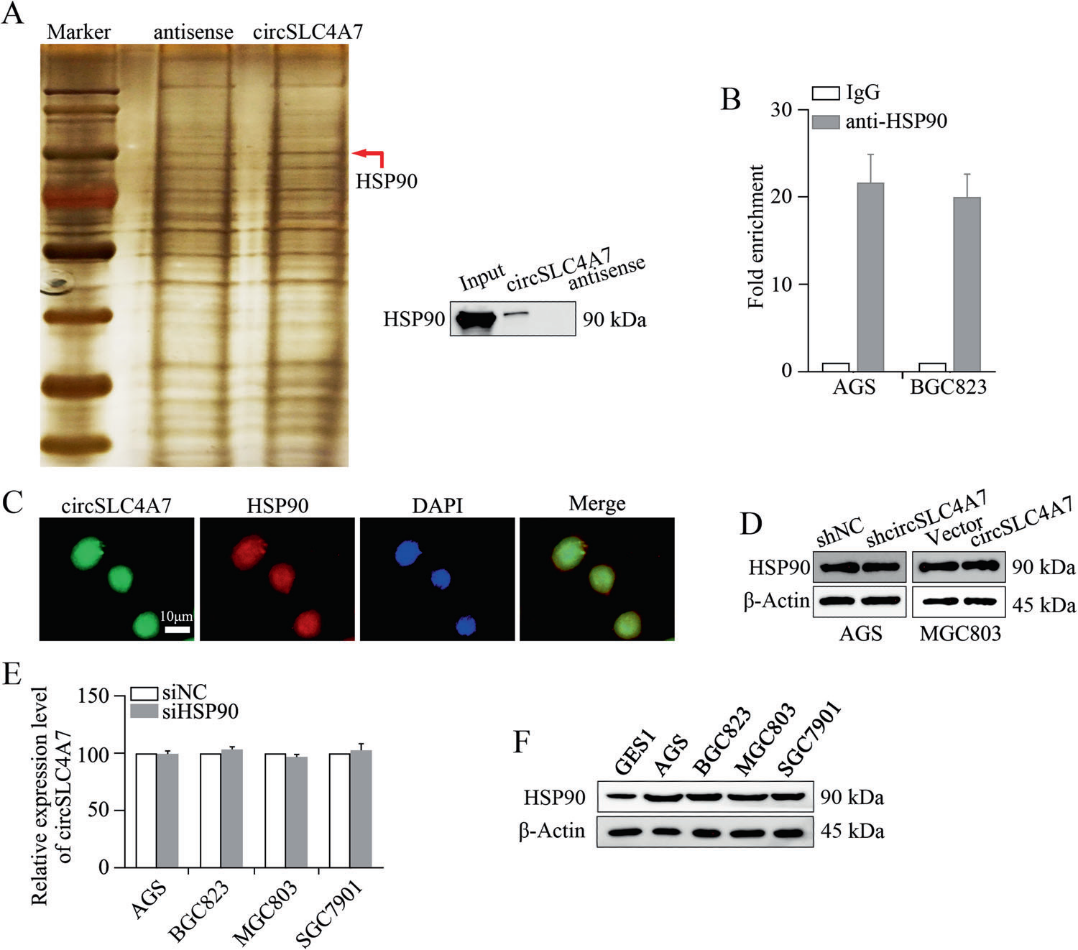
6)circSLC4A7通过与GC中的HSP90相互作用发挥作用
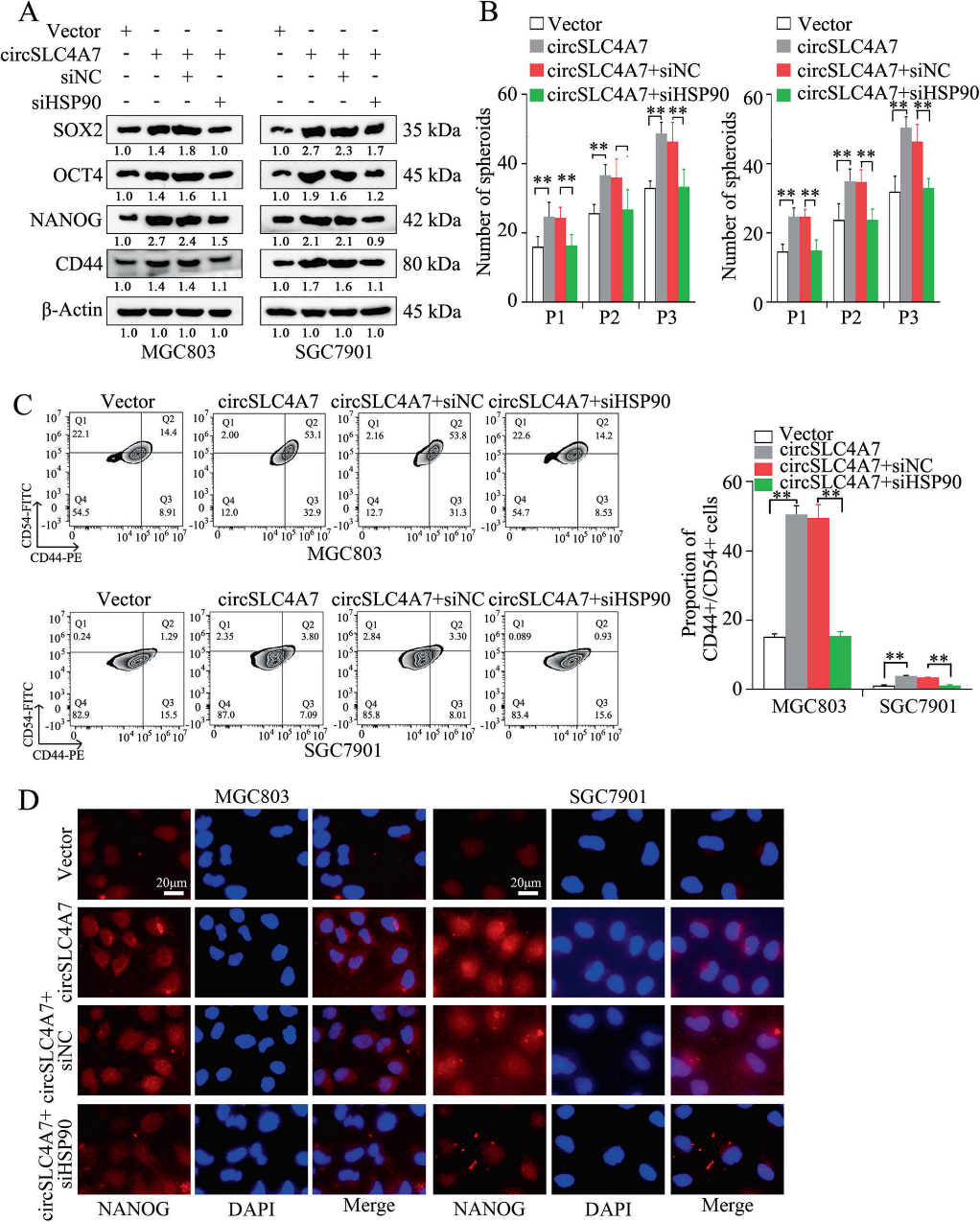
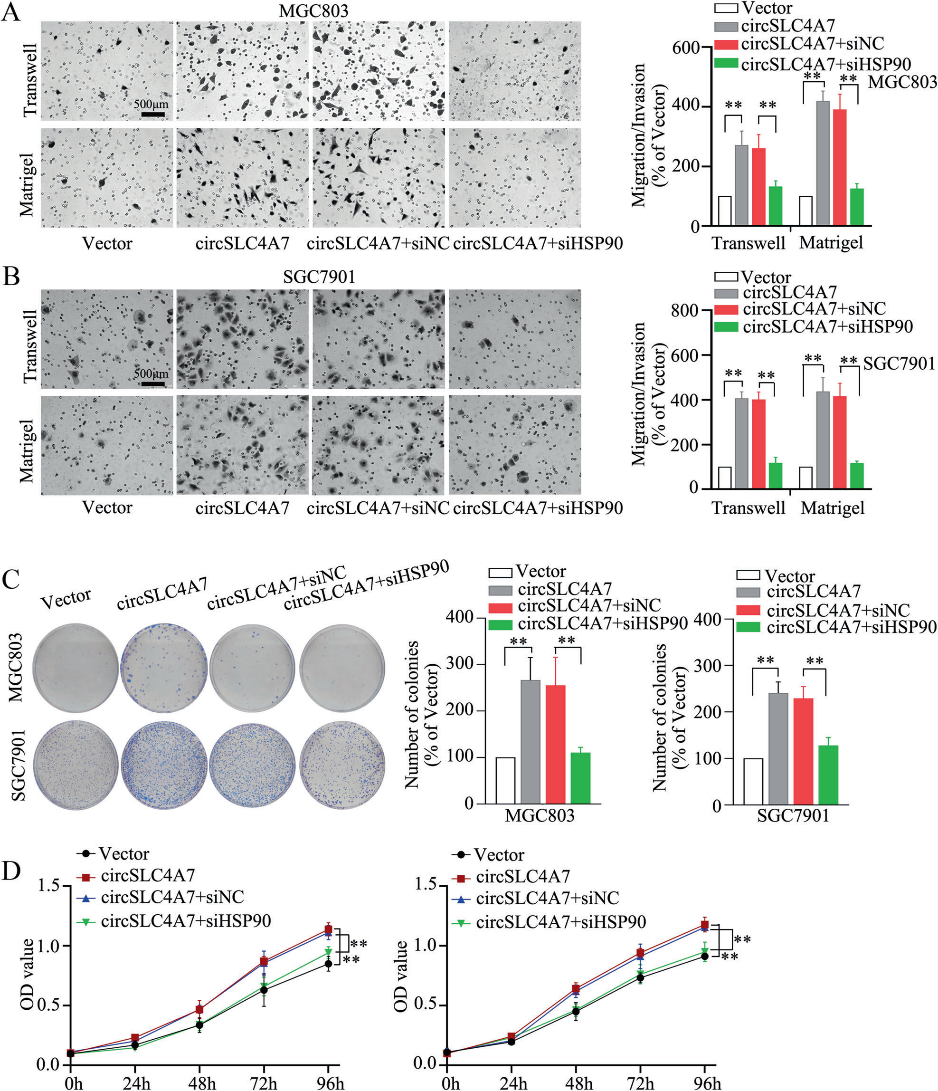
通过抑制过表达circSLC4A7的细胞(MGC803-circSLC4A7和SGC7901-circSLC4A7细胞)中HSP90的表达,研究HSP90表达对GC细胞中circSLC4A7功能作用的影响。结果显示,通过Western blotting(图6A)检测,HSP90沉默抑制了CSC标记物(SOX2, OCT4, NANOG和CD44)的上调(图6A)。球体形成实验中形成的球体数量的增加也减弱了(图6B)。流式细胞术检测显示,siHSP90逆转了circSLC4A7过表达引起的CD44+/ CD54+细胞比例的增加(图6C)。IF检测显示,抑制HSP90显著降低了由异位circSLC4A7表达引起的CSC标志物(NANOG和SOX2)的表达增加(图6D)。此外,通过沉默HSP90也可以抑制过表达circSLC4A7的GC细胞的加速迁移(图7A、B,上图)、侵袭(图7A、B,下图)和增殖(图7C、D)。总之,这一证据表明circSLC4A7在GC细胞中通过与HSP90相互作用发挥其功能。
7)circSLC4A7与HSP90结合,通过NOTCH信号通路调节GC中的细胞干性
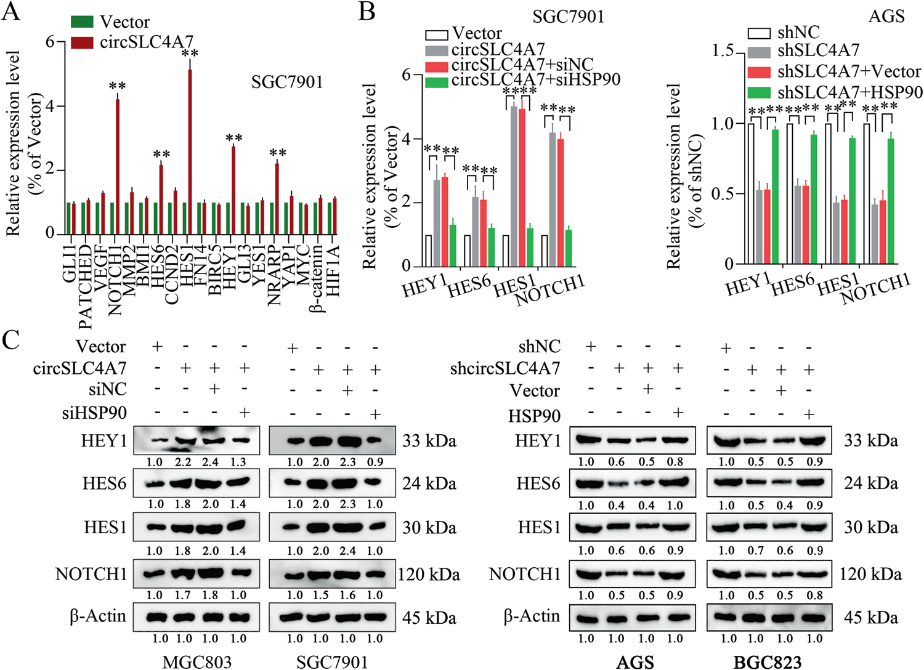
包括NOTCH信号、Wnt信号、NF-κB信号和Sonic Hedgehog信号在内的几个关键信号通路在调节CSC特性中发挥重要作用。为了确定这些信号通路是否介导circSLC4A7/HSP90复合物在GC中的功能,采用qRT-PCR法检测其靶基因的表达水平。在qRT-PCR检测中,Notch信号通路中基因(NOTCH1、HES6、HEY1、HES1、NARP)的表达显著增加(图8A)。进一步的测量发现,HSP90沉默逆转了Notch信号通路中某些基因(NOTCH1、HES6、HEY1和HES1)的上调表达,而HSP90过表达逆转了Notch信号通路中某些基因(NOTCH1、HES6、HEY1和HES1)在mRNA和蛋白水平上的抑制(图8B、C)。总之,Notch信号调节circSLC4A7/HSP90复合物在GC中的功能作用。
结论
我们的研究发现circSLC4A7在不影响HSP90表达水平的情况下与HSP90相互作用,进而激活NOTCH1信号通路,调控GC的干性和进展。这些结果表明circSLC4A7是一种新的有希望的GC治疗靶点。
实验方法
成球试验,RNA pull-down,质谱,RIP,qRT-PCR,Western blot,免疫荧光,CCK-8,集落形成试验,创伤愈合实验,Transwell,FISH。
参考文献
Hui Y, Wenguang Y, Wei S, Haoran W, Shanglei N, Ju L. circSLC4A7 accelerates stemness and progression of gastric cancer by interacting with HSP90 to activate NOTCH1 signaling pathway. Cell Death Dis. 2023 Jul 20;14(7):452. doi: 10.1038/s41419-023-05976-w.






