已确认:索拉菲尼诱导胃癌细胞铁死亡
索拉非尼是一种酪氨酸激酶抑制剂,在包括胃癌(GC)在内的多种癌症中作为铁死亡诱导剂具有重要的抗肿瘤作用。然而,最近索拉非尼作为铁死亡诱导剂的状态受到质疑。关于铁死亡和ATF2之间关系的信息非常有限,且ATF2在索拉非尼诱导的铁死亡中的作用尚未被研究。在本文中,作者探讨了GC中ATF2在索拉非尼诱导的铁死亡中的作用及其相关分子机制。本文于2023年1月发表在《Redox Biology》IF:11.4期刊上。
技术路线

主要实验结果
1、ATF2在胃癌中表达上调并预示不良预后
TCGA数据库显示与正常组比较,ATF2 mRNA表达在肿瘤中显著上调(图1A)。此外,与正常细胞系GES-1比较,GC细胞系中ATF2的蛋白表达显著上调(图1B),该结果被临床12对癌与癌旁的检测结果所验证(图1C)。使用IHC检测了107例GC组和22例正常组织中ATF2的表达,代表性图像见图1D,结果发现GC组织中61.7%的样本ATF2高表达,而癌旁中63.6%的样本ATF2低表达(图1E)。结合患者预后的生存分析显示ATF2高表达组的总体生存期显著下降(图1F)。KM数据库得出了类似的结论(图1G)。总之,ATF2在GC中表达上调并预示不良预后。
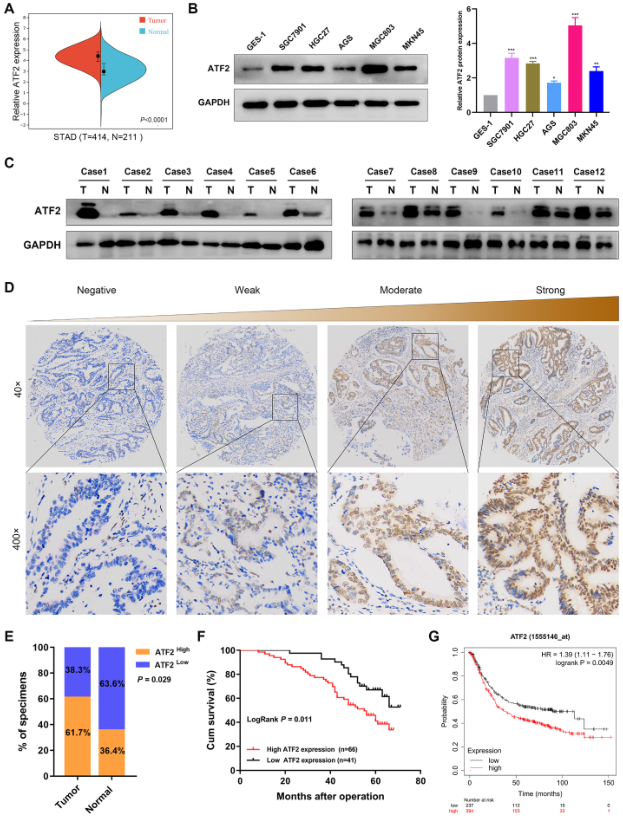
图1 ATF2在GO中上调且预测不良预后
2、ATF2促进GC细胞恶性表型
如图2所示,在GC细胞中敲低ATF2后显著抑制细胞的增殖迁移和侵袭,过表达ATF2则相反,表明ATF2促进GC细胞恶性表型。
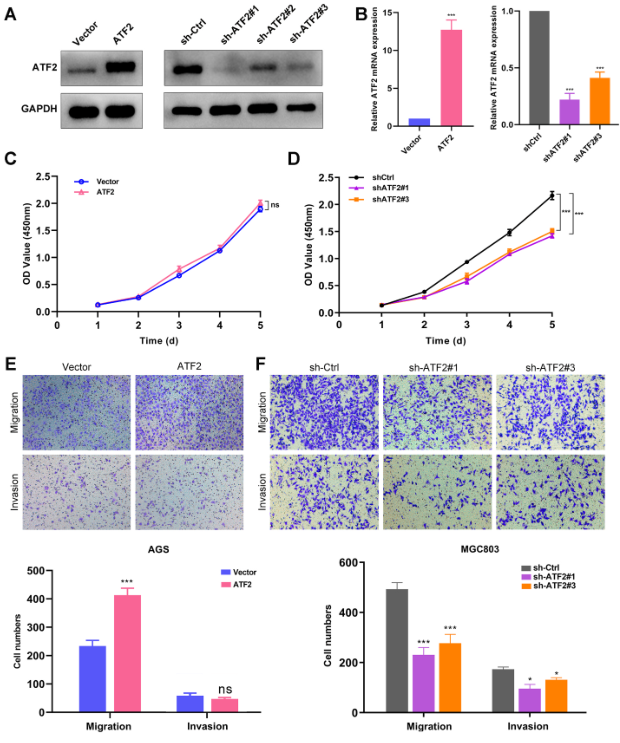
图2 ATF2敲低抑制GC细胞恶性表型
3、索拉非尼诱导GC细胞铁死亡
由于先前的研究表明索拉非尼诱导铁死亡的不确定性,作者首先探究了索拉菲尼是否诱导GC细胞铁死亡。如图3A所示,索拉菲尼处理细胞24h后,AGS和MGC-803细胞形态呈现出收缩,变圆,排列松散,而同时使用铁死亡抑制剂Fer-1处理则可反转这种效果。与对照组相比,索拉非尼处理导致总细胞ROS和脂质ROS均显著增加(图3B-C),并且导致MDA水平增加(图3D),GSH水平下降(图3E),然而Fer-1处理抑制上述效果。
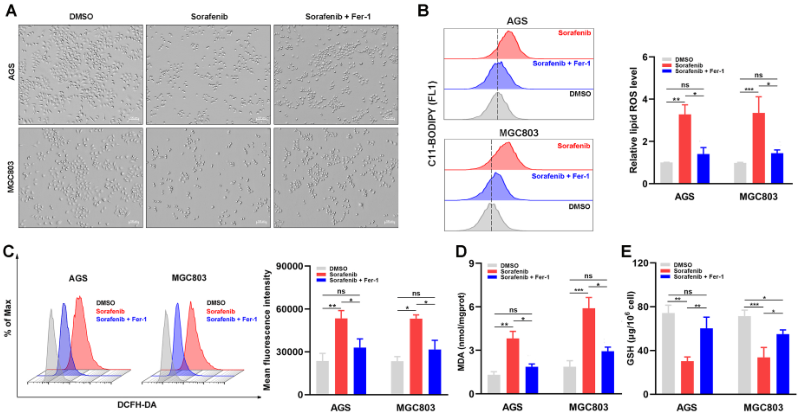
图3 索拉非尼诱导AGS和MGC-803细胞铁死亡
鉴于铁死亡与线粒体功能息息相关,因此,作者进一步检测了索拉菲尼对MMP和线粒体形态的影响。JC-1染色结果显示,与对照组比较,索拉菲尼显著减低AGS和MGC-803细胞MMP(图4A)。此外,TEM显示索拉菲尼处理的MGC803细胞线粒体嵴明显减少或缺失,线粒体膜密度增加(图4B)。这些结果表明索拉非尼可以诱导GC细胞的铁死亡。
作为一种关键的应激反应转录因子,ATF2在索拉非尼诱导的铁死亡中的表达变化尚不清楚。如图4C所示,索拉非尼处理增加ATF2的表达,尤其是磷酸化形式。免疫荧光显示,索拉非尼刺激后ATF2在细胞核中的表达更高(图4D)。因此,索拉非尼诱导的铁死亡可能会促进ATF2的核转位并增强ATF2在GC细胞中的转录活性。
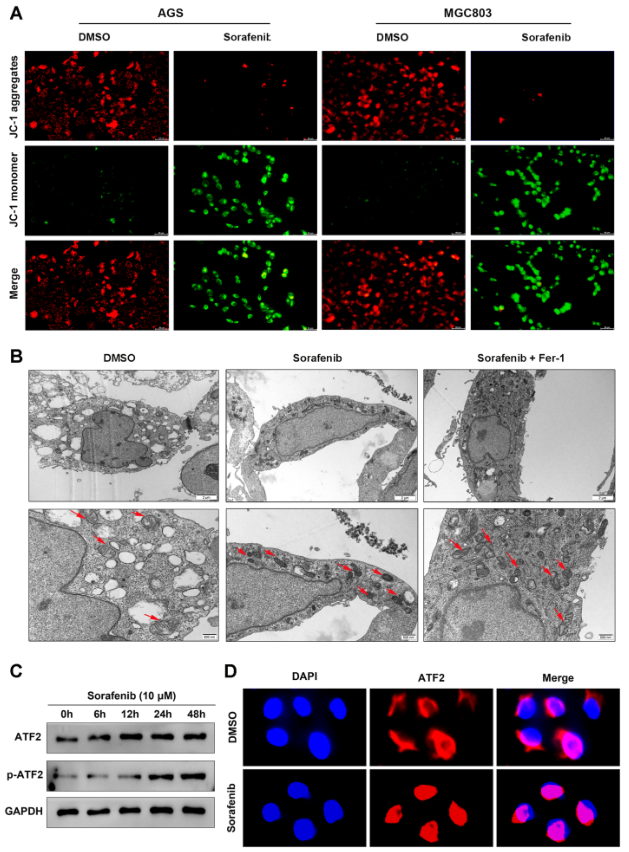
图4 索拉非尼处理增加GC细胞中ATF2的表达并促进其核易位
4、ATF2敲低抑制索拉菲尼诱导的GC细胞铁死亡
如图5A所示,敲低ATF2导致GC细胞的IC50下降,过表达则相反。此外,索拉菲尼和ATF2敲低均显著增加细胞内总ROS和脂质ROS含量,而两者同时进行则进一步促进其增加,但是,索拉菲尼处理同时过表达ATF2则显著回落ROS的水平(图5B-C)。类似的,过表达ATF2可显著逆转因索拉菲尼处理引起的MDA增加(图5D)和GSH下降(图5E),以及线粒体形态改变(图5F)。这些发现表明ATF2过表达抑制索拉非尼诱导的GC细胞铁死亡。
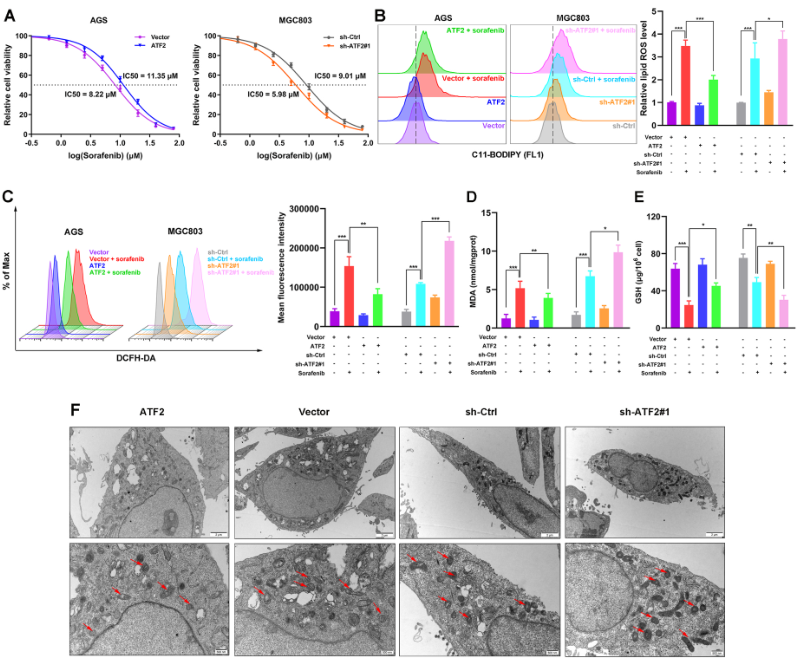
图5 ATF2敲低抑制索拉菲尼诱导的GC细胞铁死亡
5、ATF2在GC细胞中激活HSPH1的转录
为进一步阐明ATF2的潜在机制,进行RNA-seq和ChIP-seq分析,以鉴定ATF2的全基因组DNA结合位点和潜在转录靶点。如图6A所示,RNA-seq分析显示,与对照组相比,MGC803细胞中ATF2敲除后,1059个基因上调,370个基因下调。重要的是,RNA-seq数据的通路富集分析表明,ATF2敲除明显影响铁死亡通路(图6B)。ChIP-seq共鉴定出24119个峰,对应3641个RefSeq基因,其中2.88%位于启动子-转录起始位点(图6C)。在染色体上观察到了不同的峰值,并扫描了峰值之间共享的motifs(图6D和E)。
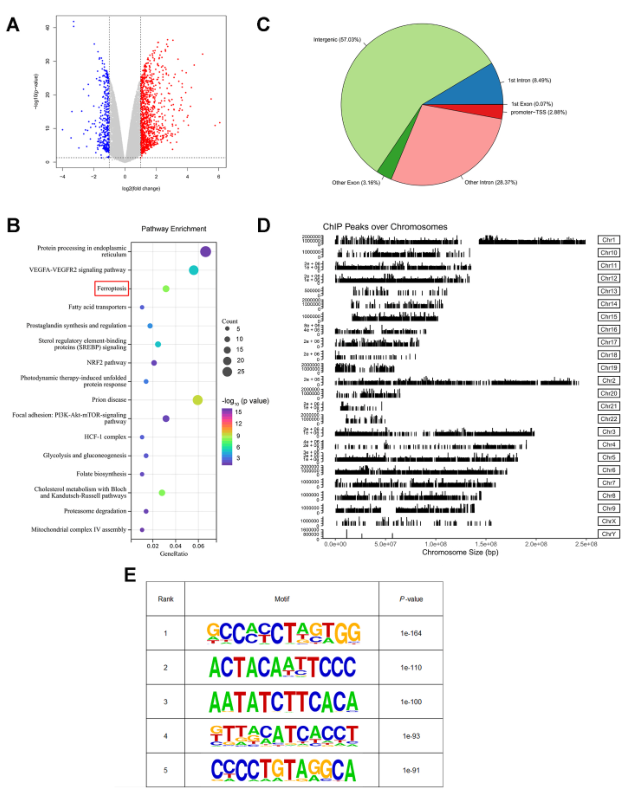
图6 RNA-seq和ChIP-seq鉴定ATF2的全基因组DNA结合位点和转录靶点
然后对RNA-seq和ChIP-seq数据进行交叉分析,筛选出222个受ATF2直接调控的候选转录靶标(图7A)。其中,HSPH1在ATF2敲除后显著下调(图7B)。此外,在TCGA数据集中,HSPH1在GC中的表达与ATF2呈显著正相关(图7C)。如图7D所示,ChIP-seq数据显示在HSPH1的启动子区域有明显的ATF2结合峰。因此,推测HSPH1可能是ATF2的潜在靶基因。WB分析结果显示,HSPH1在ATF2过表达后增加,而在ATF2敲除后减少(图7E)。此外,ChIP-qPCR进一步证实ATF2可以结合到HSPH1的启动子区域(图7F)。这些数据表明ATF2可以通过与HSPH1启动子结合来激活HSPH1的表达。
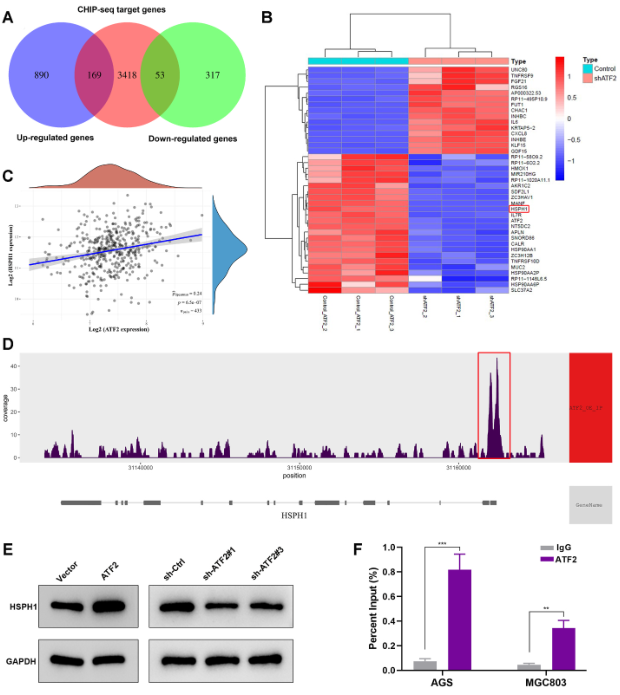
图7 ATF2与HSPH1启动子结合激活其转录
6、HSPH1与SLC7A11结合并增加其稳定性
鉴于一些研究报道了HSP蛋白在铁死亡中的突出作用,作者试图确定HSPH1是否可能影响SLC7A11在GC中的表达。首先查询了GeneMANIA数据库,其预测并显示了HSPH1和SLC7A11之间潜在的相互作用(图8A)。为验证这一预测,进行co-IP实验,确定HSPH1与SLC7A11存在物理相互作用(图8B)。接下来,采用siRNA敲除HSPH1的表达(图8C),并将HSPH1 siRNA转染到ATF2稳定过表达的AGS细胞中。观察到HSPH1的敲除降低了SLC7A11的蛋白表达水平,但没有降低mRNA水平(图8D)。因此,进行了CHX试验,以确定在HSPH1敲除或未敲除的情况下SLC7A11蛋白的半衰期。WB分析表明,与对照组相比,抑制HSPH1加速了AGS细胞中SLC7A11蛋白的降解(图8E)。这些结果表明,HSPH1可以与SLC7A11相互作用,并至少部分地通过增加SLC7A11蛋白的稳定性来增加其表达。
敲除HSPH1可以部分消除ATF2过表达对细胞ROS和脂质ROS的影响(图8F和G)。同样,与HSPH1 siRNA共转染可显著逆转ATF2过表达对铁死亡细胞MDA和GSH水平的影响(图8H和I)。这些结果为ATF2通过HSPH1调控索拉非尼诱导的GC细胞铁死亡提供了证据。

图8 HSPH1与SLC7A11结合并增加其稳定性
7、ATF2敲低增加小鼠GC肿瘤对索拉菲尼的敏感性
最后,为评估ATF2单独敲除和与索拉非尼联合敲除对体内GC的影响,建立了裸鼠异种移植模型(图9A)。与对照组相比,稳定敲除ATF2细胞形成的肿瘤体积更小,重量更轻,表明ATF2敲除可以有效抑制体内肿瘤的生长(图9B)。此外,索拉非尼治疗后,皮下肿瘤的体积和重量均显著进一步下降(图9C和D)。表明ATF2敲除联合索拉非尼治疗对肿瘤生长的抑制作用最强。为更好地观察潜在的铁死亡,皮下肿瘤切片被4-HNE染色,4-HNE是一种敏感的脂质过氧化标记物。IHC染色显示sh-ATF2+索拉非尼组4-HNE表达最高(图9E)。因此,ATF2敲除可增强索拉非尼对体内GC的抗肿瘤作用。
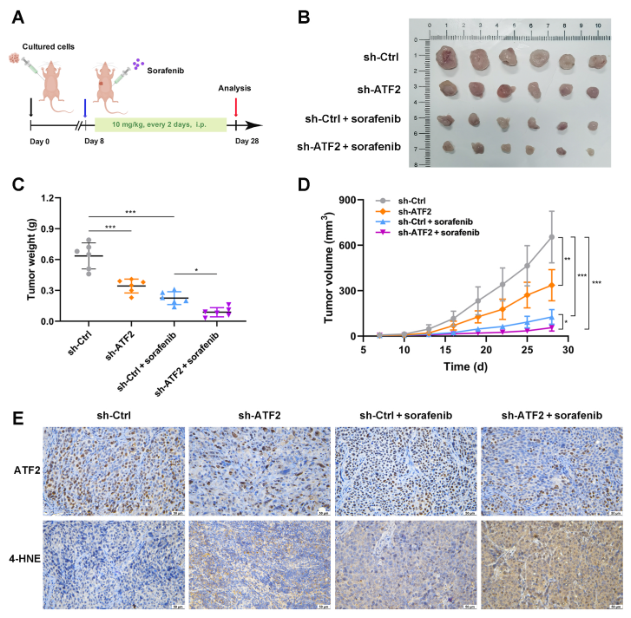
图9 ATF2敲低增加小鼠GC肿瘤对索拉菲尼的敏感性
总之,作者发现索拉非尼激活ATF2的表达,并进一步促进HSPH1的表达,减少SLC7A11蛋白的降解,从而导致了对脂质过氧化的保护(图10)。因此,以ATF2/HSPH1轴为靶点增强索拉非尼诱导的铁变态反应是一种有吸引力的GC治疗策略。

图10 图像摘要
实验方法
临床收集福尔马林固定石蜡包埋的GC样本,细胞培养,WB,qRT‒PCR,免疫组织化学染色,细胞增殖曲线,半数抑制浓度(IC50)实验,Transwell迁移和侵袭实验,Calcein-AM/PI染色,细胞内ROS和脂质过氧化检测,MDA和GSH检测,线粒体膜电位(MMP)检测,透射电镜实验(TEM),RNA测序,染色质免疫共沉淀(ChIP)测序,ChIP-qPCR,co-IP,蛋白质稳定性实验,小鼠肿瘤模型
参考文献
Xu X, Li Y, Wu Y, Wang M, Lu Y, Fang Z, Wang H, Li Y. Increased ATF2 expression predicts poor prognosis and inhibits sorafenib-induced ferroptosis in gastric cancer. Redox Biol. 2023 Feb;59: 102564. doi: 10.1016/j.redox.2022.102564.






