脂肪自噬在糖尿病神经性疾病中发挥关键作用

糖尿病产生慢性炎症和脂质代谢紊乱。小胶质细胞激活引起的神经炎症和神经损伤是糖尿病相关认知障碍(DACI)的突出特征。在本研究中,作者揭示了高糖(HG)抑制脂肪自噬促进小胶质细胞内脂滴(LDs)和骨髓细胞表达的触发受体1(TREM1)积累,积累的LDs与TREM1共定位反过来加剧HG诱导的脂肪自噬损伤,随后通过NLRP3炎症小体促进HG介导的神经炎症级联反应。而LP17对TREM1的药理学阻断抑制LD和TREM1积累,减少海马神经元的炎症损伤。该研究于2023年5月发表在《Autophagy》,IF:13.3。
技术路线













1. db/db小鼠和HFD/STZ小鼠海马体小胶质细胞中LDs积累和脂肪自噬受损
作者首先观察到LDs在大脑皮层和海马体中的积累显著增加(图1A)。用小胶质细胞标记物AIF1/IBA1、成熟星形胶质细胞标志物GFAP、神经元标记物RBFOX3/NeuN和PLIN2或BODIPY对冠状脑切片进行免疫染色。作者观察到LDs主要积累在小胶质细胞中,在星形胶质细胞和神经元中很少出现(图1A,1B)。作者之后的分析主要集中在海马体,因为它是评估认知功能的关键区域。瘦素受体缺陷(db/db)小鼠海马体中增加的PLIN2+ LDs与AIF1+小胶质细胞主要集中在CA3区域(图1A)。LDs免疫染色进一步证实增加的LDs主要分布在海马体CA3区域的小胶质细胞中(图1C)。
透射电镜结果显示,db/db小鼠海马体中LDs增加,脂肪自噬体减少(图1D)。免疫染色结果显示,在AIF1+海马体小胶质细胞中,MAP1LC3B/LC3点显著减少,而SQSTM1/p62点显著富集(图1E)。
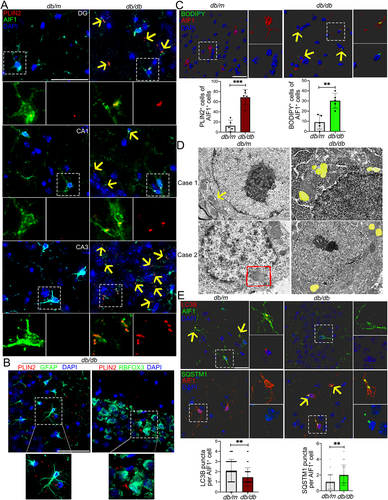
图1:低密度脂蛋白在db/db小鼠海马体小胶质细胞中积累和脂肪自噬受损
2. HG抑制脂肪自噬促进LDs在体外小胶质细胞中积累
作者用db/m和db/db小鼠收集的血浆处理BV2细胞。在db/db小鼠高血糖血浆处理的BV2细胞中,BODIPY阳性和PLIN2阳性的LDs显著增加(图2A)。接下来,作者使用含有不同浓度葡萄糖(5.5、25和50 mM)的DMEM培养基培养BV2细胞,并通过不同的培养时间点(24、48和72 h)来探索高糖是否在LDs积累中起关键作用。结果发现,在25和50 mM葡萄糖处理的BV细胞中观察到LDs呈时间依赖性积累,并在培养72 h后达到积累峰值(图2B)。因此,在接下来的体外实验中,作者均采用25 mM葡萄糖培养72 h。作者发现db/db小鼠血浆(图2C)和25 mM葡萄糖(图2D)处理的BV2细胞中LC3B点减少和SQSTM1点增加,这暗示脂肪自噬的减少。透射电镜结果也证实HG刺激BV2细胞中LDs积累和脂肪自噬损伤(图2E)。
然后,作者利用自噬抑制剂巴霉素A1(Baf)和活化剂雷帕霉素(RAPA)诱导BV2细胞。Baf显著诱导LC3B-II和SQSTM1表达水平,表明HG抑制脂肪自噬的开始,而不是自噬-溶酶体融合阶段(图2F)。RAPA则恢复HG受损的脂肪自噬(LC3B-II增加和SQSTM1减少)和LDs积累(PLIN2减少)(图2G),表明HG抑制脂肪自噬是LDs在BV2细胞中积累的原因。
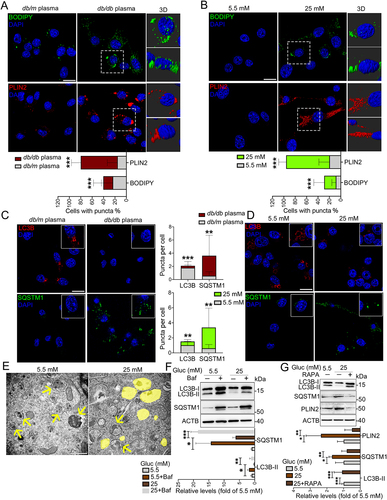
图2:HG抑制脂肪自噬是LDs在小胶质细胞中积累的原因。
3. T2DM老年患者血浆诱导人小胶质细胞HMC3中LDs积累并抑制脂肪自噬
接下来,作者使用T2DM(2型糖尿病)老年患者血浆和健康对照处理HMC3细胞进行体外实验。血清糖化ALB是代表过去2-4周平均血糖水平的血糖监测指标,T2DM患者的血清糖化ALB水平显著高于健康对照组(图3A)。用高血糖血浆处理后,HMC3细胞中PLIN2+ HMC3细胞百分比显著增加,以及SQSTM1点增加和LC3B点减少(图3B和C)。PLIN2+ HMC3细胞数量与DSST评分呈负相关(P=0.029)(图3D)。
作者用5.5 mM和25 mM葡萄糖处理HMC3细胞,观察到在HG处理的细胞中,PLIN2+ LDs和SQSTM1点数量显著增加,而LC3B点数量减少(图3E)。此外,HG诱导PLIN2和SQSTM1表达,并抑制LC3B-II的表达(图3F)。总之,研究结果表明,HG在体外和体内均损害小胶质细胞的脂肪自噬并触发LDs积累。
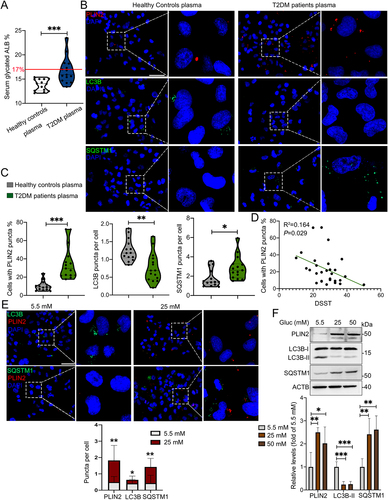
图3: T2DM老年患者血浆诱导LDs在人HMC3细胞中积累并抑制亲脂性
4. HG培养和高血糖血浆培养的小胶质细胞以及db/db小鼠和HFD/STZ小鼠的海马体小胶质细胞发生TREM1积累
小胶质细胞中TREM和TREML受体是调节炎症反应的关键受体。HG刺激后,HMC3(图4A)和BV2细胞中TREM1和TREM2 mRNA水平均显著降低。与mRNA降低水平相反,HG在HMC3细胞(图4B)和BV2细胞中显著诱导TREM1蛋白水平。接下来,作者发现db/db小鼠和db/m小鼠海马体中TREM1 mRNA表达没有显著差异,但db/db小鼠海马体中其蛋白表达明显提高(图4C)。免疫染色结果显示,在BV2细胞(图4D)和高血糖血浆处理的HMC3细胞(图4E)中,TREM1+细胞百分比显著增加。此外,TREM1+ HMC3细胞百分比与DSST评分呈负相关(P=0.00008)(图4E)。作者对T2DM点和对照小鼠脑切片进行免疫染色,发现在db/db和高脂肪饮食与STZ(HFD/STZ)小鼠海马体中,增加的TREM1与AIF1+小胶质细胞共染色(图4F)。
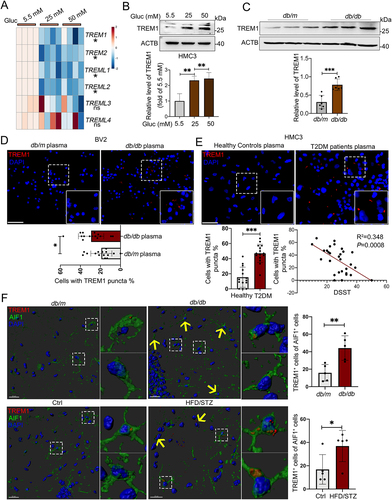
图4:高血糖血浆或HG培养的小胶质细胞和db/db小鼠海马体小胶质细胞中TREM1蛋白水平升高
5. 体内外小胶质细胞中HG诱导TREM1与LDs共定位
用T2DM患者血浆或HG培养后,TREM1点主要富集或重叠在HMC3细胞PLIN2+ LDs中(图5A和B)。在高血糖血浆培养的HMC3细胞中,TREM1簇和PLIN2+ LDs共定位显示出不同形态。如图5C所示,TREM1位于PLIN2+ LDs相邻区域(顶板),或部分重叠于PLIN2+区域(第二面板),或完全被PLIN2+ LDs吞没(第三面板)。此外,正在进行融合的LDs中也观察到TREM1簇富集。db/db小鼠血浆培养的BV2细胞中也观察到这些不同形态(图5D)。在db/db和HFD/STZ小鼠海马体小胶质细胞中,还检测到TREM1与PLIN2+ LDs共定位(图5E)。
接下来,作者对HMC3细胞进行co-IP,证实TREM1和PLIN2在HG环境中发生相互作用(图5F)。在HG处理的细胞中添加RAPA后,TREM1及其下游蛋白磷酸化脾脏酪氨酸激酶(SYK)表达显著下降(图5C)。这些发现表明,HG诱导TREM1与积累的LDs共定位可能有助于体内外小胶质细胞中TREM1的积累。
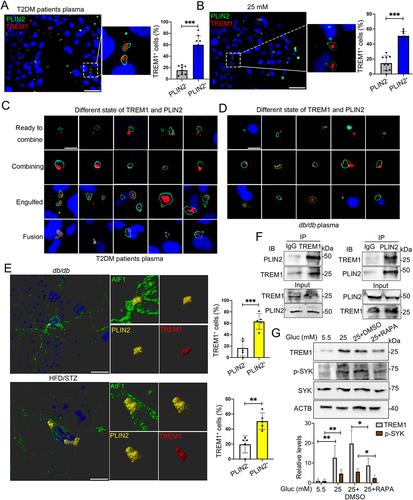
图5:HG在体内和体外诱导小胶质细胞中TREM1与LDs共定位。
6. HG刺激的小胶质细胞中TREM1通路抑制挽救脂肪自噬受损和LDs积累
TREM1在自噬中起关键作用。作者探索了HG诱导TREM1共定位以及随后TREM1高水平表达是否会反过来影响小胶质细胞脂肪自噬和LDs积累(图6A)。BV2细胞中TREM1经shRNA敲除显著降低磷酸化SYK表达,如LC3B-II水平增加以及SQSTM1和PLIN2水平降低所示(图6B),HG诱导的亲脂性损伤和LDs积累减少。然后用TREM1特异性抑制肽LP17共同处理HG诱导的BV2细胞。如图6C所示,LP17给药显著减少HG诱导的SQSTM1点和PLIN2点聚集,并恢复HG在BV2细胞中诱导的磷酸化SYK、LC3B-II、SQSTM1和PLIN3表达(图6D)。在HG诱导的HMC3细胞(图6E和F)中观察到LP17类似作用,这表明抑制TREM1可以恢复HG刺激小胶质细胞中脂肪自噬损伤和LDs积累。

图6:TREM1抑制恢复HG刺激的小胶质细胞中脂肪自噬损伤和LDs积累
7. db/db模型和HFD/STZ模型中TREM1的药理学阻断改善认知功能
接下来,作者验证TREM1在db/db模型和HFD/STZ认知障碍模型中的生物学功能。db/db和HFD/STZ小鼠腹膜内注射LP17。LP17给药2周后,通过Morris Water Maze(MWM)测试评估每只db/db小鼠的认知功能。LP17给药显著改善db/db小鼠平台穿越时间和在目标象限中花费的时间(图7A)。且注射LP17期间,平均游泳速度没有显著差异(图7B)。作者还评估了海马体神经元凋亡和突触可塑性。LP17给药显著减少db/db小鼠海马体中TUNEL+(末端脱氧核苷酸转移酶介导的dUTP生物素缺口末端标记)凋亡神经元数量。给予LP17显著恢复db/db小鼠海马体中下调的DLG4(突触后标志物)表达水平(图7C)。关于LP17对神经炎症的影响,在接受LP17的db/db小鼠中,促炎因子(NOS2、TNF、IL6和IL1B)产生显著降低(图7D)。最后,作者发现LP17显著减少db/db小鼠海马体CA3区域小胶质细胞中LDs积累,并促进细胞亲脂性,这与作者的体外结果一致(图7E和F)。
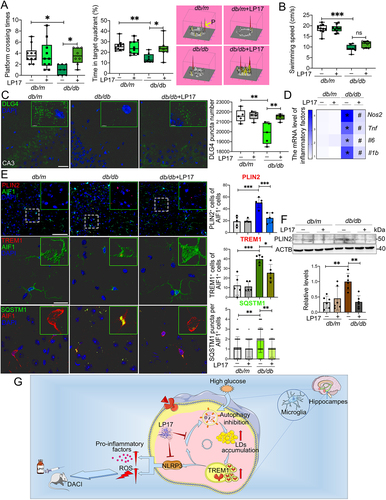
图7: db/db模型中TREM1经药物阻断能够改善认知功能,减少海马体神经元变性,抑制小胶质细胞炎症
结论
HG抑制的脂肪自噬是小胶质细胞内LDs积累的原因。LDs积累与小胶质细TREM1共定位,导致小胶质细胞TREM1积累,反过来加剧HG诱导的脂肪自噬损伤,随后通过NLRP3炎症小体促进HG介导的神经炎症级联反应。此外,在db/db小鼠和HFD/STZ小鼠中,LP17可药理学阻断TREM1从而抑制LDs和TREM1的积累,减少海马体神经元炎症损伤,从而改善认知功能。
实验方法
免疫染色,透射电镜,MWM测试,TUNEL评估,细胞体外培养,RT-qPCR,Western blotting ,Co-IP,ELISA,ROS试验
参考文献
Li Q, Zhao Y, Guo H, Li Q, Yan C, Li Y, He S, Wang N, Wang Q. Impaired lipophagy induced-microglial lipid droplets accumulation contributes to the buildup of TREM1 in diabetes-associated cognitive impairment. Autophagy. 2023 May 19:1-18. doi: 10.1080/15548627.2023.2213984. Epub ahead of print. PMID: 37204119.






