NUMA1通过调控ASK1-JNK信号通路调控食管鳞癌细胞凋亡
食管鳞状细胞癌(ESCC)是世界范围内常见的恶性肿瘤,由于缺乏治疗靶点,其生存率较低。本研究结果表明,NUMA1转录物和蛋白水平在ESCC患者样本中显著上调,其高表达预示着不良预后。敲低NUMA1可促进细胞凋亡,抑制细胞增殖和集落形成。通过使用细胞源性异种移植(CDX)和患者源性异种移植(PDX)小鼠模型,我们发现沉默NUMA1表达可抑制肿瘤进展。此外,有条件敲除NUMA1可减少4NQO诱导的小鼠食管癌变,进一步证实了NUMA1在ESCC中的致癌作用。机制上,我们通过免疫沉淀实验发现NUMA1与GSTP1和TRAF2相互作用,促进TRAF2与GSTP1的关联,抑制TRAF2与ASK1的相互作用,从而调节JNK的持续激活。综上所述,我们的研究结果表明,NUMA1在ESCC进展过程中发挥重要作用,它通过调节ASK1-MKK4-SAPK/JNK信号通路发挥作用。本文于2023年7月发表于“Cellular and Molecular Life Sciences”(IF=8)上。
技术路线

结果
1)NUMA1在人类ESCC中过表达,并与患者生存能力相关
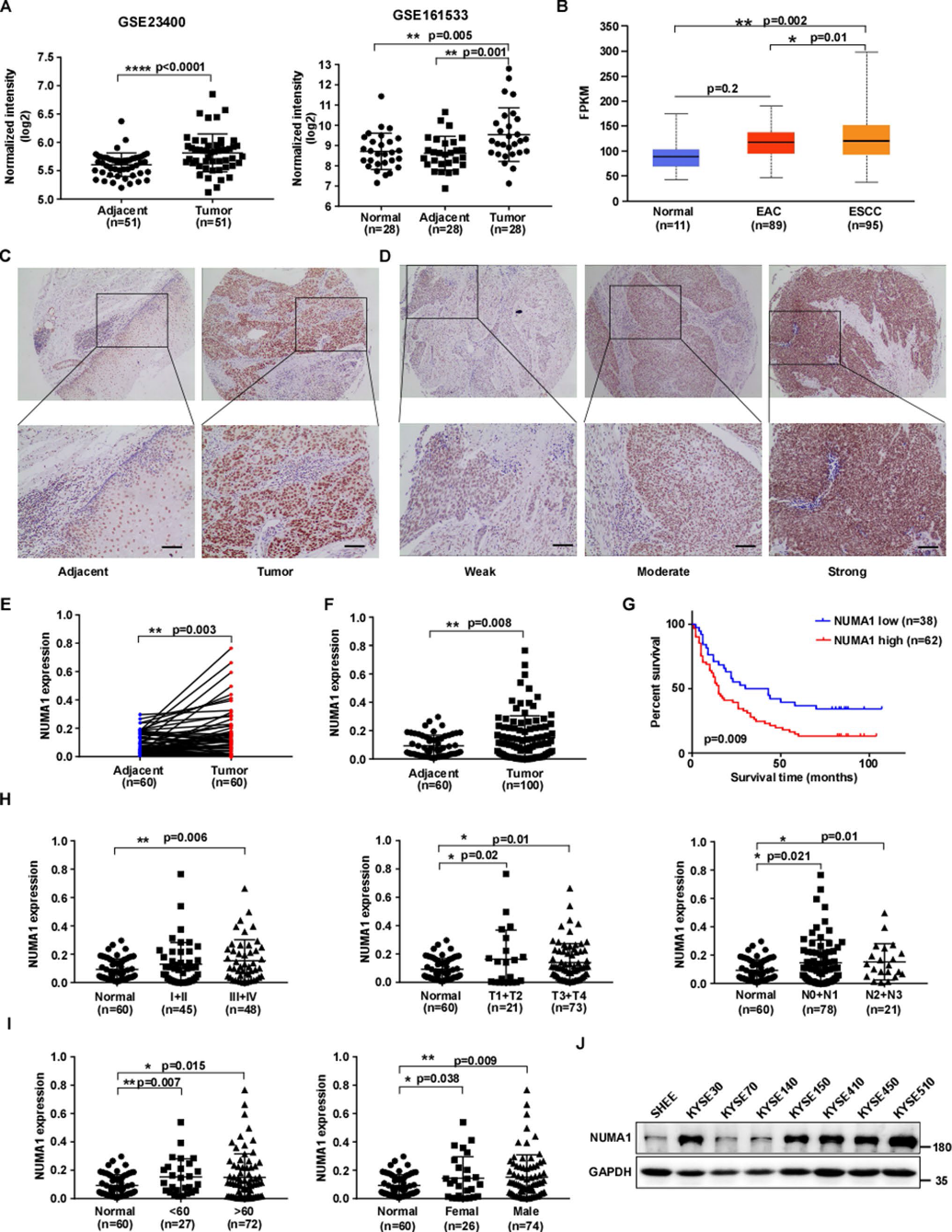
为了探索ESCC的潜在治疗靶点,我们利用两个ESCC微阵列数据集(GSE23400, GSE161533)分析了ESCC中高水平的基因表达。从数据集中,我们发现患者源性ESCC肿瘤组织中NUMA1的mRNA水平显著上调(图1A)。接下来,我们使用UALCAN评估TCGA数据库中的NUMA1表达信息,生物信息学分析结果显示,NUMA1 mRNA水平在ESCC中显著上调(图1B)。为了进一步探讨NUMA1在ESCC中的临床意义,我们通过免疫组织化学染色测量了ESCC组织微阵列中NUMA1的表达。与配对(图1C-E)和未配对(图1F)的邻近组织相比,肿瘤组织中NUMA1的表达明显升高。生存分析显示,NUMA1高表达患者总生存期较差,预后不良(图1G)。临床关联分析结果显示,NUMA1表达与临床分期、淋巴结转移、年龄、性别无显著相关性(图1H、图1I)。此外,我们还检测了NUMA1在不同ESCC细胞系和正常人永生化食管上皮细胞系中的表达。结果显示,与正常SHEE细胞相比,NUMA1在ESCC细胞系中的表达增加(图1J)。这些结果表明,NUMA1在ESCC组织中表达上调,预示着ESCC患者预后不良。
2)NUMA1的沉默降低了体外细胞的增殖,延缓了体内肿瘤的生长
为了研究NUMA1在ESCC细胞中的作用,我们构建了针对NUMA1和scramble control的慢病毒shRNA,并感染ESCC细胞。Western blot结果显示,NUMA1表达明显降低(图2A)。在KYSE450、KYSE510和KYSE150细胞中敲除NUMA1后,细胞增殖和集落形成明显受到抑制(图2B-D)。此外,我们通过转染flag-NUMA1质粒,在KYSE30、KYSE150和KYSE410细胞系中过表达NUMA1,并通过Western blot和qPCR证实了其表达(图2E)。过表达NUMA1显著增加细胞增殖和集落形成(图2F-H)。为了进一步探讨NUMA1在体内是否能促进肿瘤生长,我们将沉默NUMA1表达或scramble对照的KYSE450细胞皮下注射到裸鼠体内。结果显示,沉默NUMA1表达可显著抑制肿瘤在体内的生长(图2I-K)。与scramble对照组相比,肿瘤生长速度、肿瘤体积和肿瘤重量均明显降低,但体重无显著差异(图2I-K)。此外,在shNUMA1组中,NUMA1的表达显著降低,SAPK/JNK (Thr183/Tyr185)的磷酸化水平上调(图2L)。CDX小鼠切除肿瘤的免疫组化染色结果也显示,NUMA1敲低组的Ki67和NUMA1表达降低,而NUMA1沉默组的SAPK/JNK和c-Jun的磷酸化水平显著上调(图2M-N)。总之,这些结果表明,NUMA在ESCC的进展过程中起着至关重要的作用,并与SAPK/JNK (Thr183/Tyr185)的激活有关。

3)沉默NUMA1表达可促进ESCC细胞凋亡和细胞周期阻滞
为了评估NUMA1对细胞凋亡的贡献,在沉默NUMA1表达后,我们通过TUNEL实验和膜联蛋白-V染色检测细胞凋亡。TUNEL实验结果显示,敲除NUMA1表达后,细胞凋亡明显被诱导(图3A)。此外,流式细胞术分析结果也显示,NUMA1敲除细胞组凋亡细胞数量增加(图3B)。然后,我们通过Western blot检测促凋亡和抗凋亡标志物的表达。敲低NUMA1可上调cleaved-PARP、cleaved caspase-3和Bim短异构体的表达,下调Bcl-2的表达(图3C)。接下来,我们在KYSE450和KYSE510细胞中检测了敲除NUMA1后的细胞周期分布,流式细胞术分析结果显示显著诱导G1期阻滞(图3D)。此外,我们检测了与细胞周期G1期相关的蛋白的表达,与scramble对照组相比,NUMA1沉默降低了cyclin D1和cyclin D3的表达(图3E)。这些结果表明,在ESCC中缺乏NUMA1可通过相关生物标志物的调控诱导细胞凋亡和G1细胞周期阻滞。

4)NUMA1条件敲除抑制4NQO诱导的小鼠食管癌变
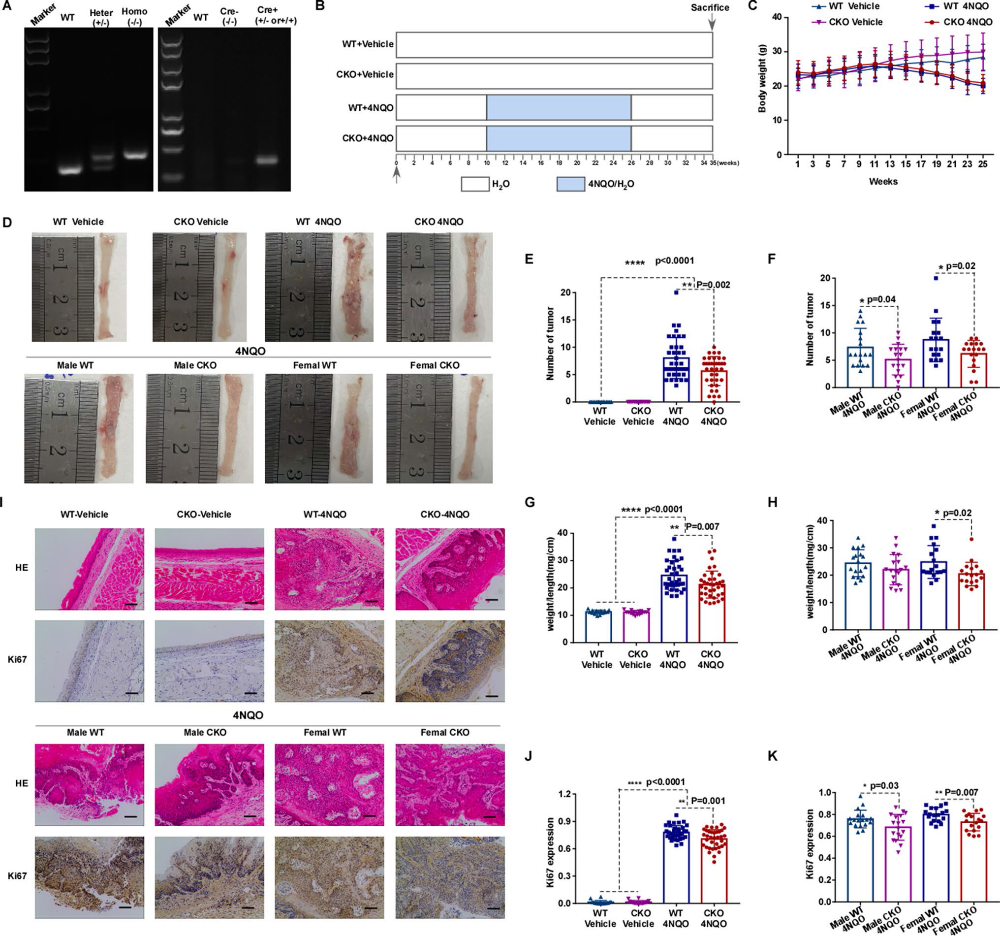
在4NQO诱导的食管癌模型中,我们制备了野生型(WT、flox纯合、Cre基因阴性)和NUMA1条件敲除型(CKO、flox纯合、Cre基因阳性)小鼠,以确定NUMA1缺失是否能延缓食管癌的发生或肿瘤的进展。首先对NUMA1 flox杂合子(Heter)、flox纯合子(Homo)、Cre基因阳性(Cre +)、Cre基因阴性(Cre−)进行PCR基因分型(图4A)。然后根据原理图(图4B)对小鼠进行分组处理。与Vehicle组相比,4NQO处理的小鼠体重明显减轻(图4C)。此外,与WT对照组相比,NUMA1 CKO小鼠的肿瘤发生更低(图4D-F)。WT组的体重与长度之比显著高于NUMA1 CKO组,尤其是雌性NUMA1 CKO组(图4G-H)。经4NQO治疗后,我们发现WT小鼠食管切片发育不良较CKO组更为严重,部分小鼠已发生原位癌和浸润性癌。与此一致的是,Ki67水平在肿瘤负荷较高的食管组织中高表达(图4I-K)。这些数据表明,NUMA1作为癌基因,加速ESCC的癌变,促进4NQO诱导的肿瘤发展。
5)NUMA1与GSTP1相互作用,促进GSTP1与TRAF2相互作用
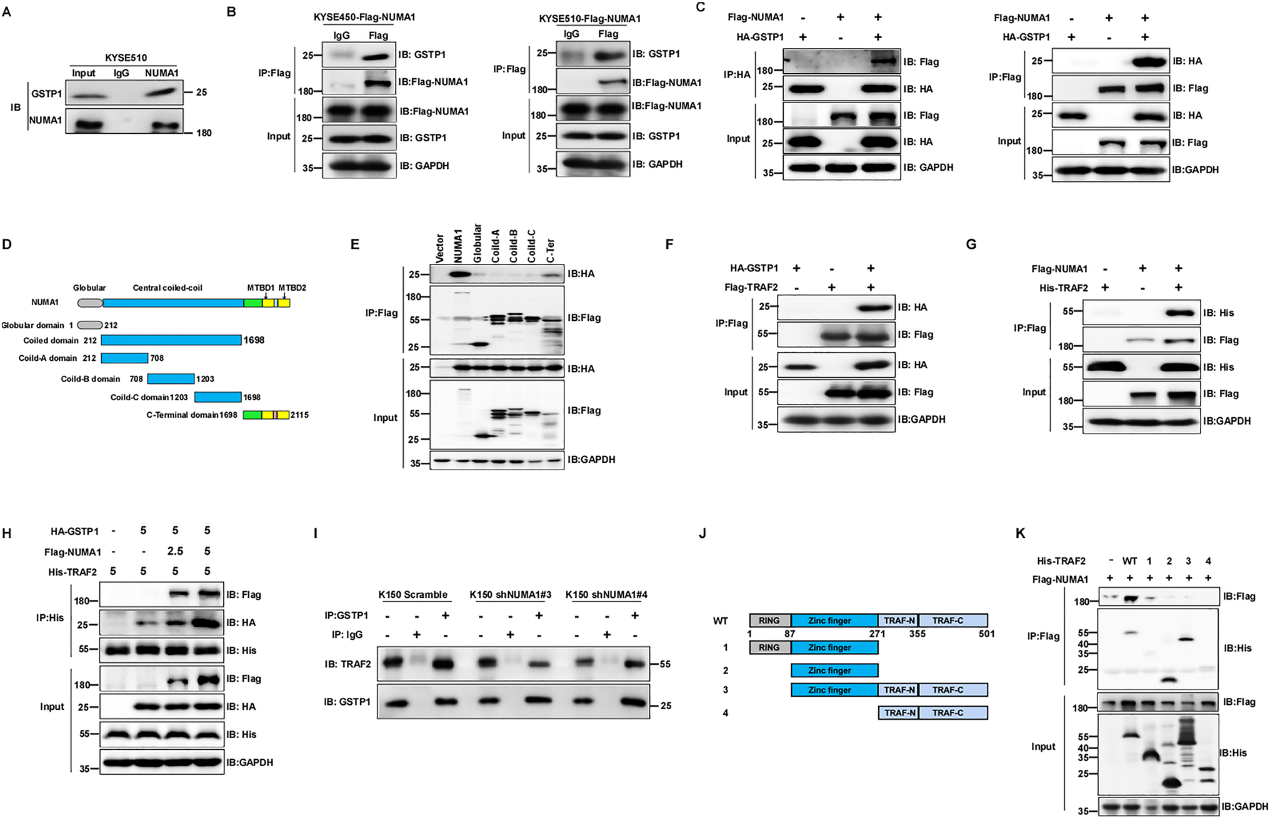
为了确定NUMA1的潜在致癌作用及其分子机制,我们继续使用co-IP(共免疫沉淀)试验和LC-MS /MS分析来探索NUMA1在ESCC中的潜在底物。我们发现GSTP1是MS评分最高的蛋白。我们进一步进行了co-IP分析,以确认GSTP1是否与NUMA1相互作用。结果显示,内源性NUMA1可以在KYSE510细胞中沉淀内源性GSTP1(图5A)。此外,我们在KYSE450和KYSE510细胞中异位表达NUMA1,co-IP结果显示Flag-NUMA1可以沉淀内源性GSTP1(图5B)。我们还在KYSE150细胞中异位表达NUMA1和GSTP1进行了co-IP实验,发现Flag-NUMA1可以沉淀HA-GSTP,反之亦然(图5C)。为了鉴定与GSTP1相关的NUMA1结构域,我们构建了一系列Flag标记的NUMA1结构域缺失突变体,如图5D所示。使用Flag磁性琼脂糖的co-IP分析结果显示,NUMA1的c端结构域负责与GSTP1的相互作用(图5E)。我们通过外源性免疫沉淀证实了GSTP1与TRAF2的相互作用,GSTP1确实与TRAF2相互作用(图5F)。然后,我们通过外源性免疫沉淀研究了NUMA1是否可以与TRAF2结合。结果显示,NUMA1与TRAF2相互作用(图5G)。此外,我们探索了NUMA1与GSTP1结合是否会影响GSTP1与TRAF2的关联。结果显示,NUMA1表达的增加促进了TRAF2和GSTP1之间的相互作用(图5H)。相反,减少NUMA1的表达减少了GSTP1和TARF2之间的内源性联系(图5I)。我们进一步研究了TRAF2的哪个结构域可以与NUMA1结合,构建了一系列带有His标记的TRAF2结构域缺失突变体,如图5J所示。结果显示,TRAF2的锌指基元直接与NUMA1结合(图5K)。这些发现表明,NUMA1与GSTP1和TRAF2相互作用,并促进TRAF2与GSTP1相互作用。
6)NUMA1通过与TRAF2和GSTP1结合调控ASK1‑MKK4‑SAPK/JNK信号
以上结果促使我们进一步研究NUMA1对ASK1-MKK4-SAPK/JNK信号通路的调控作用。我们研究了NUMA1的哪个结构域负责与TRAF2结合。Co-IP结果显示,球状结构域、c端结构域和部分卷曲结构域与TRAF2相互作用(图6A)。接下来,我们研究了TRAF2中负责与GSTP1相互作用的结构域。结果显示,TRAF2的RING finger motif和TRAF结构域都与GSTP1相互作用(图6B)。我们进一步发现,NUMA1可以显著下调ASK1免疫沉淀TRAF2的量(图6C)。而且,NUMA1表达的增加更显著地降低了TRAF2与ASK1之间的关联(图6D)。综上所述,NUMA1可以促进TRAF2与GSTP1的相互作用,抑制TRAF2与ASK1的相互作用。为了进一步确定NUMA1对ASK1-MKK4-SAPK/JNK信号传导的影响,我们测量了敲除或过表达NUMA1后ESCC细胞中MKK4和JNK的磷酸化状态。敲除NUMA1后,MKK4、JNK和c-Jun的磷酸化水平升高,而GSTP1和TRAF2的表达水平没有变化(图6E)。相反,KYSE150细胞中过表达NUMA1抑制SAPK/JNK和c-Jun的磷酸化(图6F)。此外,我们发现MKK4和JNK磷酸化水平显著下调(图6G)。NUMA1与TRAF2和GSTP1过表达显著抑制MKK4和JNK的激活(图6H)。这些结果表明,NUMA1通过调节TRAF2和GSTP1的相互作用来调节ASK1-MKK4SAPK/JNK信号通路。

7)GSTP1介导NUMA1在ESCC中的致癌作用
为了进一步验证GSTP1在人ESCC中的功能,我们生成了GSTP1敲除细胞(图7A),并评估了细胞增殖和集落形成。沉默GSTP1表达可显著抑制ESCC细胞增殖和集落形成(图7B-D)。此外,我们检测了GSTP1敲除后的信号级联,发现MKK4和JNK磷酸化水平上调(图7E)。为了研究GSTP1是否介导了NUMA1在ESCC中的致癌作用,我们进行了拯救实验。转染载体或flag标记的NUMA1的KYSE30和KYSE150细胞分别被scramble和shGSTP1慢病毒感染(图7F)。与对照细胞相比,过表达NUMA1显著增加了细胞的增殖和集落形成,而GSTP1的敲除部分地挽救了这一现象(图7G, H)。此外,沉默NUMA1表达后细胞增殖和集落形成明显受到抑制,而GSTP1过表达部分挽救了这种表型(图7I-K)。综上所述,这些结果表明GSTP1介导了ESCC细胞中NUMA1的致癌功能。

8)在ESCC患者来源的异种移植小鼠模型中,沉默NUMA1表达延迟肿瘤生长
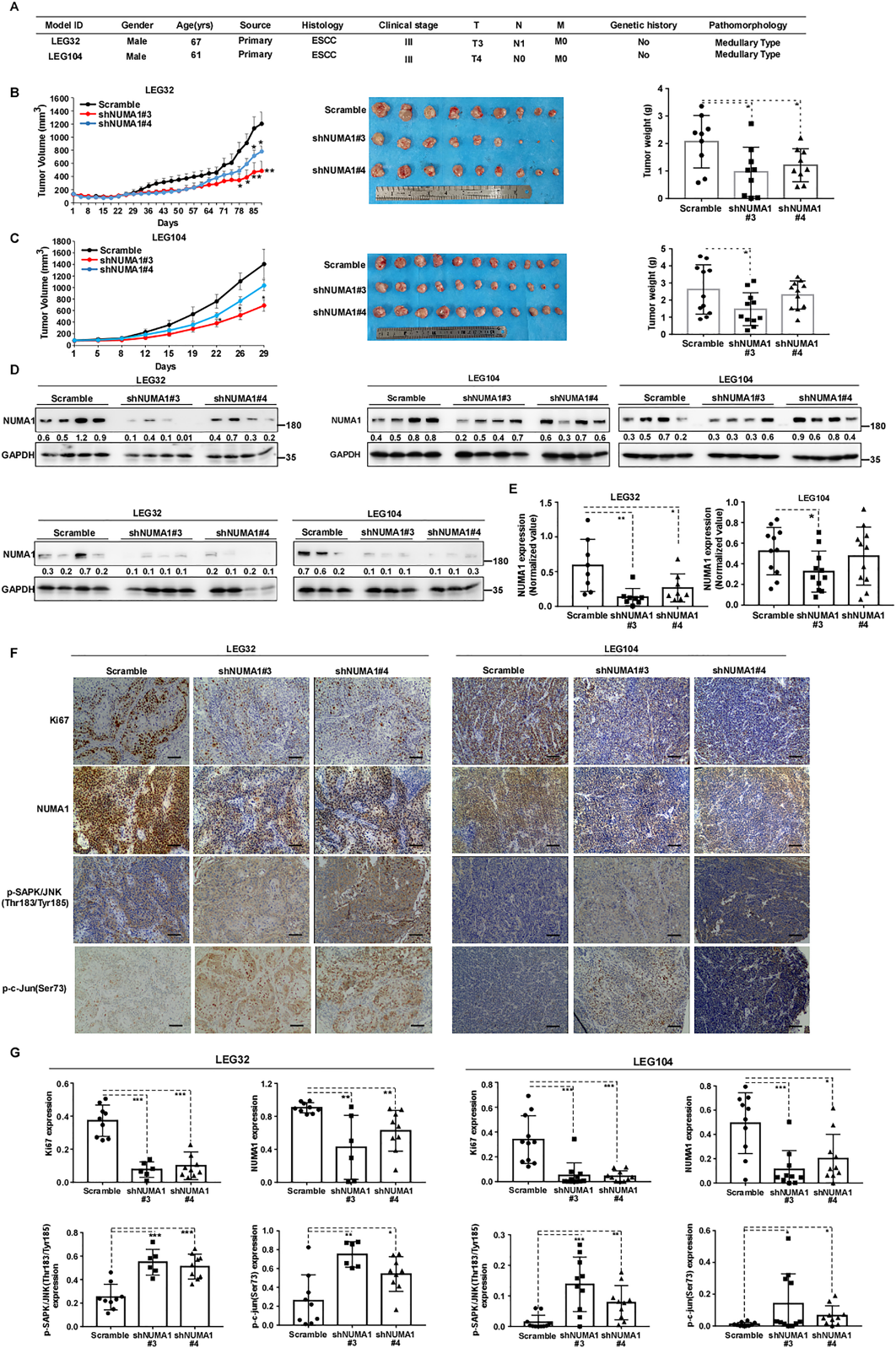
为了进一步评估NUMA1对ESCC体内进展的影响,我们建立了PDX小鼠模型,并进行了慢病毒介导的NUMA1敲除。图8A结果显示了LEG32和LEG104的患者特征。敲低NUMA1显著延缓了肿瘤生长,肿瘤体积和肿瘤重量较对照组显著下调(图8B, C)。此外,与scrambled对照组相比,NUMA1的表达明显下调(图8D, E)。免疫组化分析结果显示,NUMA1和Ki67的表达降低,p-SAPK/ JNK (Thr183/Tyr185)和p-c-Jun (Ser73)的表达显著诱导(图8F, G)。这些发现表明,抑制NUMA1的表达可延缓ESCC PDX肿瘤的体内生长。
结论
NUMA1通过调节GSTP1、TRAF2和ASK1复合物促进ESCC进展。它可能被认为是ESCC治疗的潜在靶点。
实验方法
MTT试验,WB,免疫共沉淀,LC–MS/MS,细胞周期分析,凋亡分析,免疫组化,CDX小鼠模型构建,PDX小鼠模型构建。
参考文献
Yin S, Zhao S, Li J, Liu K, Ma X, Zhang Z, Wang R, Tian J, Liu F, Song Y, Song M, Zhao R, Yang R, Lee MH, Dong Z. NUMA1 modulates apoptosis of esophageal squamous cell carcinoma cells through regulating ASK1-JNK signaling pathway. Cell Mol Life Sci. 2023 Jul 18;80(8):211. doi: 10.1007/s00018-023-04854-0.






