巨噬细胞参与卵巢癌化疗耐药的机制
背景
接近70%的卵巢癌(OC)患者在接受一线治疗后仍然会复发,并且肿瘤对含铂化疗会有很强的耐药性。因此探究卵巢癌铂类化疗耐药的机制是很有必要的。circRNA通过不同的功能机制,包括miRNA海绵、RNA结合蛋白(RBP)相互作用、基因转录和翻译调节因子以及编码功能肽,在癌症的增殖、转移和化疗耐药中发挥着关键作用。本文于2022年3月发表于《Journal for ImmunoTherapy of Cancer》,IF=10.9。
技术路线
结果
1.circITGB6水平升高与卵巢癌化疗耐药和不良预后相关
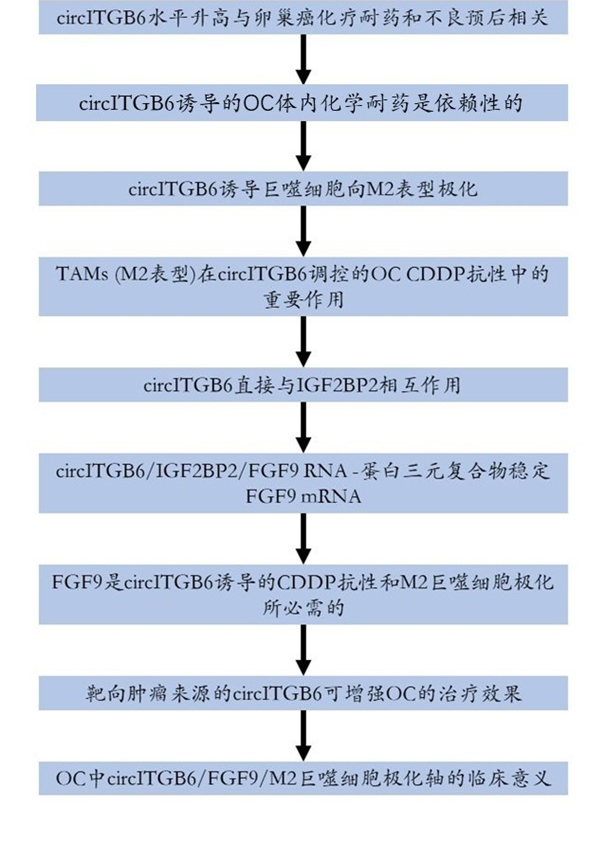
CircRNA-seq显示,与化疗敏感OC组织相比,化疗耐药OC组织中共有30个circRNA发生显著改变(图1a)。为进一步鉴定与顺铂(CDDP)耐药相关的circRNAs,作者采用实时荧光定量PCR (qRT-PCR)技术检测了40OC组织中前10位上调circRNAs的表达水平。来自化疗耐药的OC患者的肿瘤比来自未表现出术后CDDP耐药的患者的肿瘤显示出明显更高的circITGB6表达,而其他9种circRNA则没有(图1b)。作者还检测OC组织和正常卵巢上皮组织中的circITGB6水平,结果显示OC组织中的circITGB6水平明显高于正常组织(补充图1B)。值得注意的是,与CDDP敏感的OC患者和正常对照相比,CDDP耐药OC患者血清中的circITGB6表达水平显著上调(图1c)。此外,与肿瘤circITGB6低表达的患者相比,CDDP显著上调肿瘤circITGB6水平的OC患者总体生存期相对较低,复发率较高。因此,circITGB6的高表达可能是一个预后因素(图1D、E)。随后,作者对circITGB6的结构进行了表征,发现它是由整合素亚基β 6 (ITGB6)的外显子10和11的反剪接形成的(图1F)。如图1G所示,circITGB6扩增产物仅在cDNA中通过发散引物检测到;没有从基因组DNA (gDNA)中扩增产物(图1G)。高稳定性是circRNA的一个关键特征因此,为了验证circRNA的稳定性,作者使用RNase R外切酶对RNA进行预处理。结果表明,环状ITGB6对RNase R具有抗性,而线状ITGB6 RNA经RNase R处理后降解明显(图1H)。此外,circITGB6的半衰期明显长于线性ITGB6 mRNA(图1I,J)。然后,作者进行细胞核和细胞质RNA提取和FISH检测,circITGB6主要定位于OC细胞的细胞质中(图1K, L)。
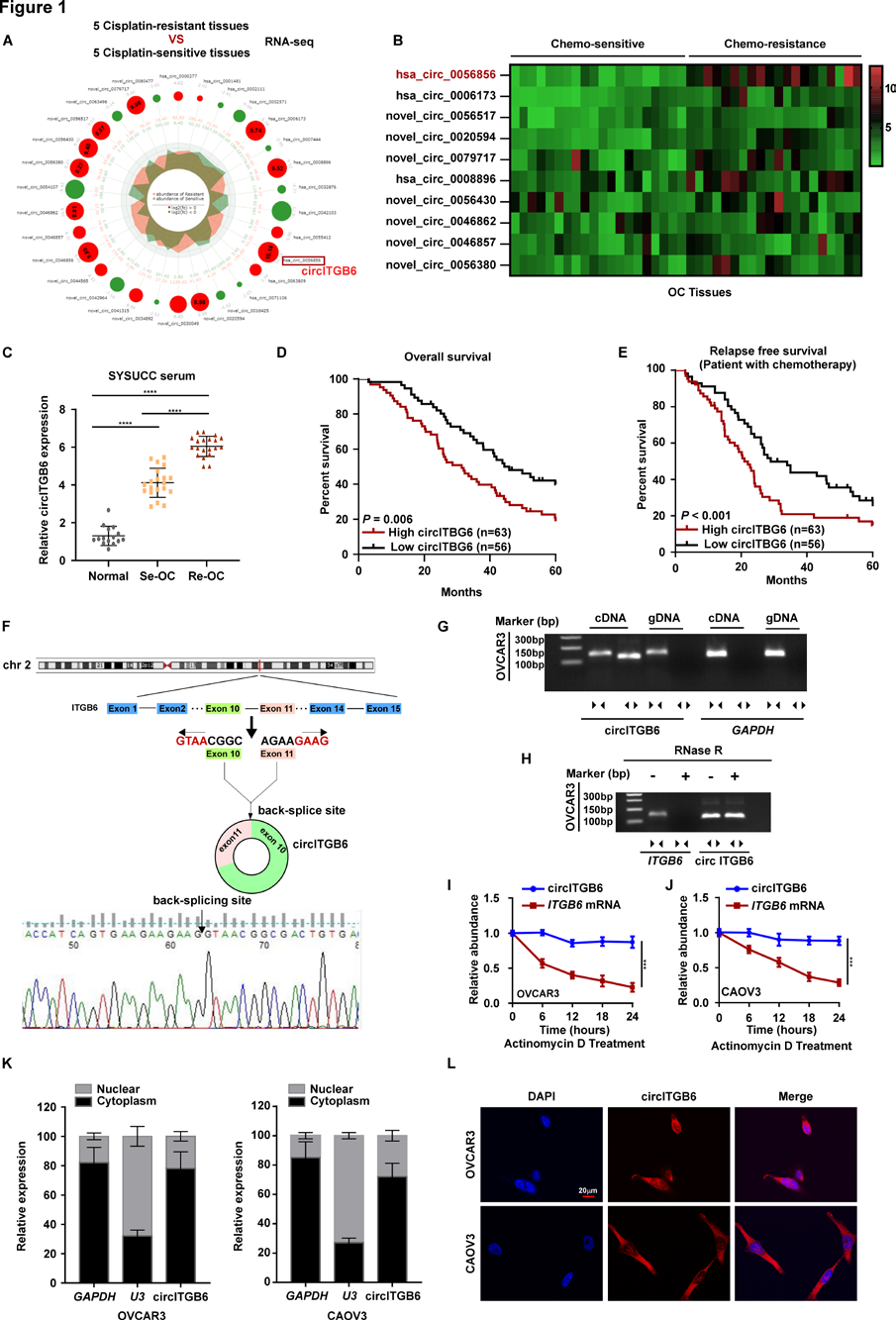
图1 circITGB6水平升高与卵巢癌化疗耐药和预后不良相关
2.circITGB6诱导的OC体内化学耐药是依赖性的
鉴于circITGB6在OC CDDP耐药中的重要临床相关性,作者探索circITGB6在这一过程中的体内功能作用。CircITGB6通过circITGB6过表达质粒成功上调,转染sh-circITGB6后表达下调,靶向circITGB6的反剪接区。为评估circITGB6在OC中的功能,将荧光素酶标记的circITGB6过表达或低表达的ID8细胞腹腔注射到雌性C57BL/6小鼠中。CDDP处理后,circ ITGB6过表达组小鼠荧光素酶信号明显强于对照组,出血性腹水明显增多;相比之下,作者检测到sh-circITGB6组的荧光素酶活性明显低于对照组,出血性腹水较少(图2A-C)。此外,在CDDP处理下,circITGB6过表达组小鼠的生存时间短于vector control组小鼠,circ ITGB6沉默细胞小鼠的生存时间长于control组小鼠(图2D)。免疫组化(IHC)结果显示,在CDDP处理下,随着circITGB6上调(通过原位杂交(ISH)评估),KI-67+癌细胞数量显著增加,TUNEL+ (TdT介导的dUTP Nick End Labeling)细胞数量显著减少(图2E-H)。然而,circITGB6是否通过与宿主免疫系统相互作用调动了其他抗肿瘤机制来发挥其抗肿瘤作用尚不清楚。有趣的是,在严重免疫缺陷的NCG小鼠中,作者发现CDDP对ID8 OC细胞的抗肿瘤作用丧失(图2I-K)。此外,作者进行了一系列体外研究,发现与对照细胞相比,circ ITGB6过表达细胞和circ ITGB6敲低细胞在CDDP处理下,CDDP的半最大抑制浓度(IC50)和集落形成能力都没有显著变化(图2L、M)。此外,作者发现,与单一培养的对照细胞相比,circ ITGB6过表达或circ ITGB6沉默的细胞中CDDP诱导的凋亡没有明显减少或增加(图2N,O)。
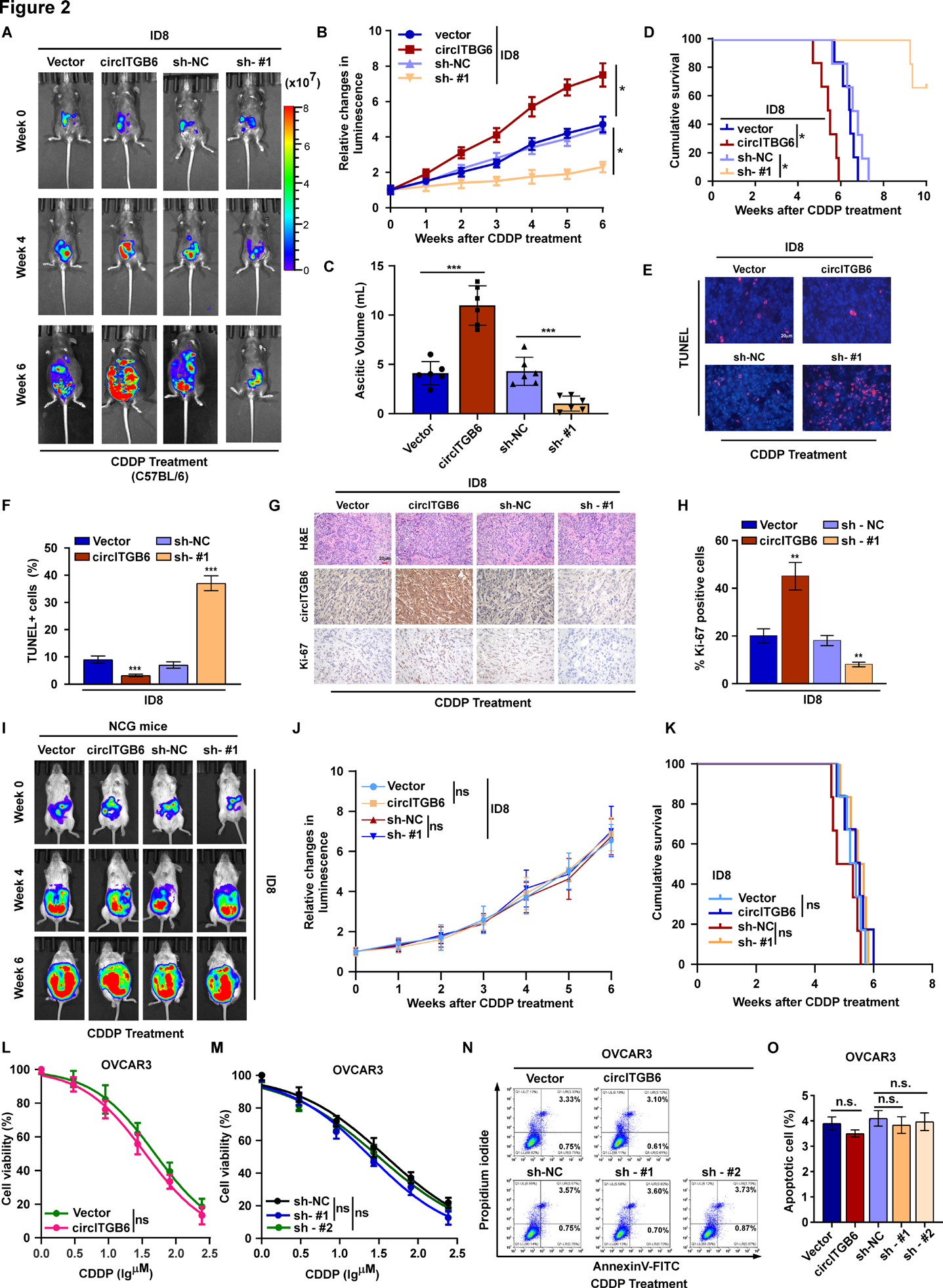
图2 circITGB6诱导的OC体内化疗耐药是依赖性的
3.circITGB6诱导巨噬细胞向M2表型极化
由于这一发现与C57BL/6小鼠中circ ITGB6诱导的CDDP耐药不一致,作者进一步探讨了OC中是否有其他关键因素导致CDDP耐药。癌症免疫学的最近的新进展表明,癌症的治疗耐药性也在很大程度上取决于癌细胞与TME的其他浸润细胞组分(特别是免疫细胞)之间的串扰介导的外在机制。为了探索circITGB6表达调节肿瘤组织中浸润性免疫细胞与癌细胞相互作用的可能性,作者进行了基于bulk RNA-seq的细胞富集分析(xCell)。有趣的是,在不同类型的浸润性免疫细胞中,巨噬细胞与circITGB6表达呈显著正相关(图3A)。此外,最近的研究报道,TAM是OC TME中占优势的浸润免疫细胞群,它们不仅促进肿瘤血管生成和转移,而且诱导化疗耐药和抑制抗肿瘤免疫反应。具有M2表型的巨噬细胞具有内在的促肿瘤作用。作者发现巨噬细胞耗竭破坏了CDDP对ID8 OC生长的抗肿瘤作用(图3B)。
此外,进一步确定了circITGB6在其他基质细胞(包括CD8+ T细胞和Treg细胞)中的潜在作用。这些结果表明circITGB6起源于OC细胞而不是基质免疫细胞。重要的是,与铂敏感的OC患者相比,铂耐药患者的M2型巨噬细胞明显增加,但TCGA数据中M1型和M0型巨噬细胞无差异(图3C-E)。临床意义与此一致的是,ISH显示circITGB6在CDDP耐药OC标本中与CDDP敏感标本相比显著上调(图3F、G)。值得注意的是,CD206染色显示,在circITGB6高表达的OC组织中,浸润的M2巨噬细胞(CD206+巨噬细胞)数量显著增加(图3F - h)。此外,相关分析表明,CDDP应答状态和circITGB6高表达与OC中CD206+巨噬细胞浸润呈正相关(图3I、J)。因此,这些结果表明,circITGB6上调可能通过将TAM极化向M2表型重置而促进OC中CDDP抗性。接下来,作者研究了单核细胞能否通过条件培养基(CM)从稳定转染circITGB6、sh-circITGB6#1或对照细胞的CM的OVCAR3细胞中分化成M2型巨噬细胞(图3K)。荧光活化细胞分选分析(FACS)显示,白细胞间素(IL)4处理组CD206+巨噬细胞百分比高于未处理组,而HLADR+巨噬细胞主要在干扰素γ (IFN-γ)和脂多糖(LPS)处理后诱导(图3L,M)。用circ ITGB6过表达OVCAR3细胞的CM处理巨噬细胞,与对照组的CM相比,可诱导更多的CD206+巨噬细胞和更少的HLA-DR+巨噬细胞(图3N,O)。此外,作者收集了OC患者的血清,包括6例高circITGB6表达的OC患者和6例低circITGB6表达的OC患者,他们的OC组织进行了ISH评估。作者用血清处理从健康女性供体获得的外周血单核细胞(PBMC)来源的单核细胞(图3P)。与低circITGB6-OC患者源性血清相比,高circITGB6-OC患者源性血清诱导CD206+巨噬细胞百分比更高,HLA-DR+巨噬细胞百分比更低(图3Q-T)。因此,来自circITGB6高表达或低表达患者的血清中的因子诱导的巨噬细胞极化与来自circITGB6高表达或低表达OC细胞的CM诱导的巨噬细胞极化相似。接下来,作者在体内进一步研究了肿瘤来源的circITGB6对M2巨噬细胞极化的影响,发现肿瘤组织中较高水平的circITGB6伴随着F4/80+ CD206+ TAMs (M2)的较高浸润和F4/80+ CD80+ TAMs (M1)的较低浸润(图4O,P)。
图3 CircITGB6诱导巨噬细胞向M2表型极化
4.TAMs (M2表型)在circ ITGB6调控的OC CDDP抗性中的重要作用
为了评估m2型巨噬细胞的存在如何在功能上教育OC细胞诱导化疗耐药,作者用双条件培养基(DCM)处理细胞(图4A)。原代人PBMC来源的CD14+单核细胞从健康供体中分离出来进行进一步探索。首先用稳定转染circ ITGB6载体、sh-circITGB6#1或sh-circITGB6#2的OC细胞衍生的CM刺激原代人巨噬细胞24小时,然后在新鲜培养基中孵育24小时(DCM)。然后使用该DCM用CDDP处理亲代OC细胞进行进一步的体外检测。与对照OVCAR3/CAOV3细胞相比,sh-circITGB6#1或sh-circITGB6#2 OVCAR3/CAOV3细胞DCM处理亲本OC细胞中CDDP的IC50值显著降低(图4B,C)。此外,在CDDP给药的亲代OC细胞中,与对照细胞源性DCM孵育相比,在circITGB6沉默的OC细胞衍生的DCM孵育中,CDDP诱导的凋亡死亡和集落形成受损明显更大(图4d - 1)。CDDP DNA加合物的形成和持续对CDDP诱导的癌细胞死亡至关重要。与从circITGB6对照细胞中获得的DCM处理的细胞相比,circITGB6沉默的OVCAR3/CAOV3 DCM处理的亲本OC细胞中CDDP诱导的γ-H2AX灶的数量显著增加(图4J,K)。此外,在与circ ITGB6沉默OC细胞衍生的DCM孵育的亲代OC细胞中,ABCB1和ABCG2等化学耐药相关基因的表达急剧下降,而cleaved caspase 3和聚adp核糖聚合酶(PARP)的表达急剧增加(图4L)。此外,作者在骨髓源性巨噬细胞和OC细胞共培养系统中发现了一致的结果(图4M,N)。癌细胞中药物积累的减少被认为是促进CDDP耐药的主要机制。
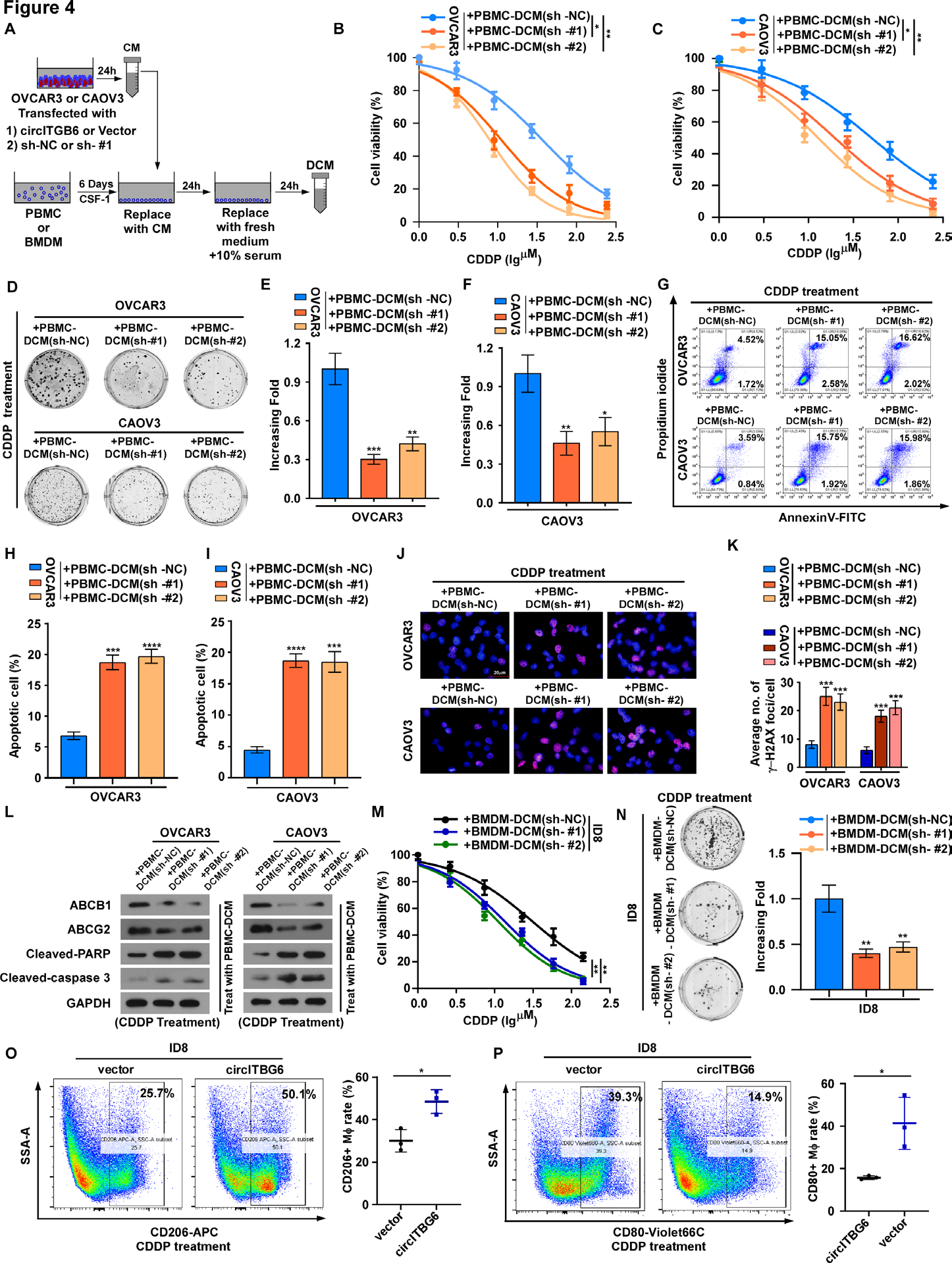
图4 TAMs (M2表型)在circitgb6调控的OC CDDP抗性中的重要作用。
5.circITGB6直接与IGF2BP2相互作用
为了研究circITGB6诱导TAM M2极化的潜在机制,作者使用生物素化circITGB6和对照探针作为阴性对照,进行了RNA拉下实验,然后进行了质谱(MS)分析,以筛选circITGB6相互作用蛋白(图5A - C)。作者发现IGF2BP2是一种可能直接与circITGB6结合的蛋白,据报道对调节mRNA稳定性至关重要(图5A和C)。RIP实验证实circITGB6和IGF2BP2之间存在相互作用(图5D)。作者使用免疫荧光-荧光原位杂交(IF-FISH)检测circITGB6和IGF2BP2的亚细胞定位,IF-FISH图像显示circITGB6和IGF2BP2在细胞质中共定位(图5E)。这些数据表明circITGB6/IGF2BP2在细胞质中形成RNA -蛋白复合物。此外,作者探索了IGF2BP2的哪个结构域促进了与circITGB6的相互作用。使用具有KH结构域截断的IGF2BP2突变体。RIP实验显示IGF2BP2的KH1-2双结构域特异性结合circITGB6,表明KH1-2双结构域是与circITGB6相互作用所必需的(图5F,G)。先前的研究报道,序列CAUH (H=A, C或U)是IGF2BP2仅有的共识识别基序。根据这些结果,通过浏览circITGB6的外显子10-外显子11连接序列,作者发现位于该序列中的CAUC基序是IGF2BP2的推定结合基序(图5H,顶部)。此外,通过电泳迁移率转移,作者证实circITGB6连接处的CAUC基序对于IGF2BP2相互作用至关重要。Super-shift实验表明IGF2BP2特异性结合该基序。当CAUC基序发生突变时,circITGB6/ IGF2BP2复合物的形成显著减少(图5H,底部)。这些数据表明IGF2BP2通过KH1-2双结构域与circITGB6的CAUC基序结合。
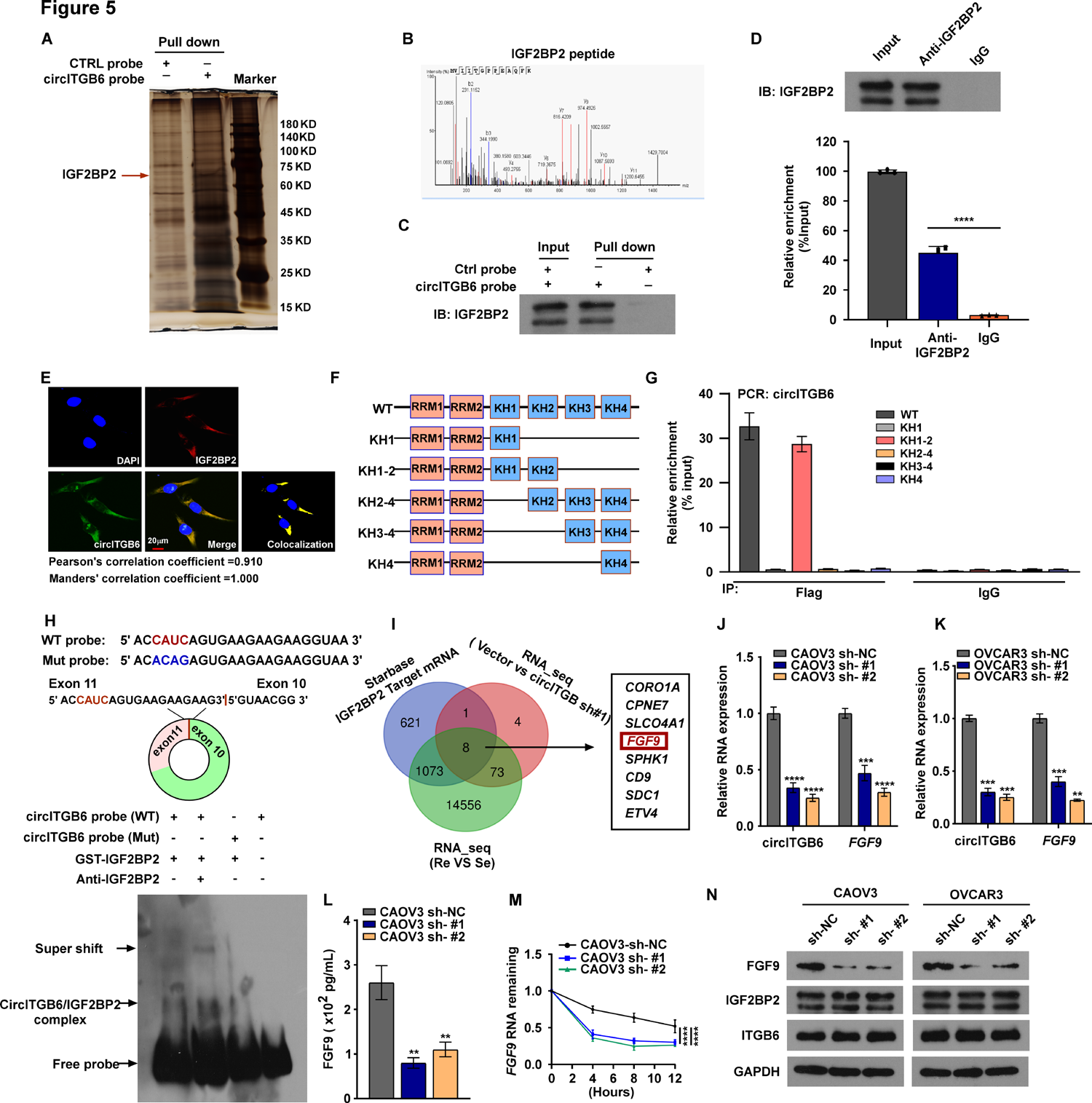
图5 CircITGB6直接与IGF2BP2相互作用。
6.circITGB6/IGF2BP2/FGF9 RNA -蛋白三元复合物稳定FGF9 mRNA
正如之前的研究报道的那样,IGF2BP2在调节mRNA稳定性方面起着关键作用。因此,作者对OVCAR3细胞(sh-NC和sh-circITGB6)进行了RNA-seq分析。与sh-NC OVCAR3细胞相比,sh-circITGB6 OVCAR3细胞中86种mRNA的表达明显降低(log2 |FC|> 1.5)。此外,作者还分析了sh-NC OVCAR3细胞与sh-circITGB6 OVCAR3细胞中下调的mRNA,这些mRNA在化疗耐药OC组织与化疗敏感OC组织中同时上调(见图1A)。之前的研究也报道了IGF2BP2优先结合到下游靶mRNA的3 ' UTR上。因此,作者使用RNA相互作用组百科全书StarBase中不同类型癌症的RBP CLIP-seq数据集,在上述上调的mRNA中筛选了IGF2BP2下游靶mRNA的3 ' UTR。通过以上筛选方法,作者鉴定出8个IGF2BP2结合的mRNA。考虑到circITGB6诱导TAM M2极化,根据前人的研究,只有一个TAM M2极化相关的分泌因子FGF9被确定为circITGB6的潜在下游靶点(图5I)。此外,通过qRT-PCR和ELISA检测证实FGF9是circITGB6的靶标(图5J-L)。作者还发现沉默circITGB6显著降低了FGF9 mRNA的稳定性(图5M),从而显著降低了FGF9的表达(图5N)。通过序列BLAST分析,作者发现circITGB6内部的两个CAAAC位点可以直接结合到富含AU元素的FGF9的3'UTR (GUUUG基序)(图6A)。接下来,作者利用一系列体外试验研究了circITGB6和FGF9 mRNA的相互作用,并通过circRNA下拉试验确认了相互作用(图6B)。接下来,作者探索了circITGB6/FGF9 mRNA复合物是否对维持FGF9 mRNA稳定性至关重要。此外,在circITGB6沉默细胞中,FGF9 mRNA的半衰期缩短,而在circITGB6过表达细胞(WT)中延长(图6C,D)。此外,与circITGB6过表达细胞(WT)相比,当circITGB6的结合位点1或2发生突变时,FGF9 mRNA的半衰期显著缩短。然而,当circITGB6中的结合位点1和2发生突变时,在circITGB6过表达细胞(Mut1+2)和对照细胞之间,FGF9 mRNA的半衰期无统计学差异(图6D)。当circITGB6被敲低时,IGF2BP2/FGF9 RNA -蛋白复合物的共定位显著降低,而IGF2BP2表达无变化(图6e)。RIP实验表明,IGF2BP2的KH1-2双结构域对其与circITGB6和FGF9的相互作用至关重要(图5G和6F)。此外,通过RIP实验检测到,沉默circITGB6显著降低了FGF9/IGF2BP2 RNA -蛋白相互作用,而上调circITGB6显著增加了IGF2BP2免疫沉淀部分中FGF9的富集(图6G)。此外,作者进一步观察到,敲低IGF2BP2后,FGF9的mRNA稳定性显著降低(图6H)。这些数据表明,circITGB6在促进IGF2BP2和FGF9之间的相互作用中起关键作用,并通过形成circITGB6/IGF2BP2/FGF9 RNA -蛋白质三元复合物来增加FGF9的mRNA稳定性。
7.FGF9是circ ITGB6诱导的CDDP抗性和M2巨噬细胞极化所必需的
为了进一步确定FGF9对于circ ITGB6介导的tam M2极化和随后诱导CDDP抗性是否必不可少,作者在共培养系统中加入了FGF9中和抗体。从OC细胞(转染载体或转染circ ITGB6)中收集的上清液用于处理pbmc衍生的CD14+单核细胞。阻断FGF9可协同消除FGF9促进M2巨噬细胞极化的作用,导致M1巨噬细胞大量出现,M2巨噬细胞较少(图6I-L)。由于目前缺乏适合体内实验的FGF9中和抗体,作者在ID8-circITGB6细胞中使用CRISPR/ cas9介导的基因敲除(KO)靶向FGF9进行进一步的体内实验。作者首先构建了FGF9-KO-ID8circITGB6细胞(图6M)。结果表明,与体内对照细胞相比,ID8-circITGB6细胞在FGF9 KO后,circITGB6对CDDP抗性的影响明显减弱(图6N,O),存活时间延长(图6P)。这些发现表明,circ ITGB6介导的TAM M2极化和随后诱导的CDDP抗性依赖于OC TME中FGF9的分泌。
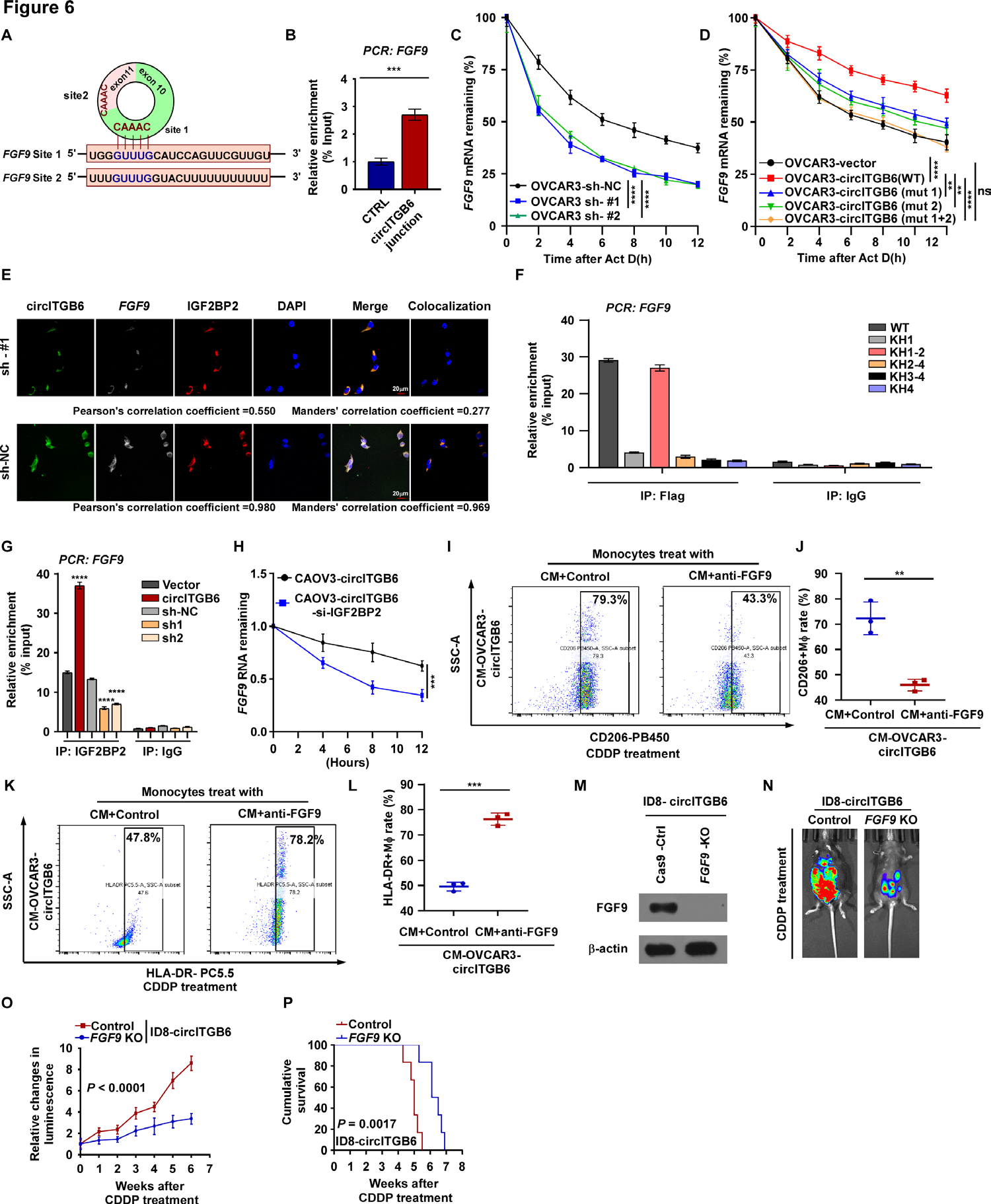
图6 circITGB6/IGF2BP2/FGF9 RNA -蛋白三元复合物稳定FGF9 mRNA。
8.靶向肿瘤来源的circITGB6可增强OC的治疗效果
鉴于circITGB6促进TAM M2极化,导致免疫抑制微环境,然后导致CDDP耐药,作者推断OC细胞来源的circITGB6可能是一个治疗靶点。如图7A-D所示,与CDDP和磷酸缓冲盐水(PBS)给药组相比,CDDP和ASOcircITGB6联合治疗显著抑制肿瘤生长,提高总生存率。此外,联合治疗小鼠肿瘤中浸润的CD206+ M2巨噬细胞和FGF9表达显著降低(图7E-G)。此外,通过ELISA(图7I,J)和qRT-PCR(图7K-M)检测,注射ASO-circITGB6小鼠肿瘤分离的tam中M2标记物IL-10和Arg1的表达显著降低,而M1标记物TNF-α和iNOS的表达显著升高。
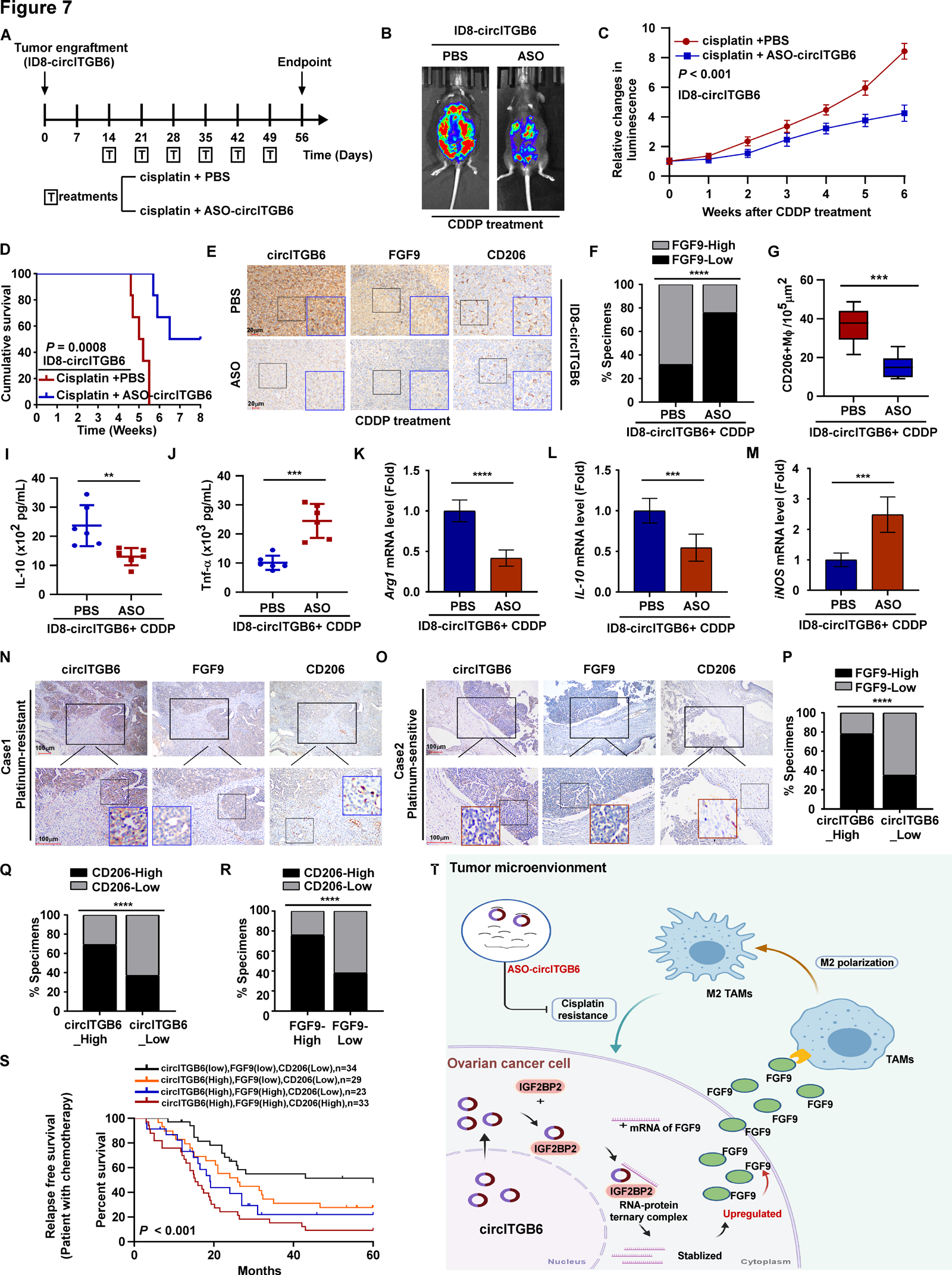
图7 巨噬细胞参与卵巢癌化疗耐药的机制
9.OC中circITGB6/FGF9/M2巨噬细胞极化轴的临床意义
IHC和ISH检测显示,化疗耐药OC组织中FGF9和circITGB6的表达以及CD206+巨噬细胞的比例明显高于化疗敏感OC组织(图7N,O)。相关分析显示,高水平的circITGB6与高水平的FGF9表达和高比例的CD206+巨噬细胞显著相关(图70,P)。此外,在OC患者中,CD206+巨噬细胞的比例与FGF9的表达呈正相关(图7R)。此外,Kaplan-Meier生存曲线和log-rank检验显示,circITGB6高表达、FGF9高表达、CD206+巨噬细胞浸润比例高的OC患者无复发生存期最短(图7S)。综上所述,作者的研究结果表明circITGB6/IGF2BP2/FGF9形成一种RNA -蛋白复合物来稳定FGF9,诱导巨噬细胞向M2表型极化,然后导致人类OC中CDDP耐药、恶性进展和不良临床结果(图7T)。
结论
总之,作者发现了一个涉及circITGB6/IGF2BP2/FGF9轴的新型细胞串扰临床网络,该网络可以调节巨噬细胞m2型极化、OC CDDP抗性和OC预后。作者的研究也提供了针对巨噬细胞在OC TME中的潜在治疗策略。
实验方法
患者样本收集,q-PCR,WB,IHC,FISH,质粒构建,RNA干扰,细胞转染,CRISPR/Cas9,集落形成实验,TUNEL实验,流式细胞术,ELISA,IF染色,Annexin V-FITC/PI细胞凋亡实验,双荧光素酶报告基因检测,RNA测序,pull-down,RNA免疫沉淀实验,EMSA
参考文献
Li H, Luo F, Jiang X, Zhang W, Xiang T, Pan Q, Cai L, Zhao J, Weng D, Li Y, Dai Y, Sun F, Yang C, Huang Y, Yang J, Tang Y, Han Y, He M, Zhang Y, Song L, Xia JC. CircITGB6 promotes ovarian cancer cisplatin resistance by resetting tumor-associated macrophage polarization toward the M2 phenotype. J Immunother Cancer. 2022 Mar;10(3):e004029. doi: 10.1136/jitc-2021-004029. PMID: 35277458; PMCID: PMC8919471.






