SOC预后不良新预测因子出现!这一条去泛素化途径你学会了吗?
浆液性卵巢癌(serous ovarian cancer, SOC)的预后不良是由于SOC细胞的高侵袭能力和顺铂抗性,而分子机制仍然知之甚少。Snail是EMT的经典生物标志物,它在癌细胞癌变,进展,转移和化学耐药性中起着重要作用。本研究分别通过免疫组织化学、体外和体内研究鉴定编码非肌西北肌球蛋白重链IIB的基因MYH10在SOC中的表达和功能。MYH10的机制通过共免疫沉淀、GST pull-down、共聚焦激光测定等得到证实。结果表明,敲低MYH10在体内外均抑制SOC细胞的增殖、迁移、侵袭、转移和顺铂耐药性。进一步的研究证实,MYH10蛋白功能结构域与编码非肌西北肌球蛋白重链IIA的基因MYH9结合,募集去泛素特异性蛋白酶45,通过去泛素化snail以抑制其蛋白质降解,最终促进SOC中的肿瘤发生,进展和顺铂耐药性。在临床样品中,与副肿瘤样品相比,SOC样品中的MYH10表达显着升高。MYH10的表达与MYH9的表达呈正相关。MYH10+/MYH9+共表达是预测SOC患者生存的独立预后因素。这些发现揭示了MYH10-MYH9-Snail轴在SOC致癌、进展和顺铂耐药性中的关键作用,并为SOC干预提供潜在的新治疗靶点。本文于2023年5月发表在《Advanced science (Weinheim, Baden-Wurttemberg, Germany)》IF:15.1期刊上。
技术路线

主要实验结果
1、MYH10在SOC样品中表达上调并预测预后不良
为探究MYH10在SOC样品中的临床意义,本研究进行IHC以检测MYH10蛋白表达(图1B,C),结果显示与肿瘤旁样品相比,SOC样品中MYH10的蛋白表达上调(图1A)。重要的是,Kaplan-Meier分析表明,高MYH10表达与SOC样品中较短的总生存期(OS)和无复发生存期(RFS)相关(图1D)。此外,MYH10表达与FIGO分期,腹膜内转移和肠道转移等因素都相关(表1)。这些结果表明MYH10在SOC中表达上调,并可预测不良预后。
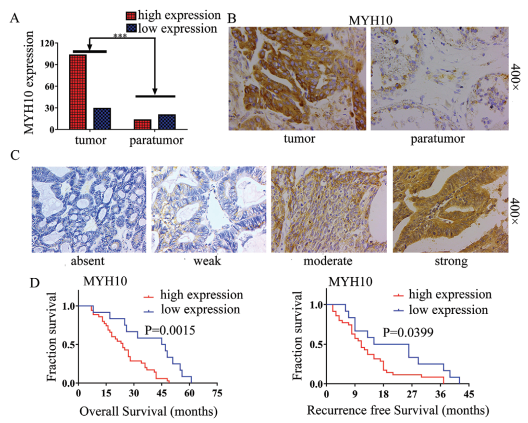
图1 上调MYH10可预测SOC患者预后不良
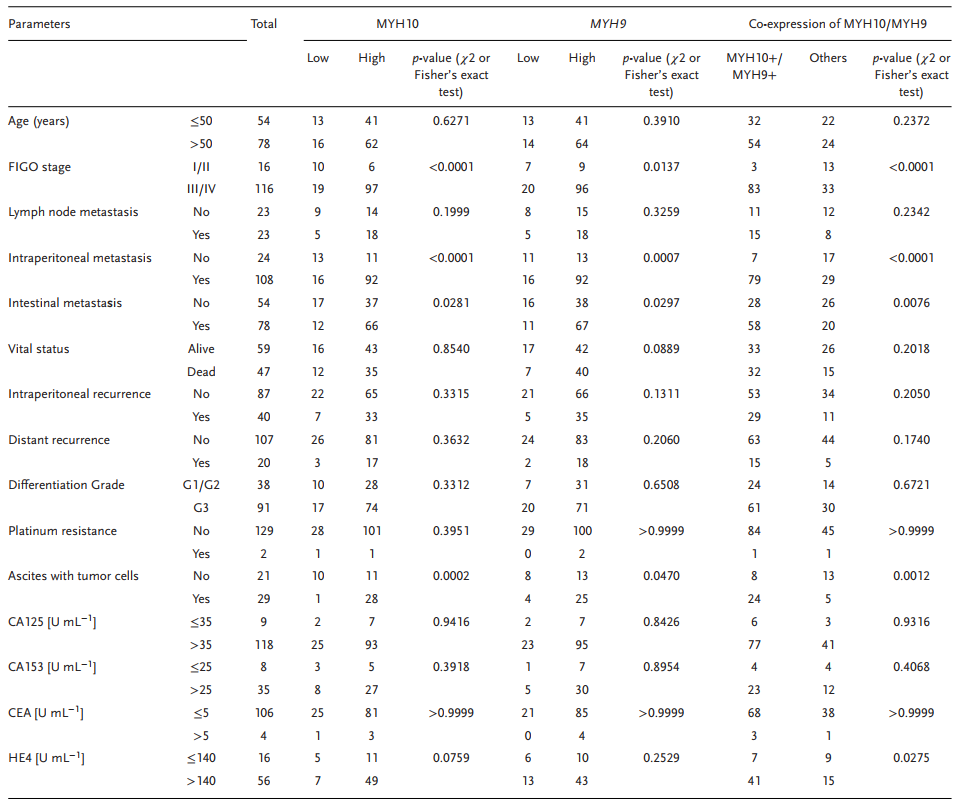
表1 使用χ2或Fisher’s精确检验与标准临床病理变量相关的MYH10,MYH9或MYH10/MYH9表达
2、敲低MYH10在体内外抑制SOC中的肿瘤发生、进展和顺铂耐药性
为验证MYH10的致癌功能,本研究使用不同的siRNA有效地敲低SOC细胞中MYH10的表达。使用3-(4,5-二甲基-2-噻唑基)-2,5-二苯基-2H-四唑溴化物(MTT),Edu和集落形成测定(图2A-C)发现敲低MYH10抑制SOC细胞生长和增殖。此外,Transwell,Boyden和细胞划痕实验表明敲低MYH10能抑制SOC细胞的迁移和侵袭能力(图2D,E),体外药物敏感性试验显示MYH10敲低细胞的IC50值在统计学上低于对照(图2G),并且这种效应在shMYH10裸鼠异种移植物模型体内进一步证实(图2F)。Kaplan-Meier方法估计的生存时间证实,与未处理的正常对照(NC+NS)相比,单独的顺铂治疗(NC+顺铂)或shMYH10(shMYH10+生理盐水[NS])有效延长生存期。然而,shMYH10+顺铂组显著延长生存时间,超过其他三组(图2F)。NC+NS组的中位生存期为20天,shMYH10+NS组为31.5天,顺铂+NS组为38.5天,shMYH10+顺铂组为47.5天。此外,为了探究MYH10是否影响肿瘤生长和肺转移,在裸鼠中进行皮下和尾静脉注射的移植肿瘤实验,结果显示敲低MYH10抑制体内肿瘤的增殖(图2H)和转移(图2I),注射shMYH10细胞的小鼠与对照相比表现出较低的肿瘤大小和重量。此外,蛋白印迹分析显示EMT信号包括N-钙粘蛋白,波形蛋白,snail和slug被显著抑制,而E-钙粘蛋白显著上调(图2J)。这些结果表明,MYH10基因的敲低通过EMT信号在体内外抑制SOC的增殖、迁移、侵袭、转移和顺铂耐药。这些数据表明MYH10作为一种癌蛋白,在体内外促进SOC癌变、进展和顺铂耐药。
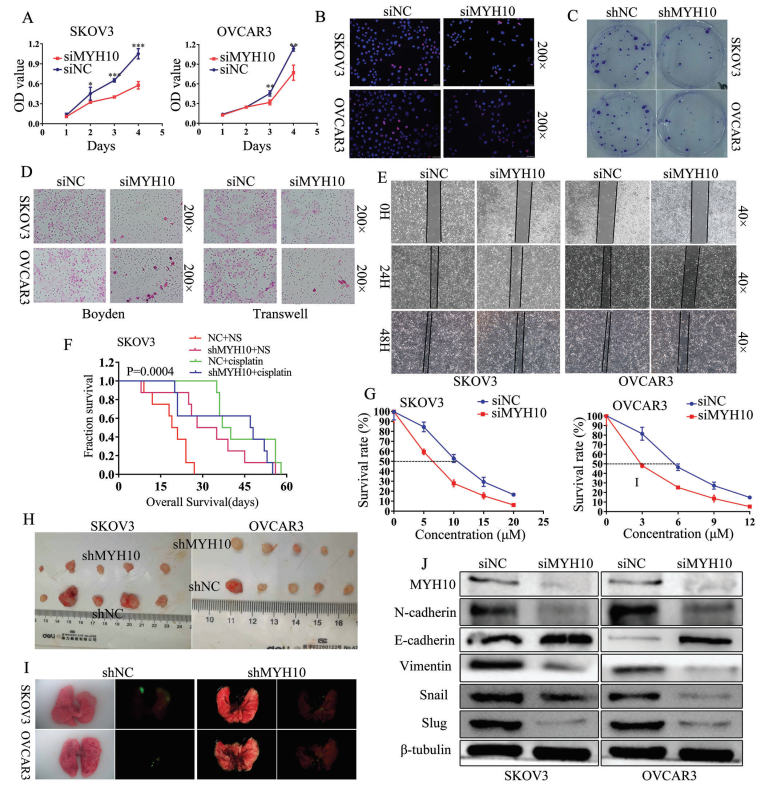
图2 MYH10基因敲低通过失活EMT信号抑制SOC细胞增殖、迁移、侵袭、转移和顺铂耐药
3、MYH10去泛素化snail
为进一步确定MYH10在SOC细胞中的作用机制,该研究使用Biogrid生物信息学网站来预测候选互作蛋白,发现snail是MYH10的候选互作蛋白。此外,作者使用RT-qPCR和WB来检测MYH10敲低后snail的表达,发现snail的mRNA表达没有改变(图3A),而蛋白质表达在MYH10敲低后下调(图2L)。此外还使用内源性Co-IP测定观察到MYH10与snail相互作用(图3B),接下来验证MYH10是否通过抑制其在SOC细胞中的泛素化来减少snail降解。用特异性抗snail抗体免疫沉淀snail,并用抗泛素抗体分析其泛素化状态。正如预期的那样,过表达MYH10显著降低snail的泛素化水平(图3C)。此外,共聚焦激光测定证实MYH10和snail共定位于SOC细胞质中(图3D),并且MYH10敲低可以在不同时间点损害用cicloheximide和MG132处理的SOC细胞中snail的稳定性(图3E,F)。
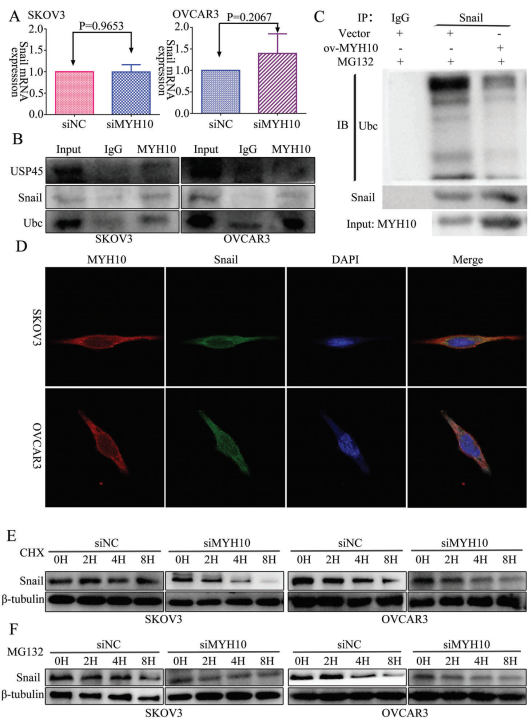
图3 MYH10去泛素化snail蛋白
4、MYH10与MYH9在SOC细胞中结合
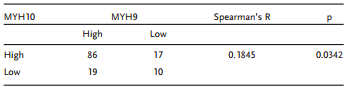
为进一步验证MYH10在SOC细胞中的详细机制,作者再次使用Biogrid预测候选互作蛋白,发现MYH9是MYH10的候选互作蛋白。在以前的研究中已得到,MYH9在OC组织中上调,并通过调节Wnt/β-连环蛋白途径和EMT信号促进SOC增殖,迁移,侵袭和转移。此外,作者使用外源性和内源性Co-IP测定得到MYH10功能结构域(≈879-1959aa)与MYH9相互作用(图4C-F),并且共聚焦激光测定证实MYH10和MYH9共定位在SOC细胞细胞质中(图4G)。此外,GST pull-down分析表明,在SOC细胞系中,MYH10可以直接结合MYH9(图4D)。此外,为了确定MYH10和MYH9表达之间的关系,该研究在总共132对SOC样品中进行了IHC(图4A)。Kaplan-Meier分析清楚地显示MYH10+/MYH9+患者的OS或RFS比其他表达更短(图4B)。MYH10+/MYH9+表达与FIGO分期,腹膜内转移,肠道转移,腹水肿瘤细胞和血清HE4水平直接相关。此外,MYH10+/MYH9+共表达确实是一个独立的预后因素,而不是使用多变量分析单独使用MYH10或MYH9(表2)。值得注意的是,在SOC样品中检测到MYH10和MYH9蛋白水平之间正相关(表3)。
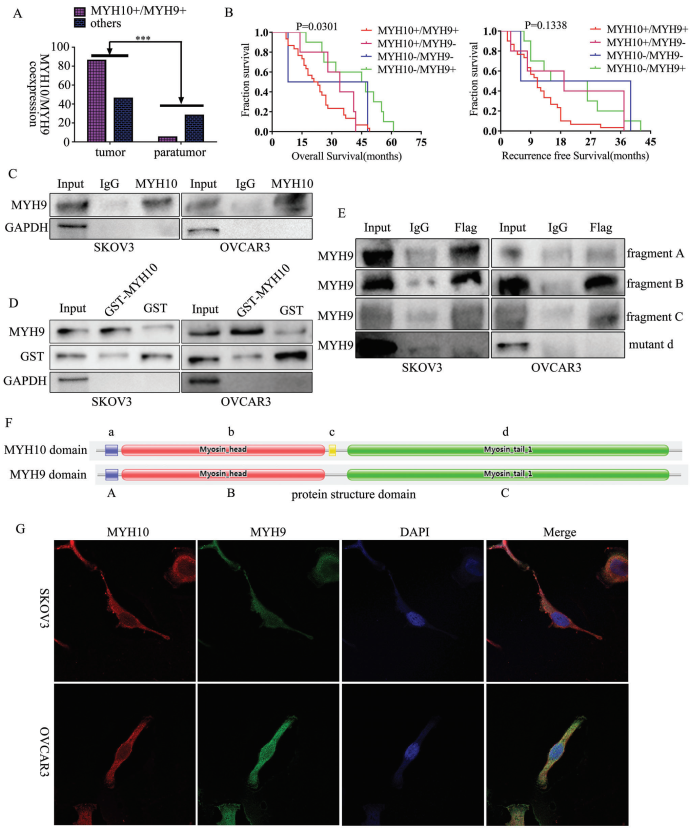
图4 MYH10在SOC细胞中与MYH9结合
表2 SOC预后因素的单变量和多变量Cox回归分析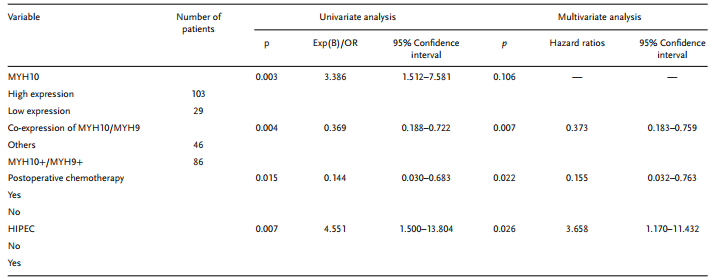
表3 MYH10与MYH9表达的相关性研究
5、MYH9招募USP45去泛素化snail
在作者之前的研究中已知,MYH9通过调节Wnt/β-连环蛋白途径和EMT信号促进OC的增殖、迁移、侵袭和转移。为探究MYH9对snail的影响,作者使用RT-qPCR和WB来检测MYH9敲低后snail的表达,结果显示snail的mRNA表达没有改变(图5A),而在snail的蛋白质表达下调(图5B)。为进一步验证MYH9在SOC细胞中的作用机制,作者应用Biogrid生物信息学网站来预测候选互作蛋白,发现USP45和snail是MYH9的候选互作蛋白。此外,内源性Co-IP分析发现MYH9可以分别与USP45,snail和泛素互作(图5C),并且Co-IP测定表明USP45敲低能改善MYH9对snail去泛素化和稳定性的影响(图5D)。此外,共聚焦激光测定证实MYH9和USP45以及MYH9和snail都共定位于SOC细胞细胞质中(图5G,H),MYH9敲低或过表达可能损害用cicloheximide和MG132处理的SOC细胞中snail在不同时间点的稳定性(图5E,F)。此外,该研究发现USP45敲低也可以损害cicloheximide和MG132处理的SOC细胞中snail在不同时间点的稳定性(图5I,J)。
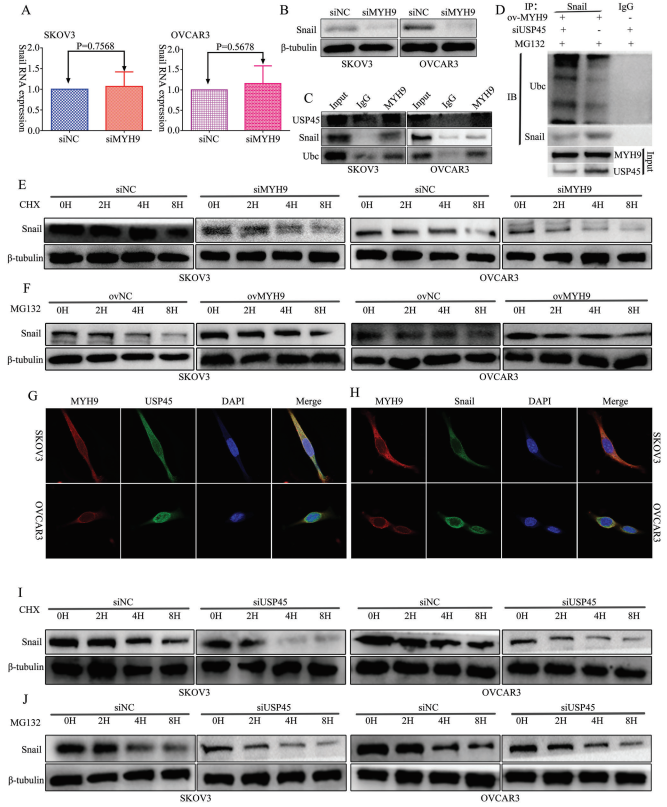
图5 MYH9招募USP45去泛素化snail
6、MYH10对SOC癌变、进展和顺铂耐药的促进作用可通过敲低MYH9逆转
为确定MYH9敲低是否逆转MYH10对SOC癌发生,进展和顺铂耐药性的促进,进行MTT和EdU测定以验证siMYH9对MYH10过表达的SOC细胞增殖的作用(图6A,C)。另外,进行Transwell和细胞划痕实验探究siMYH9对MYH10过表达的SOC细胞迁移和侵袭的逆转作用(图6D,E)。此外,检测IC50值以验证siMYH9对MYH10过表达的SOC细胞的作用(图6B),并进行WB以探究潜在的机制。WB显示MYH9敲低能逆转MYH10对EMT信号的促进(图6F)。这些数据表明MYH10对SOC癌发生、进展和顺铂耐药性的促进作用可以通过敲低MYH9来逆转。

图6 敲低MYH9可逆转MYH10诱导的SOC癌变、进展和顺铂耐药
7、MYH9对SOC致癌、进展和顺铂耐药的促进作用可通过敲低snail逆转
为确定snail敲低是否逆转MYH9对SOC癌发生,进展和顺铂耐药性的促进,进行MTT和EdU测定以验证si-snail对MYH9过表达的SOC细胞增殖的作用(图7A,C)。另外,进行Transwell和细胞划痕实验探究si-snail对MYH9过表达的SOC细胞迁移和侵袭的逆转作用(图7D,E)。此外,检测IC50值以验证si-snail对MYH9过表达的SOC细胞的作用(图7B),并进行WB以探究其潜在的机制,WB显示snail敲低能逆转MYH9对EMT信号的促进(图7F)。这些数据表明,MYH9对SOC癌发生、进展和顺铂耐药性的促进作用可以通过敲低snail来逆转。
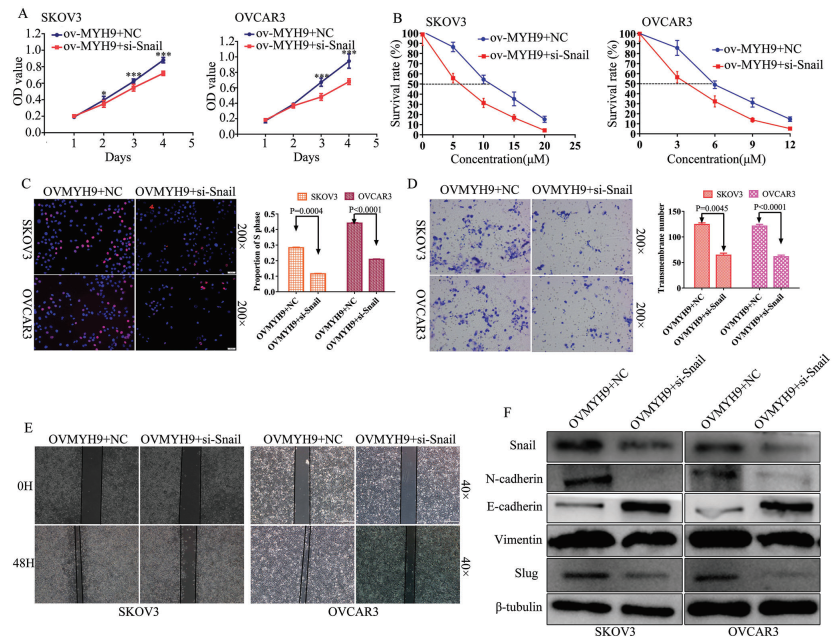
图7 敲低snail可逆转MYH9诱导的SOC癌变、进展和顺铂耐药

图8 本研究模型图
综上所述,本研究表明,MYH10在SOC样本中上调,并预测SOC患者的预后不良。MYH10作为SOC中的癌基因,促进顺铂耐药。MYH9是MYH10互作蛋白,通过招募USP45去泛素化snail导致EMT信号通路激活,从而促进SOC癌变、进展和顺铂耐药(图8)。该研究为理解与SOC发生、进展和顺铂耐药相关的分子机制提供新的见解,并为SOC治疗提供潜在的生物标志物。
实验方法
转染,qRT-PCR,MTT Assay,EdU分析,Transwell实验,细胞划痕实验,裸鼠体内外顺铂治疗实验,WB,Co-IP,GST pull-down,菌落形成实验,共聚焦激光分析,动物增殖与转移研究,免疫组织化学(IHC)染色
参考文献
Liu L, Chen C, Liu P, et al. MYH10 Combines with MYH9 to Recruit USP45 by Deubiquitinating Snail and Promotes Serous Ovarian Cancer Carcinogenesis, Progression, and Cisplatin Resistance. Adv Sci (Weinh). 2023; 10 (14): e2203423. doi:10.1002/advs.202203423






