预测HCC放射敏感性的新生物标志物发现!还与铁死亡相关!
放射耐药性是肝细胞癌(HCC)放疗失败的罪魁祸首。对HCC中放射耐药的调控基因和潜在机制的见解有待深入研究。本研究通过RNA-seq和生物信息学分析筛选出细胞因子信号传导抑制因子2(SOCS2)作为HCC放疗的潜在预后预测因子,随后确定其在体内或体外促进HCC的放射敏感性。同时,测定溶质载体家族7成员11(SLC7A11)和谷胱甘肽过氧化物酶4(GPX4)的铁死亡负调节蛋白、细胞内脂质过氧化和Fe2+浓度表明,高水平的铁死亡有助于HCC的放射增敏。此外,SOCS2和SLC7A11在具有不同放射敏感性的HCC临床组织和肿瘤异种移植肿瘤中表达相反。在机制上,SLC7A11的N端结构域被SOCS2的SH2结构域特异性识别。而SOCS162-BOX区域的L162和C166可以结合伸长蛋白B/C化合物以共同形成SOCS2/伸长蛋白B/C复合物以募集泛素分子。本文中,SOCS2作为将附着的泛素转移到SLC7A11的桥梁,促进了K48连接的多泛素化降解SLC7A11,最终导致HCC的铁死亡和放射增敏的发生。综上所述,本研究首次证实高表达的SOCS2是通过促进SLC7A11的泛素化降解和促进铁死亡来预测HCC放射敏感性的生物标志物之一,这表明靶向SOCS2可以提高HCC放疗的效率并改善患者的预后。本文于2023年1月发表在《Cell death and differentiation》IF:12.4期刊上。
技术路线
主要实验结果
1、SOCS2与肝细胞癌的放射敏感性呈负相关
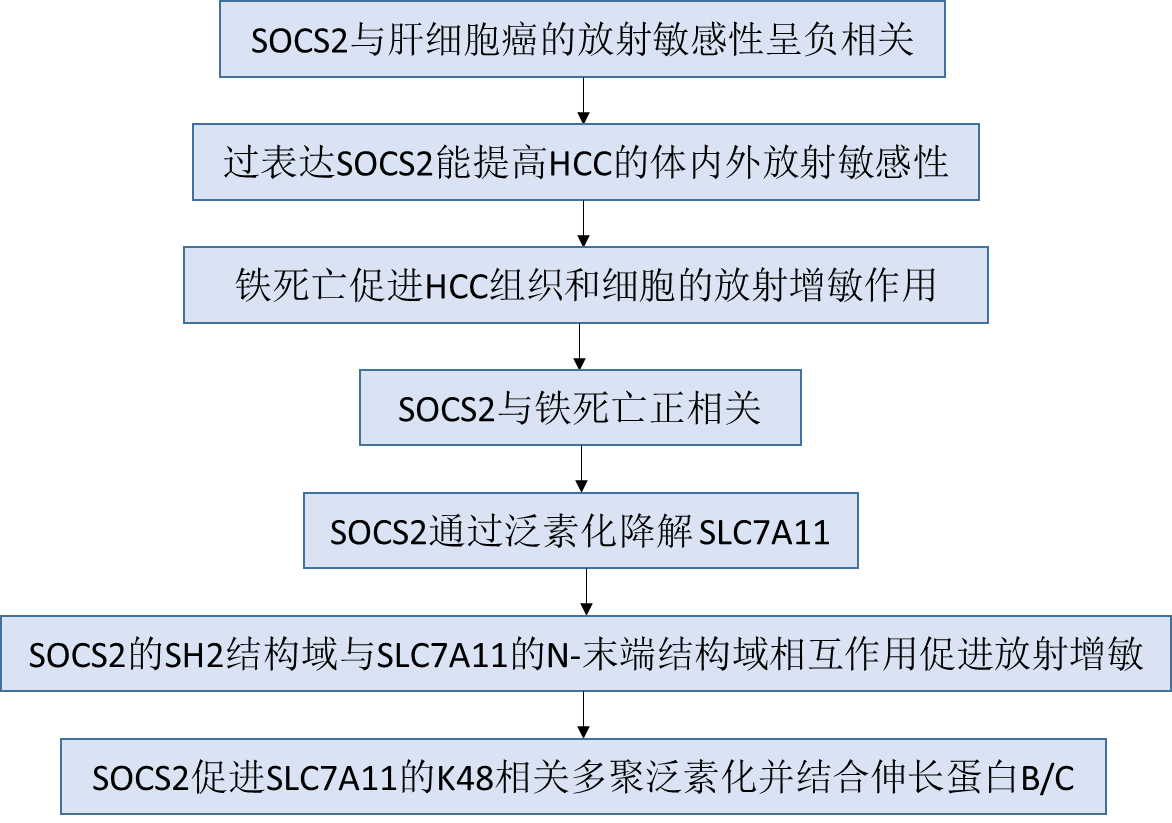
文章首先由亲本HCC细胞系SK-Hep-1和HepG2构建得到两种放射抗性HCC细胞系SK-Hep-1R和HepG2R,敏感性增强比(SER)分别为1.18和1.25(图1A)。为确定参与HCC放射抗性的潜在基因,通过RNA-seq分析探索SK-Hep-1和SK-Hep-1R细胞之间的差异mRNA谱,鉴定总共255个mRNA。其中,189个mRNA上调,66个mRNA下调(图1B)。此外,通过GEPIA和TCGA数据库的分析发现,与正常肝组织相比,HCC组织中有5856个基因差异表达(图1C),包括4282个上调基因和1572个下调基因。随后作者根据GEPIA数据库将上述差异表达基因(DEGs)与与HCC预后相关的存活基因结合起来,寻找调节HCC放射抗性和预后的DEGs。Venny分析显示只有两个基因,SOCS2和SMOX,在这些数据集中同时下调或上调(图1D)。经检测,与正常组织和SK-Hep-1细胞相比,HCC组织和放射抗性SK-Hep-1R细胞中的SOCS2基因显著降低(图1E),而根据GEPIA数据库的Kaplan-Meier总生存期(OS)分析显示,SOCS2的低表达是指HCC患者预后不良(图1F)。此外,与正常组织和SK-Hep-1细胞相比,HCC组织和SK-Hep-1R细胞中SMOX基因增加(图1E),升高的SMOX表明HCC患者预后不良。
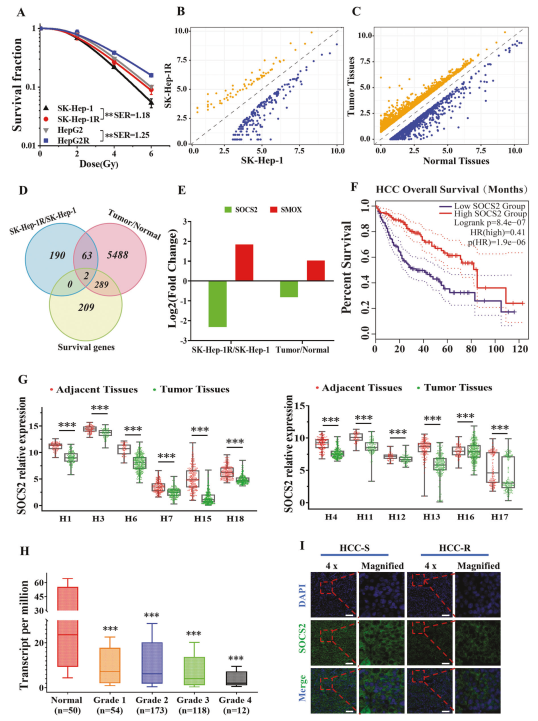
图1 SOCS2的过表达与HCC的放射增敏有关
为进一步证明这两个基因在肝癌发生和发展中的作用,作者应用HCCDB数据库进行进一步的分析。发现SOCS2在肿瘤组织中的mRNA表达显著低于邻近正常组织(图1G),表明SOCS2的高表达抑制HCC的发生和进展。SMOX的HCC调节的一致性比SOCS2差,因此后续研究选用SOCS2作为肝癌放射抗性的潜在基因。此外,与正常肝脏样本相比,HCC IV期SOCS2表达水平低于I,II和III期(图1H),这与低SOCS2表达患者预后不良的现象一致。为确定SOCS2是否直接介导放疗后HCC的预后,该研究通过免疫荧光对放射敏感性肝癌患者(HCC-S)和放射抗性肝癌患者(HCC-R)的肿瘤组织中SOCS2的表达水平进行检测,发现放射抗性组织的SOCS2表达较低(图1I)。总之,这些结果表明SOCS2可能作为一种抑癌基因来抑制肝癌的进展和放射抗性。
2、过表达SOCS2能提高HCC的体内外放射敏感性
接下来,作者检测SOCS2与肝癌细胞放射敏感性的关系。WB分析表明SOCS2在SK-Hep-1,SK-Hep-1R,HepG2和HepG2R细胞中有序下降(图2A),与它们的放射敏感性一致(图1A)。为阐明SOCS2的功能,用lvSOCS2或siSOCS2转染HCC细胞以有效地增强或减少SOCS2的表达(图2B,C)。过表达SOCS2降低SK-Hep-1和HepG2细胞的抗辐射能力,SER分别为1.11和1.16(图2D)。相反,敲除SOCS2增加了HCC细胞的抗辐射能力,SER分别为0.86和0.89(图2E)。
为研究是否可以在体内观察到同样的现象,作者对小鼠进行异种移植肿瘤实验,发现放射(irradiation,IR)会引起肿瘤体积的减少,且在SK-Hep-1中比在SK-Hep-1R细胞中更明显(图2F,H),而过表达SOCS2会导致IR后肿瘤体积进一步减少(图2G,I)。
由于已有研究表明辐射会诱导铁死亡,所以作者进一步研究铁死亡是否在肿瘤的放射敏感性中起作用。铁死亡的特征是细胞毒性脂质过氧化物的积累。铁死亡及其调节蛋白,如谷胱甘肽过氧化物酶4(GPX4)、溶质载体家族7成员11(SLC7A11)和P53在肝癌中起关键作用。免疫组织化学(IHC)检测未照射和IR后12h异种移植肿瘤中SOCS2和铁死亡蛋白的表达,发现IR增加SOCS2和铁死亡标记物(4-HNE)的表达,但抑制GPX4和SLC7A11的表达(图2J)。此外,过表达SOCS2的异种移植肿瘤中GPX4和SLC7A11表达量降低,而4-HNE表达量升高(图2J)。这些结果表明辐射诱导与过表达SOCS2都能出现铁死亡。证明SOCS2可能通过诱导铁死亡而促进HCC的放射增敏作用。
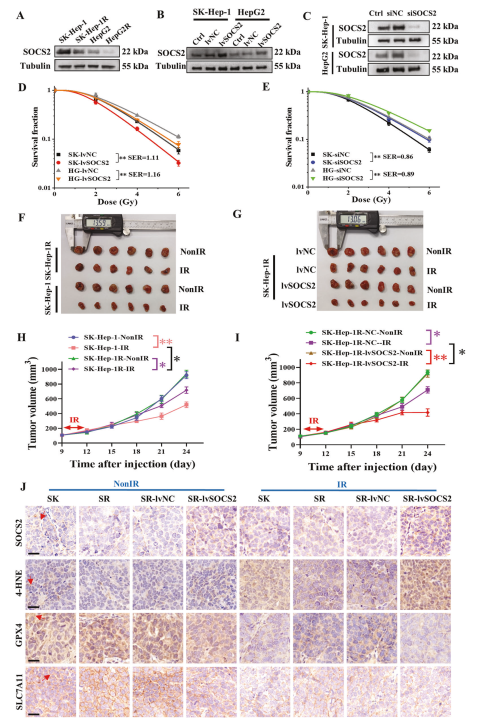
图2 过表达SOCS2提高HCC的体内外放射敏感性
3、铁死亡促进HCC组织和细胞的放射增敏作用
为进一步验证上述推测,作者通过免疫荧光分析GPX4和SLC7A11在HCC临床组织中的表达,发现放射敏感组织GPX4和SLC7A11表达水平更低,表明具有更高水平的铁死亡(图3A)。接着WB检测HCC细胞中GPX4和SLC7A11的表达水平,同样发现GPX4和SLC7A11表达随着细胞对IR的抗性而增强(图3B)。接下来,liperfluo(脂质过氧化物荧光探针)免疫荧光结果显示,氢过氧化物脂质水平随着HCC放射敏感性增加,且IR后升高(图3C,D)。这些结果提示放射抗性HCC细胞具有较低的铁死亡水平。
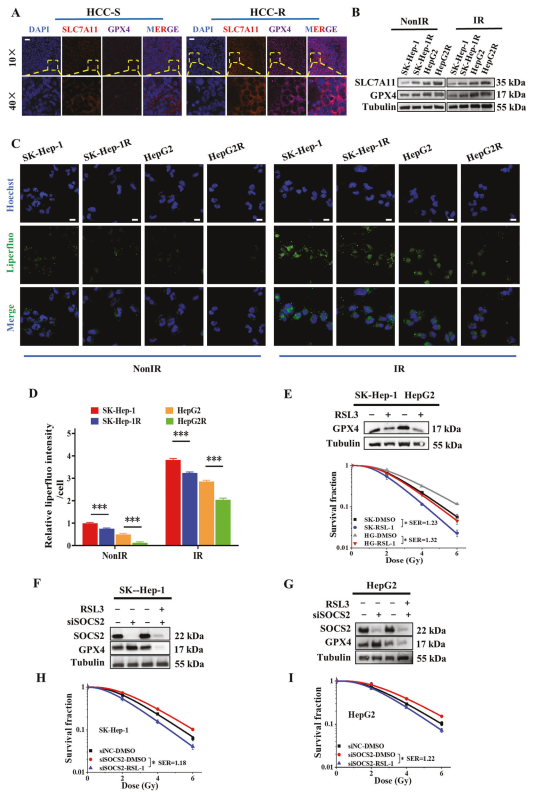
图3增强的铁浓度导致HCC的放射增敏作用
为进一步检测铁死亡是否进行HCC放射增敏,该研究使用RSL3(GPX4的抑制剂)促进铁死亡的产生,WB检测发现RSL3处理后SK-Hep-1和HepG2细胞的放射敏感性增加(图3E),而用RSL3处理siSOCS2转染的HCC细胞后,放射增敏作用随GPX4表达下降而降低(图3F,G,H,I)。总之,铁死亡有助于HCC细胞的放射增敏作用,而RSL3诱导的铁死亡可以逆转SOCS2抑制后获得的放射抗性。
4、SOCS2与铁死亡正相关
由于铁死亡和SOCS2都有助于HCC的放射增敏,而图2J暗示SOCS2促进铁死亡,因此作者试图深入探讨SOCS2与铁死亡之间的关系。通过检测IR 0~24h内HCC细胞中SOCS2和GPX4的蛋白表达水平变化,发现与未照射的细胞相比,在IR后24小时内SOCS2增加,而GPX4减少,在4小时内变化最明显(图4A)。接下来测量未照射或IR后4小时细胞中的蛋白质表达,发现与GPX4和SLC7A11表达相反,SOCS2表达量随着放射抗性的增加而下降(图4B)。此外,无论在未照射和IR的细胞中,过表达SOCS2都会抑制GPX4和SLC7A11的表达(图4C,D)。
上述结果表明SOCS2在蛋白质水平上促进铁死亡的发生,因此该研究进一步探讨SOCS2与铁死亡的特征表型:细胞内Fe2+含量和脂质过氧化物之间的关系。通过检测过表达SOCS2的HCC细胞中脂氟的相对荧光强度,发现SOCS2的增加促进细胞质脂质过氧化物在HCC细胞中的积累,在IR后更为明显(图4E,F)。广泛而言,SOCS2抑制GPX4和SLC7A11的表达,并诱导脂质过氧化物和Fe2+的积累,促进铁死亡。

图4 SOCS2促进肝癌细胞铁死亡
5、SOCS2通过泛素化降解SLC7A11
为研究SOCS2如何介导铁浓缩从而调节HCC放射敏感性,通过免疫荧光染色发现SOCS2的荧光密度与SLC7A11相反,表明SOCS2与SLC7A11呈负相关(图5A)。接着通过Co-IP证明SLC7A11与SOCS2相互作用(图5B,C)。为了解这种相互作用的功能后果,作者想知道SOCS2是否可以负调节SLC7A11的表达或诱导其降解。WB检测发现在SOCS2过表达后,SLC7A11的稳态水平显著降低,并且SLC7A11的半衰期大大缩短(图5D,E)。说明SOCS2通过蛋白质方面而不是转录方面促进SLC7A11的降解。
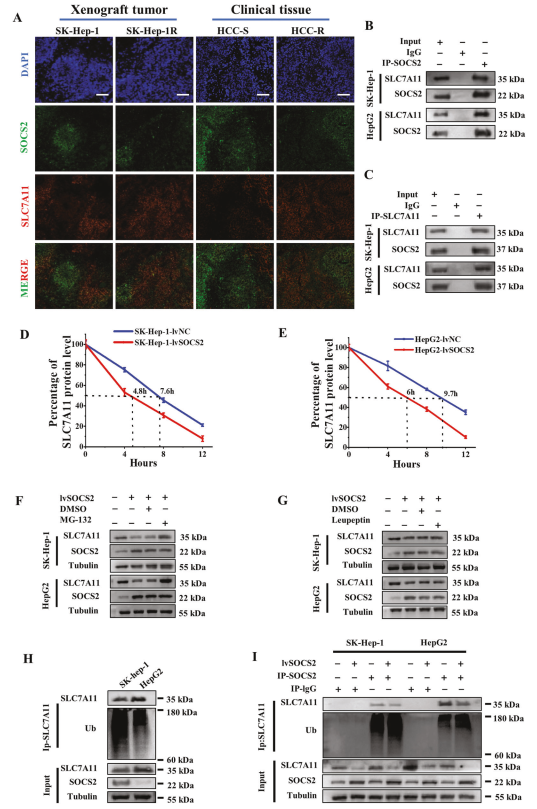
图5 SOCS2与 SLC7A11相互作用,并通过泛素-蛋白酶体途径降低其水平
接下来,为深入研究SLC7A11降解的机制,作者在HCC细胞中加入蛋白酶体抑制剂(MG-132)和溶酶体抑制剂(亮肽蛋白)。尽管高表达的SOCS2可以降低SLC7A11的蛋白质水平,但是这种下调通过MG-132的处理被逆转,而亮肽蛋白不能逆转(图5F,G),表明SOCS2诱导的SLC7A11下降依赖于蛋白酶体途径而非溶酶体途径。
由于SOCS2作为一种E3泛素连接酶,作者推测SLC7A11可能被SOCS2特异性识别并经历泛素化降解。WB分析显示SK-hep-1细胞中的泛素化SLC7A11水平显著高于HepG2细胞(图5H)。此外,在过表达SOCS2的HCC细胞中,SLC7A11表达量显著降低,并且SLC7A11泛素化水平更高(图5I)。
6、SOCS2的SH2结构域与SLC7A11的N-末端结构域相互作用促进放射增敏
为阐明SOCS2和SLC7A11之间的相互作用区域,作者将SOCS2分为三个结构域:NTD,SH2-结构和CTD,构建C-末端具有3×Flag标签的三个截短质粒(质粒A,B,C)和完整SOCS2序列的野生型(WT)质粒,并将这些质粒转染到HCC细胞中(图6A)。Co-IP分析显示只有WT和B(SH2截短)的通道表现出SLC7A11条带,表明SLC7A11与SOCS2的SH2结构域相互作用(图6B)。随后,为研究SOCS2-SH2结构域对泛素化水平的影响,作者通过从SOCS2全序列中删除SH2结构域来产生SOCS2-ΔSH2质粒,发现SOCS2-ΔSH2突变体不能增加SLC7A11的泛素化水平,而SOCS2-WT质粒显著增加SLC7A11的泛素化水平(图6C)。因此,SOCS2通过SOCS2的SH2结构域诱导SLC7A11泛素化。
此外,为鉴定与SOCS2相互作用的SLC7A11的结构域,作者还基于SLC7A11的结构域建立三个截断质粒A,B,C(图6D),发现SOCS2与SLC7A11的NTD相互作用(图6E)。与SOCS2-ΔSH2质粒的构建一致,作者还构建无N-末端的SLC7A11-ΔNTD突变质粒,发现Flag-ΔNTD的泛素化水平检测不到,而WT组中仍存在高水平的泛素化Flag-SLC7A11(图6F)。表明SLC7A11-NTD与SOCS2相互作用并因此介导其自身的泛素化。此外,将SOCS2-ΔSH2或SOCS2-WT质粒转染HCC细胞后观察IR后存活数,发现SOCS2-ΔSH2组的存活数与其阴性对照相比没有显著差异,但显著高于SOCS2-WT组(图6G,H),这意味着SOCS2由于其SH2结构域在HCC细胞中发挥放射增敏作用。

图6 SOCS2-SH2结构域与SLC7A11的N-末端结构域相互作用以降低辐射抗性
7、SOCS2促进SLC7A11的K48相关多聚泛素化并结合伸长蛋白B/C
确定SOCS2-SH2能通过识别SLC7A11-NTD介导SLC7A11泛素化后,作者想知道SLC7A11中发生的多聚泛素化的类型。到目前为止,K48和K63连接的链已被报道为最丰富和功能表征良好的多泛素链。为确定其中哪些存在于多泛素化的SLC7A11中,构建SLC7A11的K48R和K63R泛素突变体,泛素化测定K48R突变体泛素化积累减少,而K63R突变体泛素化积累不变(图7A),这意味着SLC7A11多泛素化主要以K48连接的泛素链而不是K63连接的形式产生。值得注意的是,K48R突变降低SLC7A11多聚泛素化的水平,但没有完全降低,暗示其他连锁类型也可能有助于这种多聚泛素化。
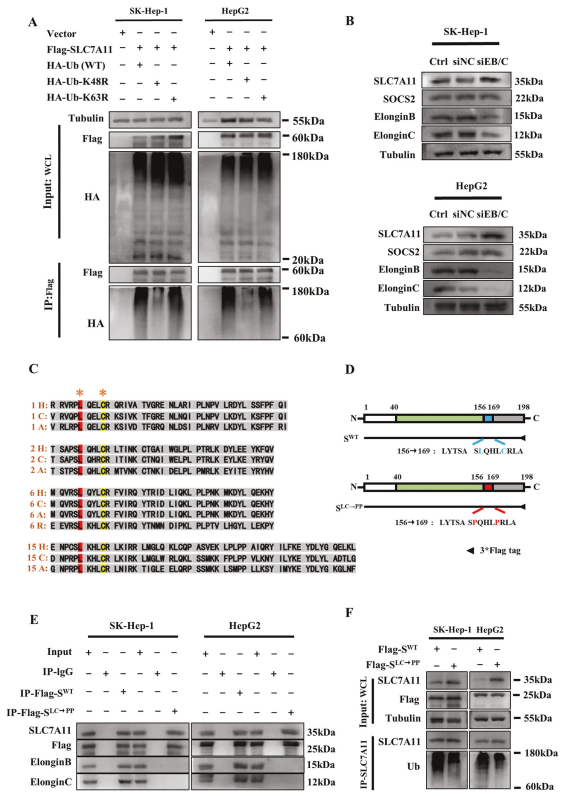
图7 SOCS2通过延伸蛋白B/C泛素复合物介导K48连接的多聚泛素化链到SLC7A11上
如前所述,SOCS1和SOCS6通常通过SOCS-BOX区域与伸长蛋白B/C结合以组装成E3泛素连接酶复合物介导泛素化,所以作者探究HCC细胞中SOCS2介导的SLC7A11泛素化是否也需要伸长蛋白B/C的参与。WB检测显示在HCC细胞中敲低伸长蛋白B/C不影响SOCS2表达,但是SLC7A11表达量升高(图7B),表明延伸蛋白B/C复合物是SOCS2介导的SLC7A11的泛素化降解所必需的。
接下来研究SOCS2与伸长蛋白B/C复合物相互作用的氨基酸位点。通过比较不同物种SOCS1、SOCS2、SOCS6和SAB15蛋白SOCS2-BOX区的氨基酸序列,发现只有Leu和Cys在不同的序列中保守(图7C)。因此,作者假设Leu和Cys可能是SOCS2与伸长蛋白B/C相互作用的靶位点。为验证这一猜想,该研究构建SOCS2突变质粒(SOCS2LC→PP),其中SOCS2的Leu 162(L162)和Cys 166(C166)突变为Pro,SOCS2WT质粒作为对照(图7D)。Co-IP显示SOCS2WT可以与SLC7A11,伸长蛋白B和伸长蛋白C分别互作,而SOCS2LC→PP仅与SLC7A11互作,不与伸长蛋白B和伸长蛋白C互作(图7E)。此外,SOCS2LC→PP也导致SLC7A11泛素化降低(图7F),意味着伸长蛋白B/C在L162和C166位点与SOCS2互作以形成SOCS2/伸长蛋白B/C复合物,从而共同促进SLC7A11的泛素化降解。
总而言之,本研究详细研究SOCS2介导的HCC放射增敏促进铁死亡的过程。IR增加SOCS2表达,导致SLC7A11的减少,随后SOCS2-SH2与SLC7A11-NTD特异性识别,通过SOCS2的L162和C166位点与伸长蛋白B/C结合,并与E2泛素结合酶连接,诱导多聚泛素化(图8A,B)。最终,具有泛素链的SLC7A11被26S蛋白酶体识别并分解成蛋白质片段(图8C)用于降解,这最终有助于HCC铁死亡和放射增敏的发生。
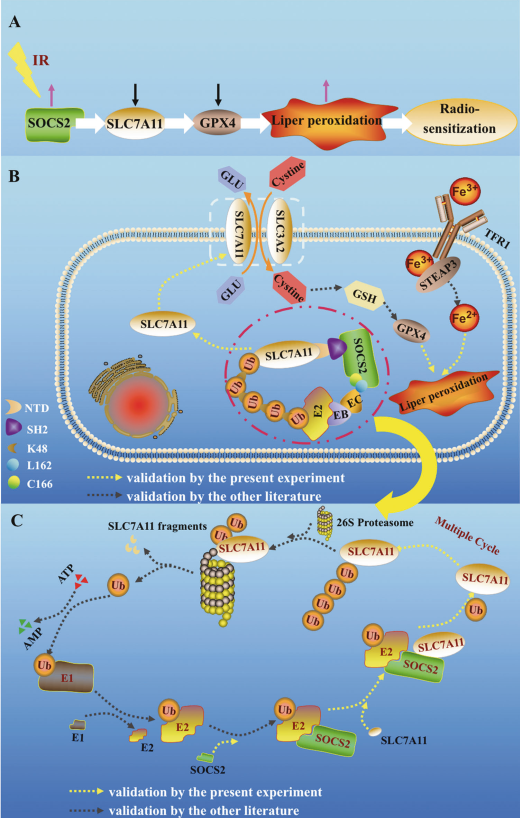
图8 增量SOCS2促进SLC7A11的泛素化降解,诱导HCC的铁死亡和放射增敏作用
实验方法
RNA-seq和测序分析,小鼠异种植肿瘤模型,免疫荧光(IF)检测,免疫组织化学(IHC)检测,WB,细胞内Fe2+的含量测定,细胞内脂质过氧化的测量,qRT-PCR,小干扰RNA(siRNA)转染,质粒转染,Co-IP,泛素化测定
参考文献
Chen Q, Zheng W, Guan J, Liu H, Dan Y, Zhu L, Song Y, Zhou Y, Zhao X, Zhang Y, Bai Y, Pan Y, Zhang J, Shao C. SOCS2-enhanced ubiquitination of SLC7A11 promotes ferroptosis and radiosensitization in hepatocellular carcinoma. Cell Death Differ. 2023 Jan;30(1):137-151. doi: 10.1038/s41418-022-01051-7.






