什么泡沫不泡沫不都得看LKB1吗
泡沫细胞形成是动脉粥样硬化的早期标志,大量研究表明血管平滑肌细胞(VSMCs)占据相当比例的泡沫细胞。肝激酶B1(LKB1)在心血管疾病中起重要作用。然而,LKB1在VSMCs衍生泡沫细胞形成和动脉粥样硬化中的作用尚不清楚。为探讨LKB1对VSMC源性泡沫细胞形成和动脉粥样硬化的影响,本研究构建了平滑肌特异性LKB1基因敲除(LKB1SMKO)小鼠。研究发现LKB1在斑块负荷的主动脉和氧化低密度脂蛋白(oxLDL)处理的VSMCs中表达下降。与对照组相比,LKB1SMKO小鼠的动脉粥样硬化发展通过促进VSMC源性泡沫细胞形成而加剧。相反,LKB1的过表达抑制VSMCs中的脂质摄取和泡沫细胞形成。研究显示LKB1与SIRT6结合并直接磷酸化并激活SIRT6,从而通过SIRT6依赖性的组蛋白去乙酰化减少凝集素样oxLDL受体-1(LOX-1)。并且,平滑肌中LOX-1缺陷可改善LKB1SMKO小鼠的动脉粥样硬化。本研究表明,LKB1可能通过SIRT6的磷酸化和激活来调节VSMC源性泡沫细胞形成和动脉粥样硬化。本文于2023年8月发表在《Cell Death Disease》IF:9.0期刊上。
技术路线

主要实验方法
1、LKB1在动脉粥样硬化斑块中的表达降低
为研究VSMC中的LKB1是否导致动脉粥样硬化,从颈动脉内膜切除术的患者和正常供体的对照颈动脉中获取动脉粥样硬化斑块,并对其进行免疫荧光。与对照动脉相比,动脉粥样硬化斑块中LKB1的表达减少(图1A)。用正常饮食(ND)或高脂饮食(HFD)喂养ApoE-/-小鼠12周。与ND组相比,HFD组小鼠主动脉中的LKB1蛋白水平明显降低(图1B)。此外,我们用免疫荧光技术评估α-SMA标记的VSMC中LKB1的表达,发现与ND组相比,HFD组小鼠主动脉平滑肌中的LKB1水平降低了(图1C)。从小鼠主动脉中提取的VSMCs 被用于以下体外实验。体外氧化LDL(100 μg/mL)处理72小时后,LKB1蛋白水平下降(图1D)。此外,LKB1的mRNA水平在oxLDL处理72小时后开始下降(图1E)。
接下来,测定oxLDL是否通过启动子甲基化下调LKB1的转录。用oxLDL处理VSMC细胞72小时,然后用抗5-MC抗体(用于识别甲基化DNA)进行MeDIP检测,用抗MeCP2抗体(用于识别与甲基化DNA结合的特异性蛋白质)进行ChIP检测。用ChIP或MeDIP检测的染色质DNA和针对LKB1启动子中 CpG岛的引物进行PCR检测的结果显示,经oxLDL处理的VSMC的LKB1启动子甲基化程度高于对照组(图1F,G),表明oxLDL通过启动子DNA甲基化下调VSMC中LKB1的表达。
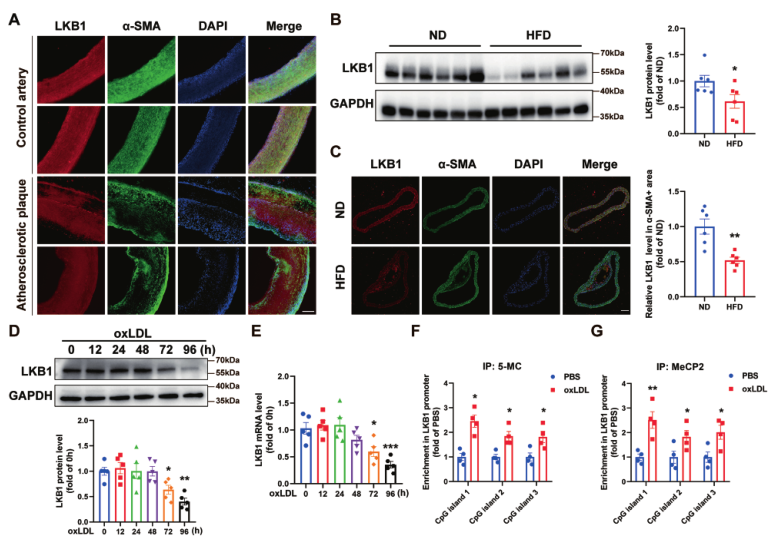
图1 LKB1在动脉粥样硬化斑块中的表达降低
2、平滑肌中LKB1缺失加速动脉粥样硬化
为探索平滑肌 LKB1 在动脉粥样硬化中的作用,利用注射了AAV8/D377Y-mPCSK9的对照组(CTR)和LKB1SMKO小鼠建立了动脉粥样硬化动物模型,并喂食Paigen饮食12周。结果显示相比于CTR小鼠,LKB1SMKO小鼠的主动脉表面和横断主动脉根部的动脉粥样硬化病变区域都更大(图2A,B),脂质负担更重(图2C)。此外,LKB1敲低增加了斑块中的巨噬细胞积累(图2D)。然而,LKB1敲低不影响血浆TG,TC,HDL-C和LDL-C的水平(图2E)。因此,平滑肌中LKB1缺失加速动脉粥样硬化。
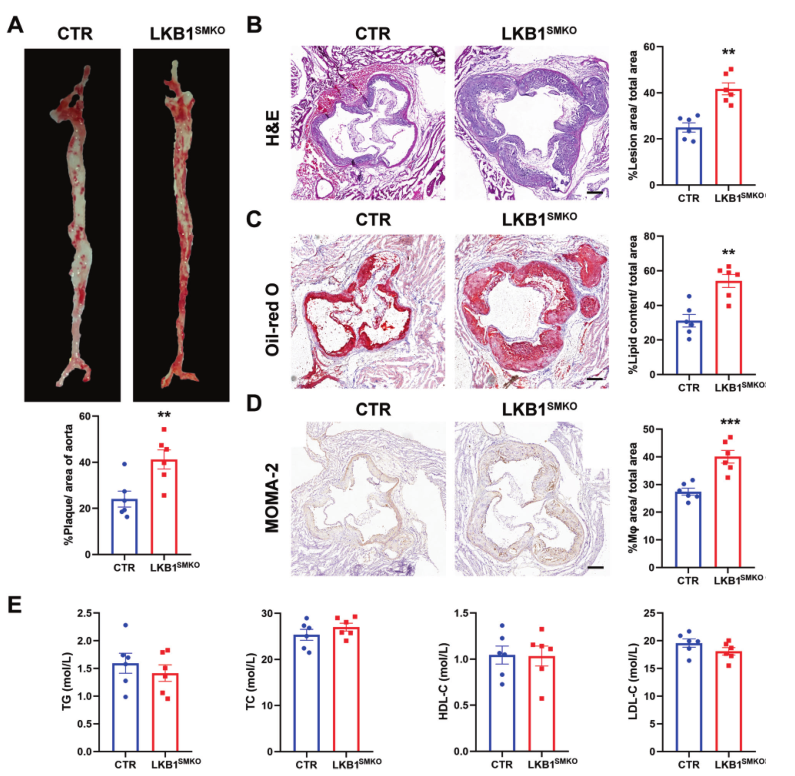
图2 平滑肌中LKB1缺失加速动脉粥样硬化
3、LKB1抑制VSMC来源的泡沫细胞的形成
为探索LKB1是否在VSMC衍生的泡沫细胞形成过程中发挥作用,使用BODIPY检测斑块中泡沫细胞的脂滴。斑块中BODIPY和α-SMA均呈阳性的细胞被认为是VSMC衍生的泡沫细胞。与CTR比较,LKB1SMKO小鼠斑块中BODIPY + /α-SMA+区域显著增加,表明LKB1敲除促进泡沫细胞的形成。为证实这一结果,用oxLDL刺激VSMC 24小时,以模拟体外VSMC衍生的泡沫细胞。在用oxLDL刺激VSMC之前的24小时,用腺病毒过表达LKB1,并用油红O染色法测定VSMC的脂质负荷。结果显示,与GFP组相比,过表达LKB1能显著减少脂滴在VSMC中的积累(图3B)。由于细胞内脂质含量取决于脂质摄取和胆固醇外流之间的平衡,脂质研究了LKB1是否抑制oxLDL的吞噬或增强胆固醇的外流。为评估血管内皮细胞摄取脂质的能力,用表达GFP或LKB1的腺病毒感染血管内皮细胞,然后用Dil-oxLDL处理血管内皮细胞。LKB1的过表达抑制了VSMC对Dil-oxLDL的吸收(图3C)。胆固醇外排实验表明,LKB1并不影响胆固醇从VSMCs排出(图3D)。培养CTR和LKB1SMKO小鼠的原代VSMCs并用oxLDL或Dil-oxLDL处理。不出所料,LKB1缺乏会增加脂质沉积和脂质摄取(图3E、F)。此外,LKB1缺乏并不影响胆固醇外流(图3G)。因此,得出结论,LKB1可抑制VSMC衍生的泡沫细胞形成。
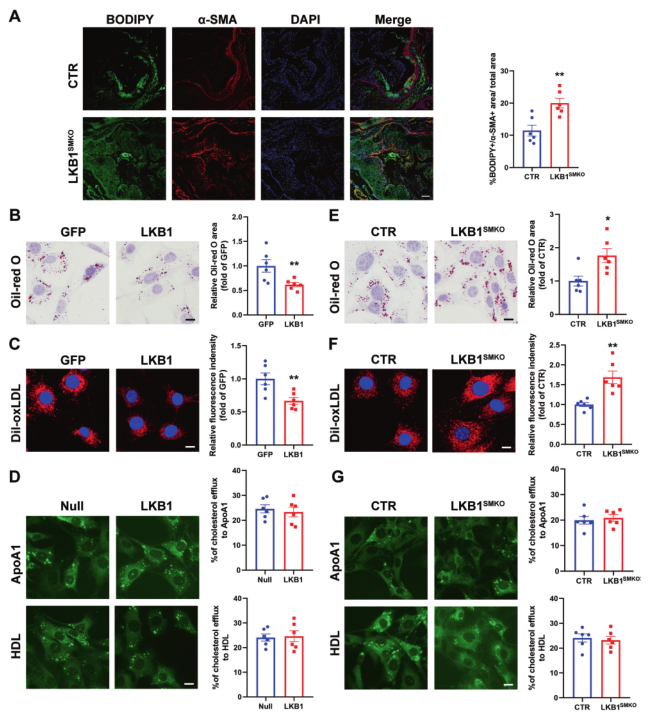
图3 LKB1抑制VSMC来源的泡沫细胞的形成
4、LKB1抑制LOX-1的表达
接下来,用WB测定负责胆固醇摄取和逆向转运的蛋白质的表达,结果显示,LKB1过表达会降低LOX-1的蛋白水平,而LKB1缺失则会升高LOX-1的蛋白水平。然而,LKB1并没有改变其他清除受体或胆固醇逆向转运体的蛋白水平(图4A,B)。此外,LKB1过表达会降低LOX-1 mRNA水平(图 4C),而LKB1缺失会增加LOX-1 mRNA水平(图4D)。此外,与CTR小鼠相比,LKB1SMKO小鼠主动脉中的LOX-1表达水平明显增加(图4E)。因此,LKB1可抑制LOX-1的表达,这可能是抑制VSMC衍生泡沫细胞形成的原因之一。

图4 LKB1抑制LOX-1的表达
5、LKB1通过LOX-1调控oxLDL的摄取
根据这些数据,脂质推测LKB1可通过下调LOX-1抑制VSMC衍生的泡沫细胞形成。为验证这一假设,用表达GFP、LOX-1或LKB1的腺病毒感染VSMC,然后处理oxLDL。油红O染色表明,LKB1过表达后脂质沉积和oxLDL吸收的减少被LOX-1过表达逆转(图5A,B)。在与oxLDL培养之前,用LOX-1 siRNA转染CTR和LKB1缺失的VSMC。LKB1缺失后,LOX-1的缺失持续抑制了脂质积累和吸收的增强(图5C、D)。总之,这些结果表明LKB1通过LOX-1减少了oxLDL的吸收。
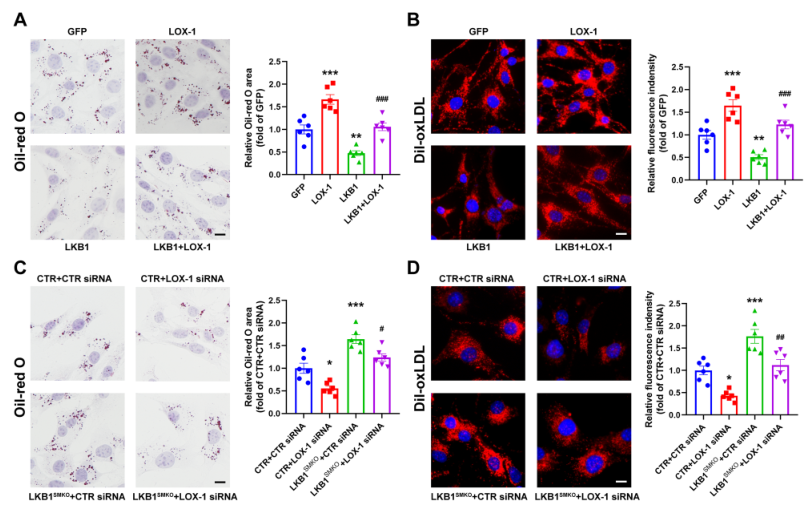
图5 LKB1通过LOX-1调控oxLDL的摄取
6、LKB1通过SIRT6调控LOX-1的表达
为研究LKB1调控LOX-1表达的分子机制,化合物C被用来阻断经典信号通路LKB1-AMPK。结果发现抑制AMPK并不能消除LKB1对LOX-1的下调作用,这表明LKB1以一种不依赖于AMPK的方式调控LOX-1的表达。为确定组蛋白乙酰化是否参与LKB1对LOX-1表达的调控作用,对感染了表达GFP或LKB1的腺病毒的VSMC进行乙酰基H3K9和H3K56的ChIP检测。如图6A所示,LKB1过表达后,LOX-1启动子中的H3K9和H3K56乙酰化水平显著降低。SIRT6是一种核去乙酰化酶,可调节巨噬细胞衍生泡沫细胞的形成。为确定SIRT6是否参与了LKB1对LOX-1的调控,用SIRT6 siRNA转染GFP或LKB1表达的VSMC。SIRT6的缺乏减轻了LKB1过表达引起的LOX-1表达的减少(图6B)。此外,SIRT6的缺乏也抑制了LKB1过表达引起的脂质积累和吸收的减少(图6C,D)。相反,SIRT6的过表达抑制了LKB1缺失的VSMC中LOX-1表达、脂质积累和脂质摄取的增加(图6E-G)。这些数据表明,LKB1通过SIRT6介导的组蛋白去乙酰化调节LOX-1的表达。

图6 LKB1通过SIRT6调控LOX-1的表达
7、LKB1磷酸化激活SIRT6
为验证LKB1和SIRT6之间的相互作用,用这两种蛋白的抗体进行免疫荧光染色,结果显示LKB1和SIRT6在VSMCs中部分共定位(图7A)。免疫沉淀试验显示,LKB1可与VSMC中的SIRT6结合(图7B)。这一点在转染了Flag标记的LKB1和HA标记的SIRT6的HEK 293 T细胞中得到进一步证实(图7C、D)。此外,GST牵引试验证明LKB1可直接与SIRT6结合(图7E)。
LKB1是一种丝氨酸/苏氨酸激酶,可磷酸化并激活下游蛋白,所以作者在线预测了LKB1可磷酸化SIRT6的位点,发现SIRT6序列中在人,小鼠,大鼠中保守的LKB1磷酸化位点是苏氨酸51,57,184。为检验LKB1能否在预测位点上磷酸化SIRT6,构建携带磷酸化位点突变体SIRT6(苏氨酸51、57和184被丙氨酸取代)质粒。用携带HA-SIRT6-WT或三种不同突变体(HA-SIRT6-T51A、T57A 和T184A)的质粒转染HEK 293 T细胞,然后用GFP或LKB1过表达腺病毒感染。用抗-HA或IgG进行免疫沉淀,然后用抗-磷酸(Ser/Thr)或抗-HA 一抗进行蛋白印迹分析。结果表明,LKB1提高了HA-SIRT6-WT和HA-SIRT6-T51A的磷酸化水平,但没有提高HA-SIRT6-T57A或HA-SIRT6-T184A的磷酸化水平(图7F)。此外,HA-SIRT6-WT和HA-SIRT6-T51A能显著降低VSMC的LOX-1表达和脂质摄取,而这些因素与HA-SIRT6-T57A和HA-SIRT6-T184A并无差异(图7G,H)。此外,用SIRT6活性测定试剂盒测定,LKB1能显著提高 VSMCs中SIRT6的去乙酰化酶活性,而苏氨酸57或184处的丙氨酸突变会阻断LKB1对SIRT6的激活(图7I)。此外,与HA-SIRT6-WT相比,磷酸拟态突变体(苏氨酸突变为天冬氨酸、HA-SIRT6-T57D和HA-SIRT6-T184D)表达的SIRT6进一步降低了VSMC的LOX-1表达和脂质吸收(图7J、K)。综上所述,这些数据表明LKB1在Thr 57和184位点磷酸化SIRT6,从而激活SIRT6,导致VSMCs中LOX-1表达和脂质吸收的减少。
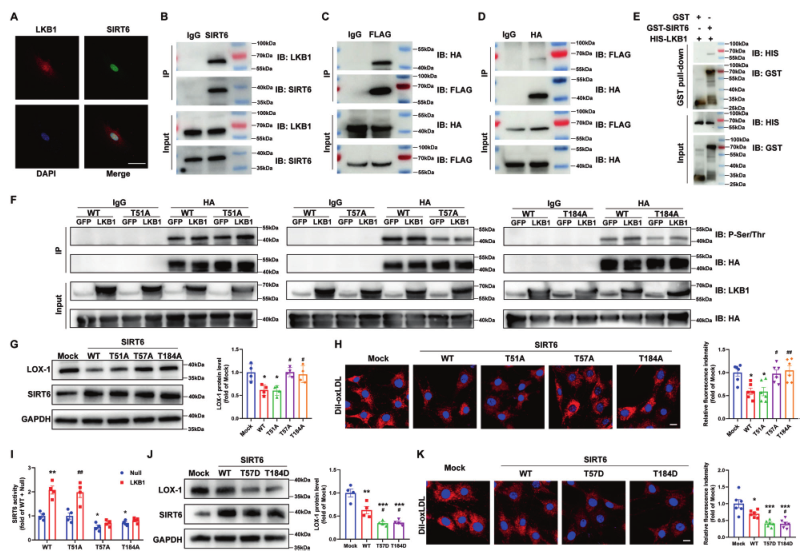
图7 LKB1磷酸化激活SIRT6
8、在LKB1敲除小鼠中平滑肌LOX-1缺失改善动脉粥样硬化
为探讨平滑肌LKB1缺乏是否会通过LOX-1促进体内动脉粥样硬化,用AAV9-shCON或AAV9-shLOX-1在SM22α启动子下感染CTR和LKB1SMKO小鼠,注射AAV8/D377Y-mPCSK9,并喂食Paigen饮食12周。与CTR相比,LKB1SMKO小鼠的斑块负荷更重,AAV9-shLOX-1可减轻斑块负荷(图8A-D)。此外,AAV9-shLOX-1也抑制了平滑肌LKB1缺失导致的病变中BODIPY+/α-SMA+区域的增加(图8E)。然而,平滑肌LOX-1的缺失并不影响LKB1SMKO小鼠的TG、TC、HDL-C或LDL-C水平(图8F)。因此,体内缺乏LOX-1可改善平滑肌LKB1缺失导致的动脉粥样硬化。
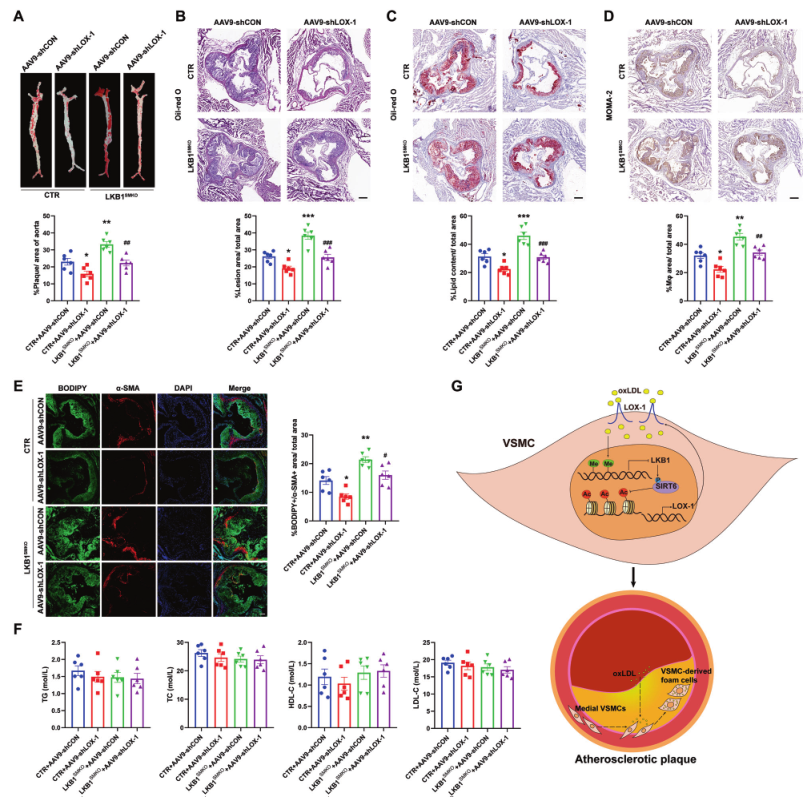
图8 在LKB1敲除小鼠中平滑肌LOX-1缺失改善动脉粥样硬化
实验方法
特异性敲除小鼠的构建,动脉粥样硬化病变测定,免疫荧光,免疫组化,脂质谱实验,油红O染色,BODIPY染色,胆固醇摄取实验,胆固醇外排实验,WB,qPCR,染色质免疫沉淀(ChIP),甲基化的DNA免疫沉淀(MeDIP)实验,共免疫沉淀(CoIP),Pull-down实验,SIRT6活性实验
参考文献
Deng Q, Li H, Yue X, Guo C, Sun Y, Ma C, Gao J, Wu Y, Du B, Yang J, Zhang C, Zhang W. Smooth muscle liver kinase B1 inhibits foam cell formation and atherosclerosis via direct phosphorylation and activation of SIRT6. Cell Death Dis. 2023 Aug 22;14(8):542. doi: 10.1038/s41419-023-06054-x. PMID: 37607939; PMCID: PMC10444762.






