STAT5通过促进组蛋白乳酰化促进PD-L1表达,以驱动急性髓系白血病的免疫抑制
随着基因组学和免疫学的快速发展,免疫治疗成为一种革命性的肿瘤治疗策略,免疫检查点抑制剂在包括血液系统恶性肿瘤在内的多种肿瘤中取得了成功。然而,急性髓性白血病(acute myeloid leukemia, AML)是一种异质性疾病,目前仍缺乏基于PD-1/PD-L1阻断的免疫治疗在AML中的应用的系统证明。因此,迫切需要识别驱动肿瘤免疫抑制的分子,并根据免疫检查点抑制剂的获益对患者进行分层。在这里,作者报道了STAT5在AML队列中高表达,并激活糖酵解基因的启动子来促进AML细胞中的糖酵解。因此,乳酸积累的增加促进了E3BP核易位和组蛋白乳酸化,最终诱导PD-L1转录。当免疫检查点抑制剂与STAT5组成型激活的AML细胞共培养时,可以阻断微环境中PD-1/PD-L1与反应性CD8+ T细胞的相互作用。临床发现,在新诊断的AML患者中,骨髓中乳酸的积累与STAT5以及PD-L1的表达呈正相关。因此,作者揭示了STAT5-乳酸-PD-L1网络在急性髓细胞性白血病进展中的作用,这表明STAT5诱导糖酵解和乳酸蓄积的急性髓细胞性白血病患者可能会从基于PD-1/PD-L-1的免疫疗法中获益。本文于2023年9月发表于《Nature communications》,IF=39.3。
技术路线
主要实验结果
1.STAT5通过干扰AML患者的T细胞功能来减弱免疫状态
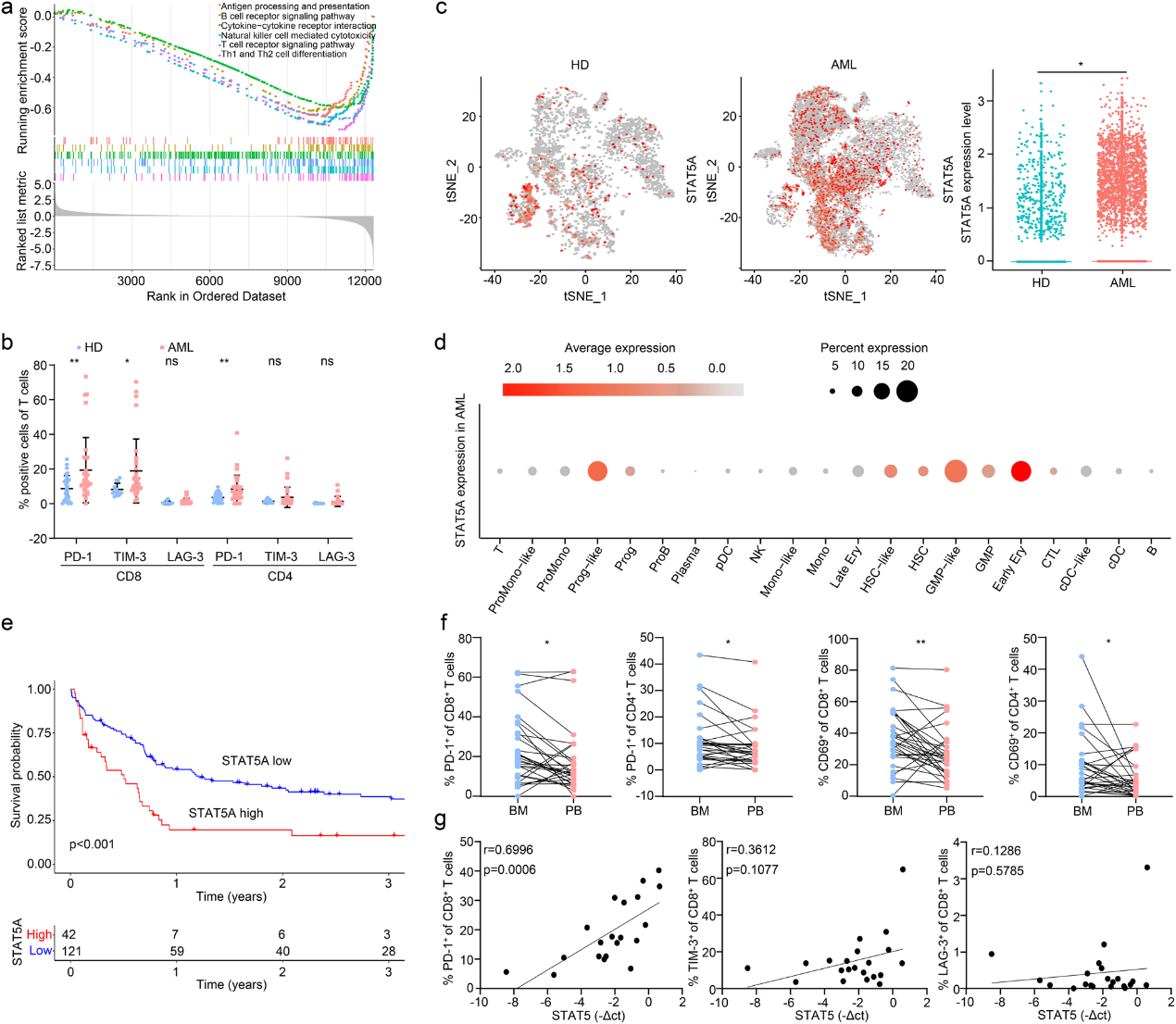
为了深入了解正常和恶性造血的免疫异质性,作者使用GSE9476数据集在健康供者和AML患者之间进行了GSEA。结果显示,AML患者中多种免疫相关通路下调(图1a)。通过验证T细胞标记在AML患者和健康供者外周血单个核细胞(PBMCs)上的表达,作者观察到AML患者CD8+T细胞中PD-1和TIM-3的表达明显上调(图1b)。这些结果表明,AML患者的T细胞免疫状态严重失调。
作者研究了STAT5是否导致AML免疫状态失调。STAT5在AML和健康供者中的表达通过GSE116256进行分析,结果显示STAT5 在AML患者的恶性细胞中高表达(图1c, d)。此外,对来自GSE12417的163名AML患者的生存分析显示,高STAT5表达与较短的总生存期显著相关(图1e)。接下来,作者比较骨髓单核细胞(BMMC)和AML的PBMC之间的T细胞功能差异,但PD-1和CD69在BMMC中的表达增加(图1f)。随后,作者研究发现STAT5表达与BMMC的CD8 + T细胞上的PD-1呈正相关(图1g)。因此,STAT5可能干扰患者T细胞的功能。
2.STAT5的组成型活化促进AML细胞中的糖酵解
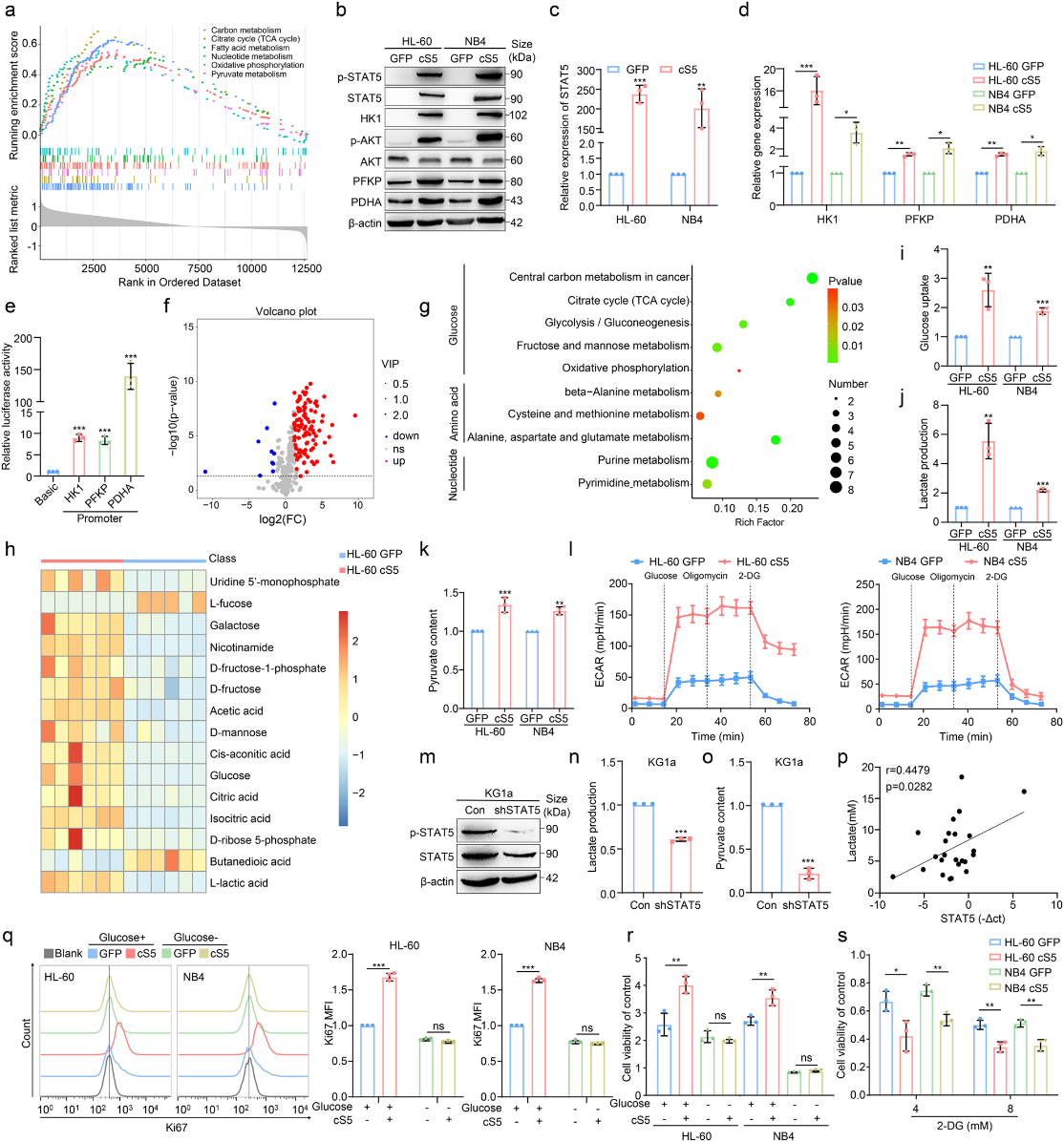
由于STAT5参与控制细胞代谢,作者通过鉴定GSE12417中的差异表达基因(DEGs)并根据STAT5的表达将其分为四分位数,继续评估STAT5如何影响白血病糖酵解。GSEA显示,STAT5高表达的AML患者的代谢途径上调(图2a)。然后,作者构建了STAT5组成激活(cS5) AML细胞,并检测糖酵解酶的表达。STAT5促进糖酵解酶的表达,包括HK1、PFKP 和PDHA。同时,评估代谢增强的指标磷酸化AKT (p AKT)在cS5过表达的细胞中也升高(图2b-d)。此外,糖酵解基因的荧光素酶报告基因活性被STAT5强效诱导(图2e)。
因此,STAT5可以激活HK1、FKP 和PDHA的启动子,促进它们的转录,进而上调葡萄糖代谢。作者进行了GC-MS非靶向代谢组学研究cS5过表达的AML细胞的代谢产物,发现112种代谢物发生了改变(图2f)。如图2g所示,通过 KEGG 富集分析,cS5过表达的AML细胞中的葡萄糖、氨基酸和核苷酸代谢等代谢途径发生了变化。值得注意的是,糖酵解中的葡萄糖、柠檬酸、异柠檬酸、d -核糖5-磷酸和l -乳酸在cS5过表达的AML细胞中增加(图2h)。cS5过表达的白血病细胞表现出糖酵解代谢的显著增加,通过增强葡萄糖摄取(图2i)、乳酸生成(图2j)和丙酮酸含量(图2k)来判断。同时,糖酵解应激试验也表明,cS5过表达的AML细胞的细胞外酸化率(ECAR)升高(图21)。此外,STAT5的敲低(图2m)降低了乳酸的产生和丙酮酸含量(图2n,o)。作者进一步证实, STAT5 的表达与AML患者骨髓(BM)中的乳酸生成呈正相关(图2p)。这些结果表明,STAT5可以上调AML中的糖酵解。通过去除培养基中的葡萄糖,这种作用得以恢复(图2q, r)。一致地,将AML细胞暴露于2-脱氧-d-葡萄糖(2-DG)后,cS5诱导的增殖可以逆转(图2s),这表明STAT5主要通过增加糖酵解来促进白血病生长。
3.T5介导乳酸诱导的AML细胞中PD-L1表达
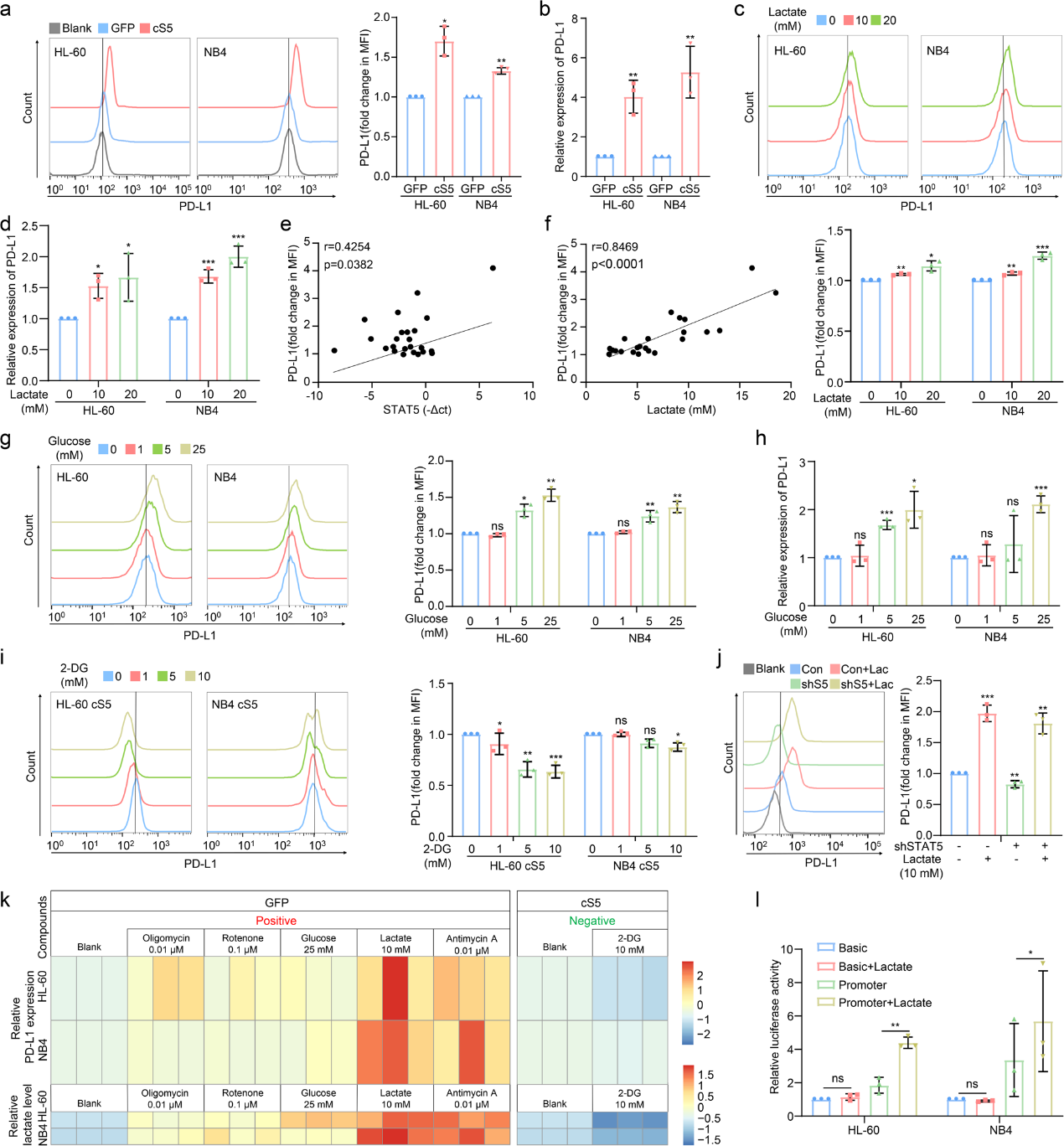
作者为了探讨STAT5在调节PD-L1表达中的作用,通过流式细胞术和qPCR分析发现,cS5显著上调了PD-L1的表达(图 3a, b)。为了解决乳酸诱导的PD-L1在AML中表达的生物学相关性,将乳酸直接供给AML细胞,诱导PD-L1表达(图3c)。PD-L1表达与AML患者骨髓中STAT5表达或乳酸含量呈正相关(图3e, f)的结果支持了这一观点。作者进一步评估了通过将细胞暴露于提供不同剂量葡萄糖的培养基中,糖酵解是否可以增强PD-L1表达,流式细胞术和qPCR显示葡萄糖刺激的AML细胞中PD-L1表达增加(图3g,h)。相反,当cS5过表达的AML细胞暴露于2-DG时,PD-L1表达和乳酸含量减弱(图3i)。在STAT5敲除的AML细胞中,PD-L1的减少可以通过额外的乳酸恢复(图3j)。此外,AML细胞暴露于不同的化合物中,这些化合物可以将氧化磷酸化转变为糖酵解。 结果显示,AML细胞中PD-L1表达与乳酸生成呈正相关(图3k)。然后,作者使用荧光素酶报告测定法分析了乳酸对PD-L1启动子活性的影响。重要的是,乳酸暴露后PD-L1启动子活性明显增强(图3l)。因此,乳酸可刺激PD-L1启动子启动PD-L1表达。
4.乳酸通过组蛋白乳酰化激活PD-L1基因表达
由于STAT5可以改善AML中乳酸的产生(图2j),而乳酸化是一种由乳酸介导的新型翻译后修饰,作者进一步研究了乳酸是否可以驱动乳酸化介导的PD-L1表达。事实上,STAT5可以增加AML细胞中组蛋白的泛乳酸化(Kla),而2-DG则相反(图4a)。作者用额外的乳酸培养AML细胞,并注意到组蛋白Kla被显著诱导(图4b)。接下来,作者评估了对照组和cS5过表达的AML细胞之间组蛋白特异性残基的乳酸化水平。STAT5诱导H3K18、H4K5、H4K8和H4K12的乳酸化水平(图4c)。 培养液中额外的乳酸显著诱导特定残基的组蛋白乳糖化(图4d)。一致地, 通过将AML细胞暴露于不同浓度的葡萄糖或2-DG来改变乳酸生成可以分别改变乳酸化(图4e)。此外,在STAT5敲除的AML细胞中观察到组蛋白乳酸化减弱(图4f)。同时,免疫荧光分析也支持上述结果(图4h)。乳酸源性H3K18的乳酸化已被证明可以直接刺激基因表达。同样,在cS5过表达的AML细胞中,PD-L1启动子区域中H4K5的乳酸化水平显著富集(图4i)。此外,通过将 AML 细胞暴露于更高浓度的葡萄糖中以诱导细胞内乳酸生成,H4K5乳酸化的富集也增加了(图4j)。因此,乳酸激活的PD-L1 基因表达可能是通过PD-L1启动子上的组蛋白乳酸化实现的。
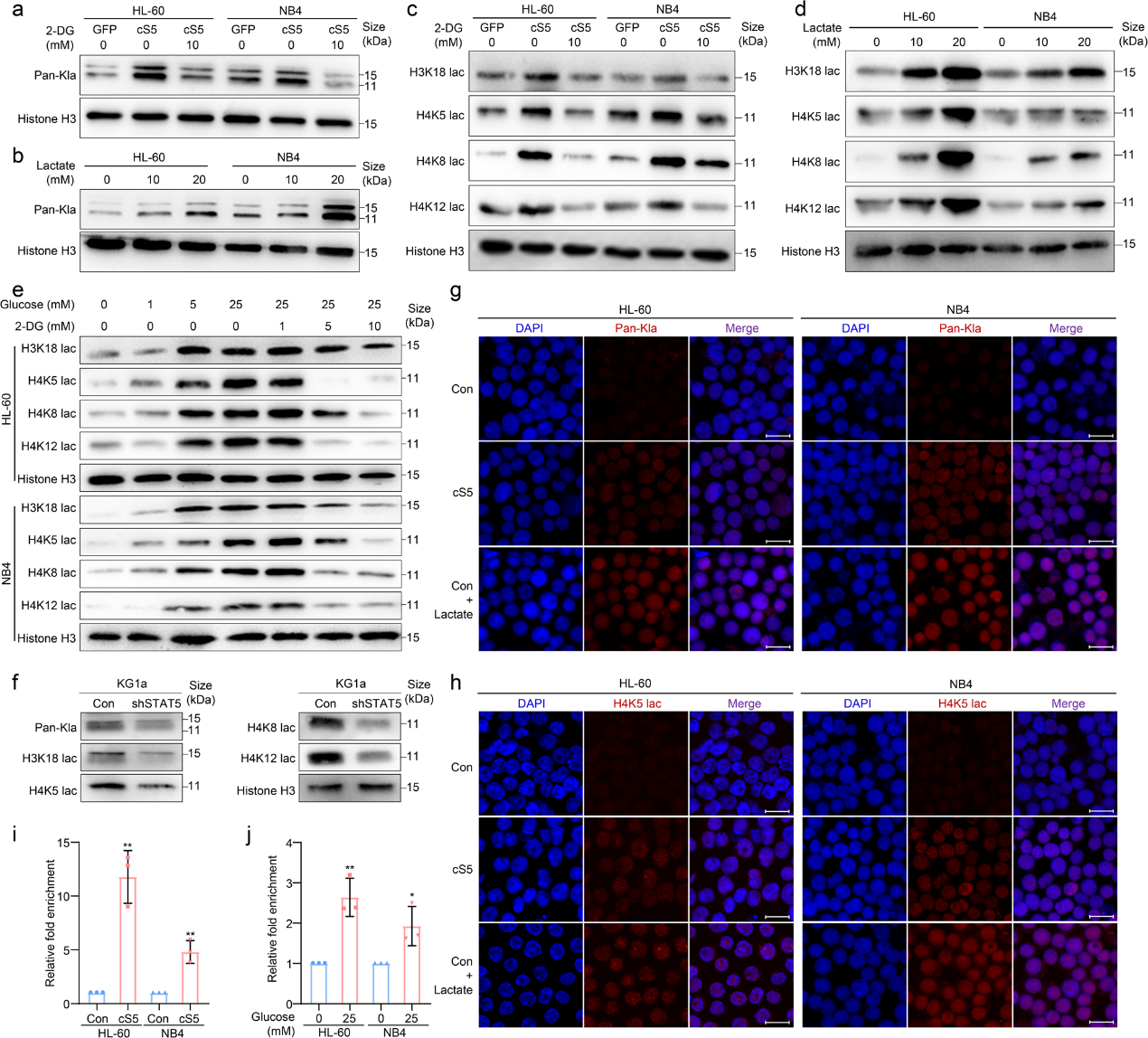
5.E3BP的核定位促进AML细胞中的H4K5乳酸化
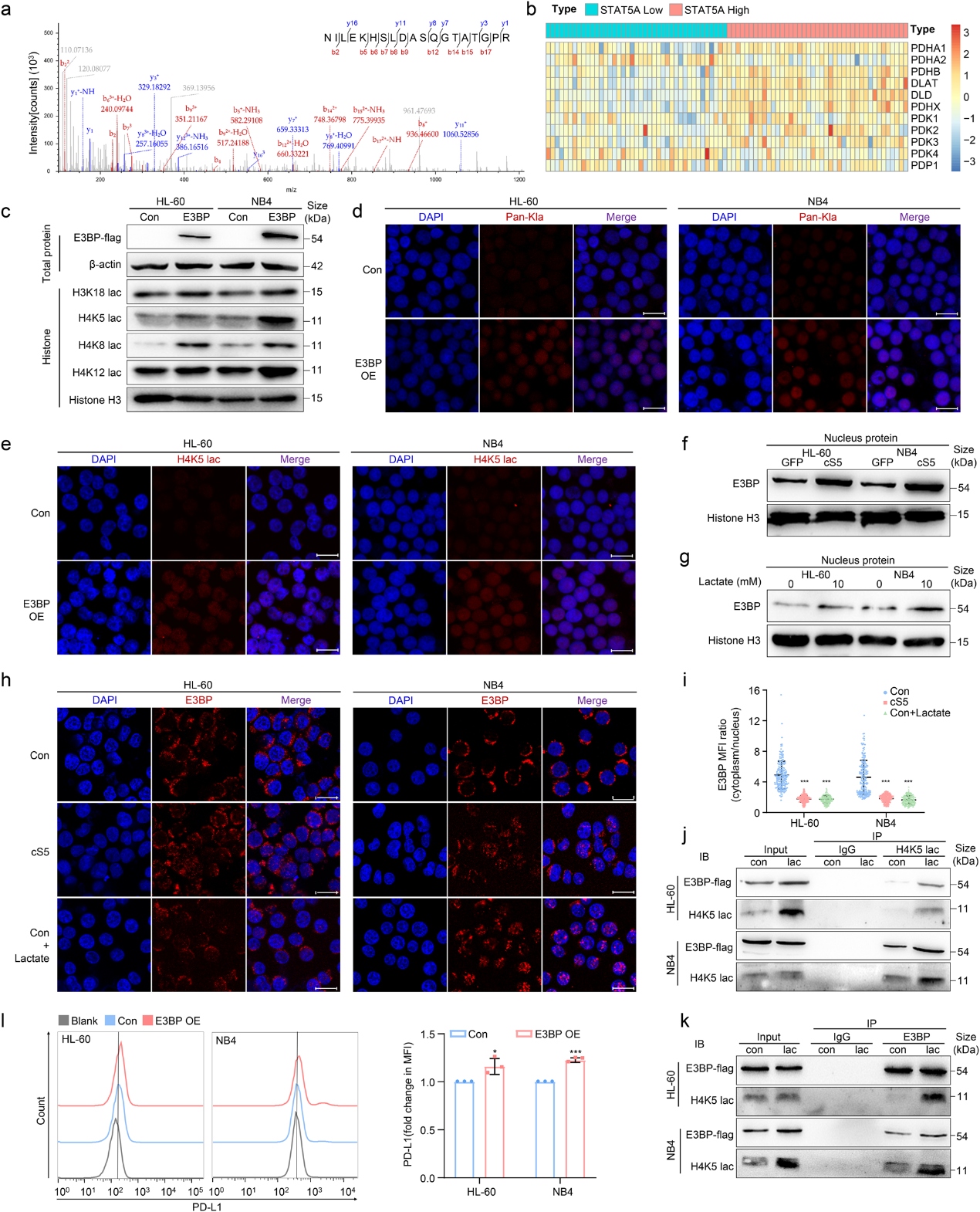
为了寻找AML细胞中调节组蛋白乳酸化的分子,作者使用LC-MS/MS验证了乳酸化H4K5的结合蛋白。结果表明,丙酮酸脱氢酶(PDH)复合物的组成部分E3BP可以与白血病细胞中的乳酸化H4K5相互作用 (图5a)。同时,根据STAT5的表达将源自GSE12417的AML患者分为四分位数,然后分析E3BP的表达。在STAT5高表达的AML患者中, E3BP (PDHX)基因表达升高(图5b)。接下来,作者构建了E3BP过表达的AML细胞,然后检测组蛋白乳酸化。结果显示,E3BP在AML细胞中显著诱导组蛋白乳酸化,包括H3K18、H4K5、H4K8和H4K12(图5c)。 此外,免疫荧光还显示,E3BP过表达后,Kla和H4K5乳酸化升高(图5d, e)。出乎意料的是,在cS5过表达的AML细胞中,E3BP在细胞核中富集,这表明E3BP核定位受STAT5调节(图5f)。与此一致的是, E3BP核易位在乳酸处理的AML细胞中升高(图5g-i)。此外,Co-IP 表明,在乳酸处理后,更多的E3BP与乳酸化H4K5相互作用(图5j, k)。一致地,AML细胞在E3BP过表达后表现出更高的PD-L1水平(图5l)。这些结果表明,乳酸促进E3BP核易位有助于组蛋白乳酸化。
6.STAT5通过上调PD-L1表达抑制T细胞活化
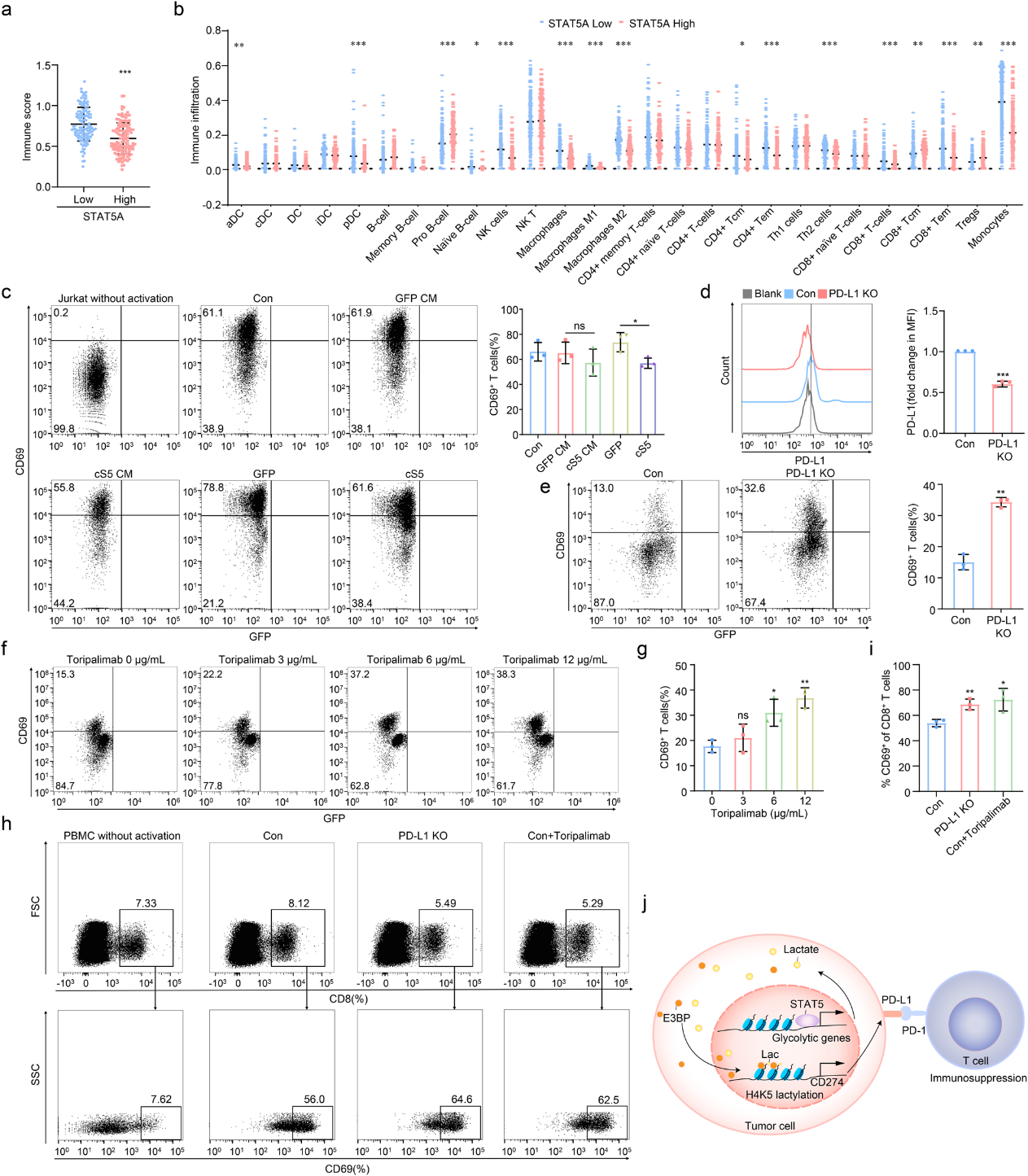
基于作者发现STAT5驱动AML细胞中PD-L1的表达(图3a),作者假设STAT5 可能抑制PD-L1介导的免疫功能。作者在GSE14468中描述了STAT5 高表达和低表达AML患者之间免疫景观的差异。值得注意的是,在STAT5高表达的AML细胞中,免疫评分降低,CD8+T细胞含量下降(图6a, b)。随后,作者在AML细胞和T细胞之间进行了共培养系统。在cS5衍生的条件培养基(CM)中培养的Jurkat细胞和对照AML细胞的活化水平相当。然而,Jurkat细胞与cS5 AML细胞直接接触显示, Jurkat细胞中CD69的表达明显下调(图6c),这表明STAT5 可能通过诱导PD-L1表达来抑制 Jurkat 细胞的活化。作者进一步生成 PD-L1 敲除(KO) HL-60 cS5 细胞(图 6d),然后与Jurkat细胞共培养。正如预期的那样,Jurkat细胞通过PD-L1敲除被重新激活(图6e)。通过使用PD-1中和抗体托利单抗治疗Jurkat细胞,阻断PD-1/PD-L1 相互作用,也恢复了Jurkat细胞的活化(图6f, g)。PBMCs的 CD8+ T 细胞在与PD-L1- ko HL-60 cS5 细胞共培养或暴露于特瑞普利单抗后被重新激活(图6h, i),支持AML中PD-L1抑制可能恢复被STAT5抑制的CD8+ T 细胞激活。
结论
综上所述, 由STAT5驱动的乳酸累积促进了PD-L1启动子上组蛋白的乳酸化,并最终诱导 PD-L1 的表达。免疫检查点抑制剂可以阻断STAT5 高表达AML中PD-1/PD-L1的相互作用,并重新激活CD8+T细胞。因此,作者的研究证明了新陈代谢-表观遗传学-免疫网络在急性髓细胞性白血病进展中的作用,STAT5诱导的乳酸可作为抗PD- (L)1免疫疗法应用于AML的预测性生物标志物。
参考文献
Huang, ZW., Zhang, XN., Zhang, L. et al. STAT5 promotes PD-L1 expression by facilitating histone lactylation to drive immunosuppression in acute myeloid leukemia. Sig Transduct Target Ther 8, 391 (2023).
生信分析:生物信息学分析
常规分子实验:质粒构建、qPCR检测、免疫印迹检测、组蛋白提取、免疫荧光染色、免疫共沉淀、荧光素酶报告基因检测、
细胞实验:慢病毒感染 、糖代谢指数的测量、流式细胞术、AML细胞和T细胞共培养测定、细胞糖酵解应激试验测定






