肺泡巨噬细胞外泌体分泌的Ficolin B通过cGAS-STING信号通路通过铁死亡加剧博来霉素诱导的肺损伤
多年来,肺损伤一直危害着全球人类的健康,因此对肺损伤的发病机制进行探索和及时干预是非常必要的。Ficolin B(Fcn B)是一种可识别多种配体的识别分子,在介导细胞周期、免疫反应和肺组织稳态中发挥着重要作用。然而,Fcn B在博莱霉素(BLM)诱导的肺损伤中的作用尚不明确。本研究旨在探讨Fcn B在博莱霉素诱导的肺损伤中的来源及其机制。研究选取WT、Fcna-/-和Fcnb-/-小鼠构建BLM诱导的肺损伤模型。利用肺上皮细胞构建BLM诱导的细胞模型。临床数据表明,间质性肺病(ILD)患者血浆中的 M-ficolin(Fcn B的同源物)含量升高。在小鼠模型中,巨噬细胞衍生的Fcn B加剧了BLM诱导的肺损伤和肺纤维化。Fcn B进一步促进了自噬和铁死亡的发展。值得注意的是,细胞实验结果显示,BLM诱导的AMs外泌体转运的Fcn B通过激活cGAS-STING通路加速了肺上皮细胞的自噬和铁死亡。与此相反,3-甲基腺嘌呤(3-MA)通过抑制自噬依赖性铁死亡,逆转了BLM诱导的AMs外泌体中的Fcn B对肺上皮细胞损伤的促进作用。同时,在BLM诱导的小鼠模型中,BLM诱导的AMs外泌体分泌的Fcn B的干预作用通过铁死亡促进了肺损伤和肺纤维化。综上所述,本研究表明,由AMs外泌体转运的Fcn B通过cGAS-STING信号通路促进肺上皮细胞铁死亡,从而加剧了BLM诱导的肺损伤。本文于2023年8月发表于《cell death & disease》,IF=9。
技术路线

主要实验结果
1.巨噬细胞来源的Fcn B加重BLM诱导的肺损伤和纤维化
首先,作者的临床数据显示,间质性肺病(ILD)患者血浆中L-ficolin(Fcn A的同源物)的浓度与健康人相比无明显差异,而M-ficolin(Fcn B的同源物)的浓度则明显升高(图1A)。为了探讨Fcn B对肺损伤的影响,用BLM刺激WT、Fcna-/-和 Fcnb-/-小鼠。在BLM诱导前,WT、Fcna-/-和Fcnb-/-小鼠的存活率均为100%。然而,BLM诱导的WT小鼠的存活率明显降低,而BLM诱导的Fcnb-/-(而非 Fcna-/-)小鼠的存活率则略有降低(图1B)。HE染色证明,BLM诱导后小鼠肺泡结构受到不同程度的损伤,肺泡壁增厚并伴有炎症浸润,表明肺损伤模型构建成功。与WT+BLM 组相比,Fcnb-/-+BLM 组的肺泡结构相对完整,炎症浸润最少(图1C)。代表组织纤维化的Masson染色显示,只有Fcnb-/-+BLM组的肺间质胶原纤维沉积量少于 WT+BLM组(图1D)。同样,Fcnb-/-+BLM组BALF中的总蛋白浓度和肺组织中的羟脯氨酸浓度也明显低于WT+BLM 组(图1E、F)。此外,Fcnb-/-+BLM组肺组织中α-SMA的表达也明显低于WT+BLM组(图1E,F)。此外,与WT+BLM组相比,Fcnb-/-+BLM组小鼠肺中α-SMA的表达明显下调(图1G)。BLM诱导后,WT和Fcna-/-小鼠肺部和血液中Fcn B表达的增加主要来自巨噬细胞(部分来自中性粒细胞)(图1H,I)。与BLM诱导的WT小鼠相比,BLM诱导的Fcnb-/-小鼠肺中巨噬细胞数量明显减少。这些结果证明巨噬细胞衍生的Fcn B加重了BLM诱导的肺损伤和肺纤维化。
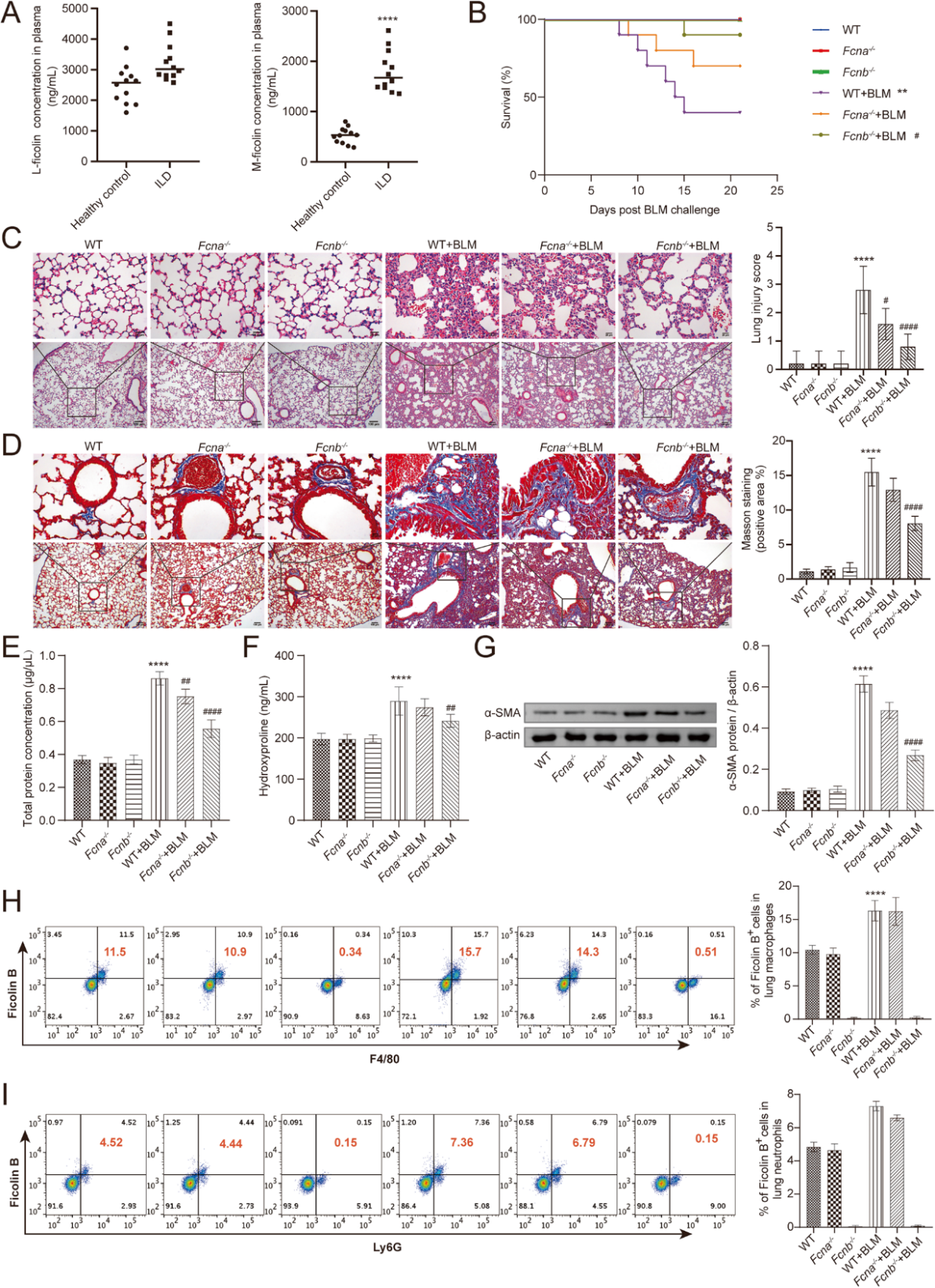
图1:来自巨噬细胞的Fcn B加重了BLM诱导的肺损伤和纤维化
2.Fcn B促进BLM诱导肺损伤模型中的自噬和铁死亡
接下来,为了探索Fcn B加重肺损伤的原因,作者检测了小鼠模型中与自噬和铁死亡相关的标志物水平。与WT+BLM组相比,Fcna-/-+BLM组和Fcnb-/-+BLM组的肺组织中LC3II/LC3I、Beclin1和ATG7的表达减少,而p62的表达增加(图2A)。与WT+BLM组相比,Fcnb-/-+BLM组肺和血清中MDA和Fe2+浓度降低,GSH浓度显著升高(图2B)。然后检测肺组织的ROS水平,结果显示Fcnb-/-+BLM组明显低于WT+BLM 组(图2C)。此外,与WT+BLM组相比,Fcnb-/-+BLM组肺组织中GPX4、SLC7A11、FTH1、FTL1表达明显增加,NCOA4表达减少(图2D、E)。因此,这些结果表明,在BLM诱导的肺损伤模型中,Fcn B可以促进自噬和死亡。
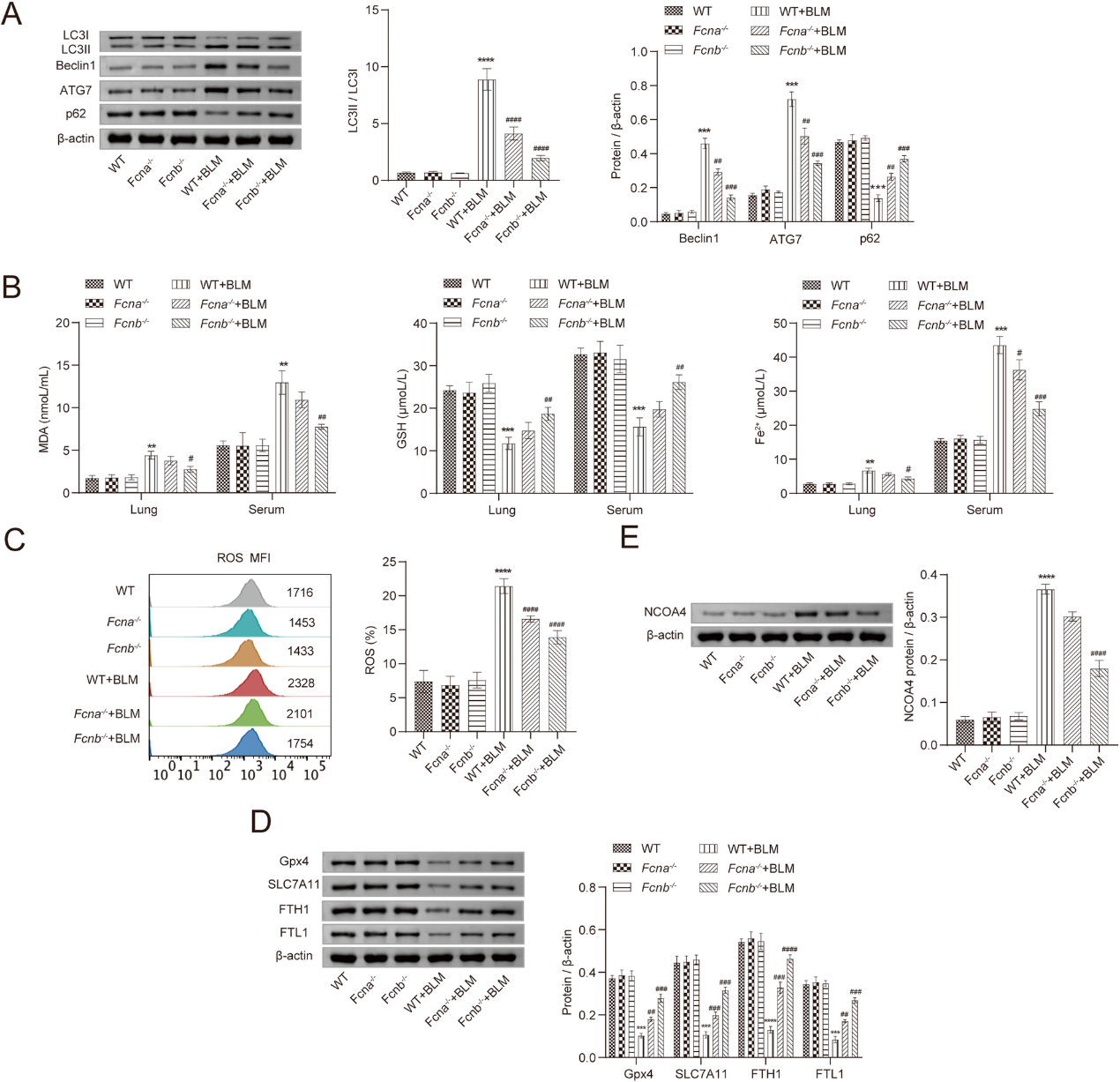
图2: Fcn B促进BLM诱导的肺自噬和铁死亡
3.BLM诱导的AMs外泌体加速肺上皮细胞中Fcn B的表达、自噬和铁死亡
作者应用外泌体抑制剂GW4869探讨其对AMs外泌体功能的影响。BLM诱导后,AMs中Fcn B的mRNA表达上调(图3A)。在Transwell细胞培养系统中,添加GW4869可抑制外泌体从上腔BLM诱导的AMs向下腔BLM诱导的肺上皮细胞的分泌和迁移(图3B)。当BLM处理过的肺上皮细胞与BLM处理过的AMs共同培养时,Fcn B的转录显著增加。不幸的是,使用GW4869后这一趋势被逆转(图3C)。随后,Western印迹结果显示,BLM处理过的肺上皮细胞与BLM处理过的AMs共同培养后,LC3II/LC3I、Beclin1和ATG7的表达上调,p62的表达下调。然而,添加GW4869可逆转这些变化(图3D, E)。生化检测进一步表明,与BLM处理过的AMs共同培养会显著增加BLM处理过的肺上皮细胞中MDA和Fe2+ 的浓度,同时降低GSH的浓度。然而,GW4869的存在降低了MDA和Fe2+的浓度,但增加了GSH的浓度(图3F,G)。此外,BLM处理的肺上皮细胞与BLM处理的AMs共培养后,ROS水平和死亡率也明显升高,但在GW4869条件下则有所下降(图3H,I)。同时作者发现,BLM处理的肺上皮细胞与BLM处理的AMs共同培养后,GPX4、SLC7A11、FTH1和FTL1的表达明显下调,而NCOA4的表达明显上调。然而,施用GW4869后,上述结果发生了逆转(图3J,K)。这些结果表明,AMs中Fcn B的调节可能是参与自噬和铁死亡的一种机制,从而减轻BLM诱导的肺上皮细胞损伤。
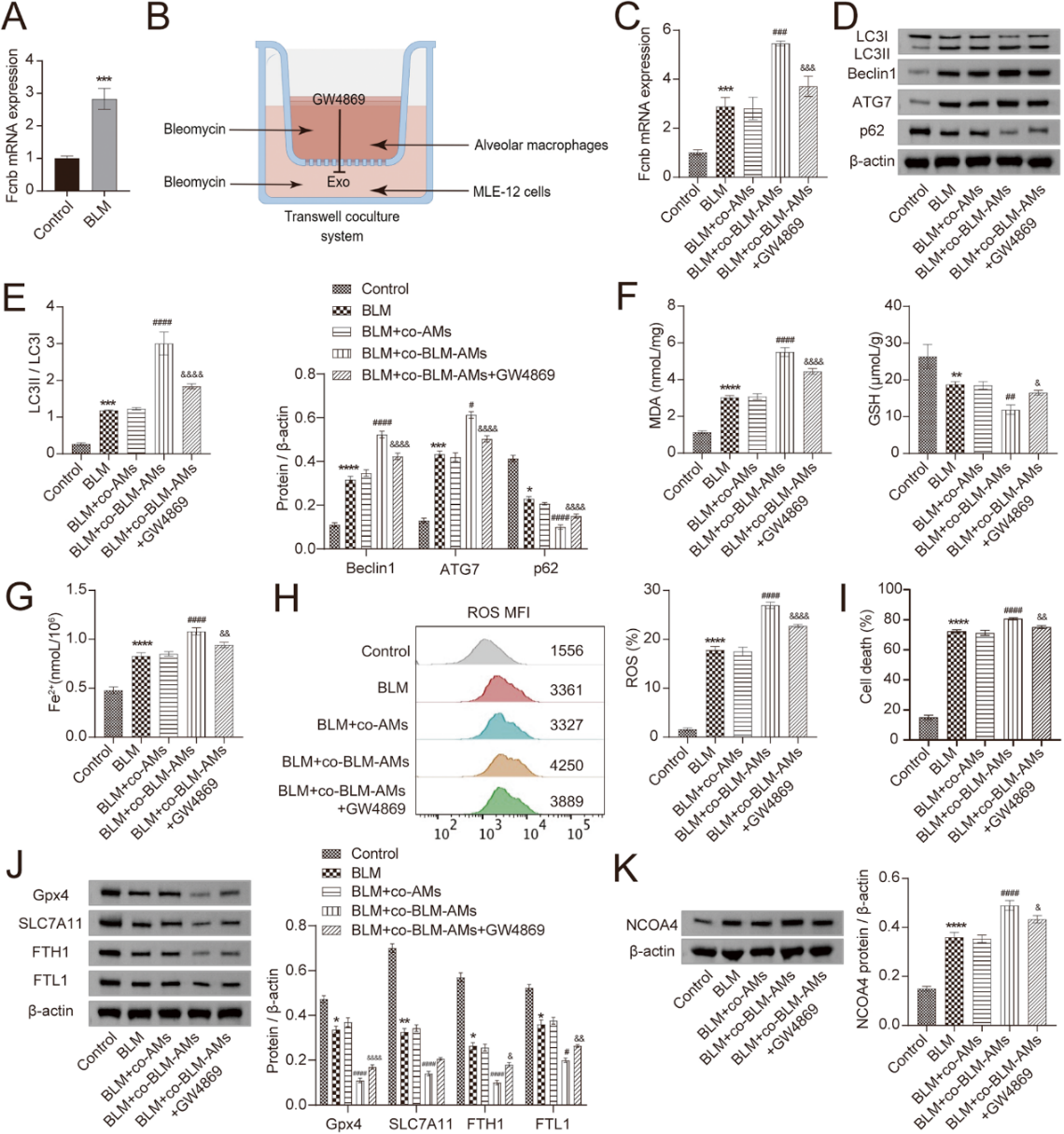
图3:BLM诱导的AMs外泌体增加Fcn B表达,促进肺上皮细胞自噬和铁死亡
4.BLM诱导的AMs通过外泌体转运的Fcn B介导肺上皮细胞自噬和铁死亡
为了研究AMs与Fcn B之间的联系,作者提取了外泌体并进行了一系列表征。NTA结果显示,大多数外泌体的大小在40到160 nm之间(图4A)。TEM图像显示,外泌体通常呈碟形,呈单一分布(图4B)。Western 印迹进一步显示,外泌体中表达了特定的标记物CD9、CD63和CD81(图4C)。PKH67标记的外泌体被肺上皮细胞成功吸收并分布在细胞核周围(图4D)。经BLM处理的肺上皮细胞与经BLM处理的AMs衍生的外泌体共培养后,Fcn B的mRNA表达上调(图4E)。BLM处理的肺上皮细胞与转染了oe-Fcnb的AMs衍生的外泌体共培养后,Fcn B的mRNA表达有更明显的增加。用si-Fcnb转染肺上皮细胞并用BLM处理后,Fcn B的mRNA表达明显受到抑制。然而,与转染了oe-Fcnb并经BLM处理的AMs衍生的外泌体共同培养可逆转这种效应(图4F)。随后的Western印迹结果显示,转染si-Fcnb可显著下调BLM处理的肺上皮细胞中LC3II/LC3I、Beclin1和ATG7的表达,并上调p62的表达。然而,与转染了oe-Fcnb和BLM处理过的AMs衍生外泌体共同培养却得到了相反的结果(图4G,H)。此外,生化检测结果表明,与转染了oe-Fcnb和BLM处理过的AMs衍生外泌体共培养后,si-Fcnb对MDA和Fe2+浓度的抑制作用以及对BLM处理过的肺上皮细胞中GSH的促进作用被逆转(图4I)。同样,与转染oe-Fcnb 和BLM处理的AMs衍生外泌体共培养后,转染si-Fcnb和BLM处理的肺上皮细胞的ROS水平和死亡率显著增加(图4J,K)。Western 印迹结果显示,在 BLM 处理的肺上皮细胞中,si-Fcnb转染可明显促进 GPX4、SLC7A11、FTH1和FTL1的表达,抑制NCOA4的表达。然而,当与转染了oe-Fcnb和BLM处理过的AMs衍生的外泌体共同培养时,这一趋势发生了逆转(图4L,M)。这些结果表明,BLM诱导的AMs 通过外泌体转运的Fcn B介导了肺上皮细胞的自噬和铁死亡。

图4:由BLM诱导的AMs转运的Fcn B外泌体有助于肺上皮细胞自噬和铁死亡
5.BLM诱导的AMs外泌体中的Fcn B通过cGAS-STING通路促进肺上皮细胞自噬和铁死亡
当用BLM诱导si-Fcnb或si-cGAS转染的肺上皮细胞时,cGAS、LC3II/LC3I、Beclin1和ATG7的表达下调,STING的磷酸化也降低,而p62的表达上调。然而,当它们与转染oe-Fcnb和BLM诱导的AMs共同培养时,cGAS、LC3II/LC3I、Beclin1和ATG7的表达上调,STING的磷酸化也增加,而p62的表达下调(图5A-C)。进一步研究发现,BLM诱导后,si-Fcnb或si-cGAS转染的肺上皮细胞中MDA和Fe2+的水平降低,而GSH的水平升高。然而,将转染oe-Fcnb的AMs与BLM诱导的AMs共同培养后,MDA和Fe2+的水平升高,而GSH的水平则相反(图5D,E)。同样,当转染了si-Fcnb或si-cGAS的肺上皮细胞被BLM诱导时,ROS水平和细胞死亡率均下降。相反,当它们与转染oe-Fcnb和BLM诱导的AMs共同培养时,ROS水平和细胞死亡率均升高(图5F,G)。铁死亡相关蛋白的检测发现,当转染si-Fcnb或si-cGAS的肺上皮细胞被BLM诱导时,GPX4、SLC7A11、FTH1和FTL1的表达上调,NCOA4的表达下调。不幸的是,当它们与转染oe-Fcnb和BLM诱导的AMs共培养时,GPX4、SLC7A11、FTH1和FTL1的表达下调,而NCOA4的表达上调(图5H,I)。这些结果表明,BLM诱导的AMs外泌体中的Fcn B促进了cGAS-STING通路介导的肺上皮细胞自噬和铁死亡。
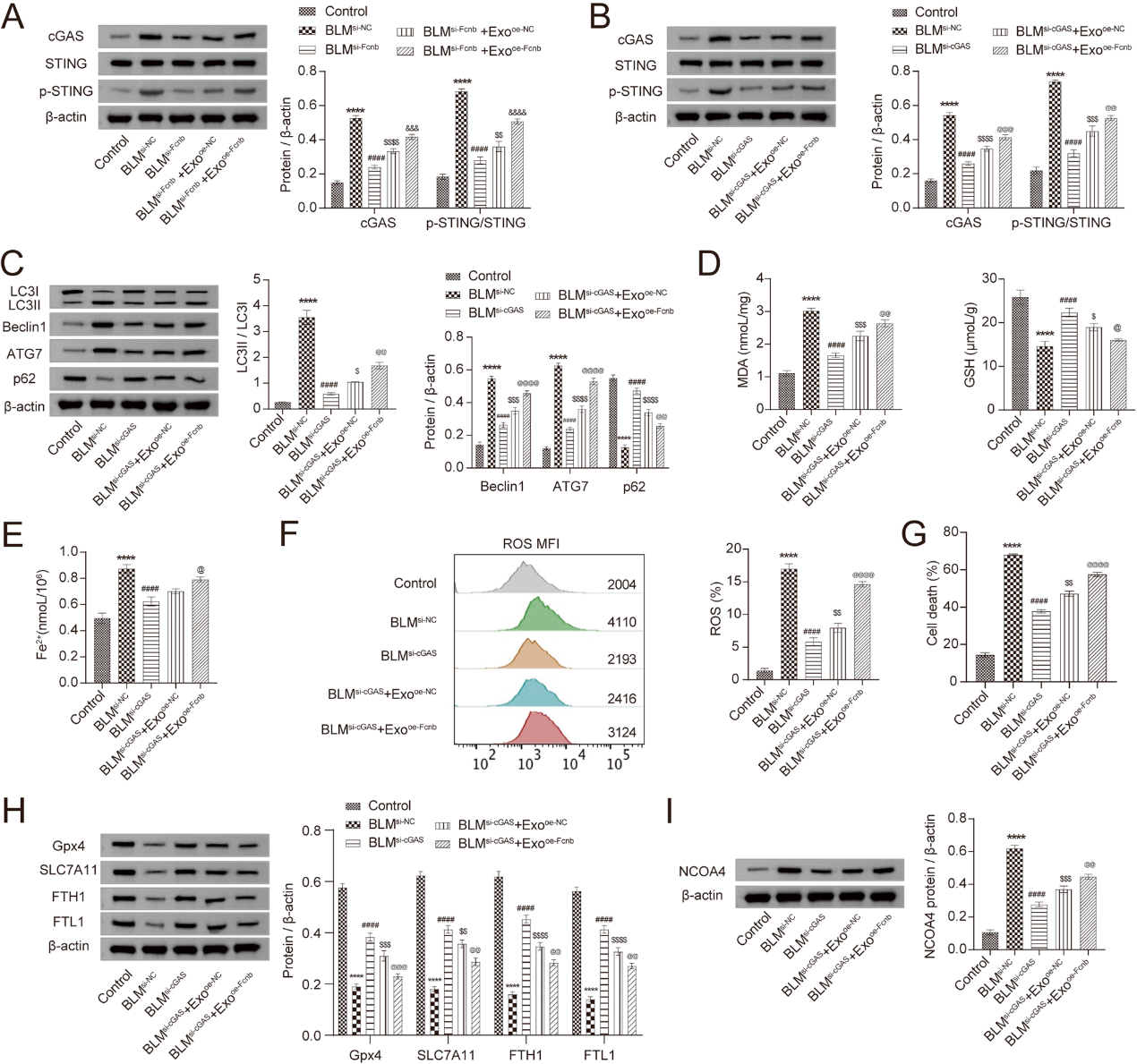
图5:cGAS-STING通路介导的肺上皮细胞自噬和铁死亡,由BLM诱导的AMs外泌体的Fcn B促进
6.BLM诱导的AMs外泌体中的Fcn B通过cGAS-STING途径促进的肺上皮细胞铁死亡是自噬依赖性的
为进一步阐明肺上皮细胞铁死亡与自噬的关系,将si-cGAS转染和 BLM诱导的肺上皮细胞与不同AMs的外泌体共同培养,并结合自噬抑制剂3-MA进行研究。si-cGAS转染的肺上皮细胞和BLM诱导的肺上皮细胞的线粒体损伤均有所减轻。当它们与转染oe-Fcnb和BLM处理过的AMs外泌体共同培养时,线粒体损伤加剧。然而,使用3-MA逆转了oe-Fcnb转染对细胞造成的损伤,细胞中的大多数线粒体保持正常状态(图6A)。此外,3-MA还降低了BLM诱导的AMs外泌体中的Fcn B对si-cGAS转染细胞和BLM诱导的肺上皮细胞的自噬促进作用,表现出 LC3II/LC3I、Beclin1和ATG7表达减少,p62表达增加(图6B)。接着,转染oe-Fcnb和BLM处理的AMs外泌体促进了si-cGAS转染和BLM处理的肺上皮细胞中MDA和Fe2+的积累,并抑制了GSH的合成,而添加3-MA则显示出相反的效果(图6C,D)。此外,si-cGAS转染和BLM处理的肺上皮细胞与oe-Fcnb转染和BLM处理的AMs外泌体共培养后,GPX4、SLC7A11、FTH1和FTL1的表达下调,NCOA4的表达上调,但这些变化在3-MA条件下相反(图6G,H)。这些结果表明,抑制自噬可通过cGAS-STING 通路减轻BLM诱导的AMs外泌体中的Fcn B促进的肺上皮细胞铁死亡。
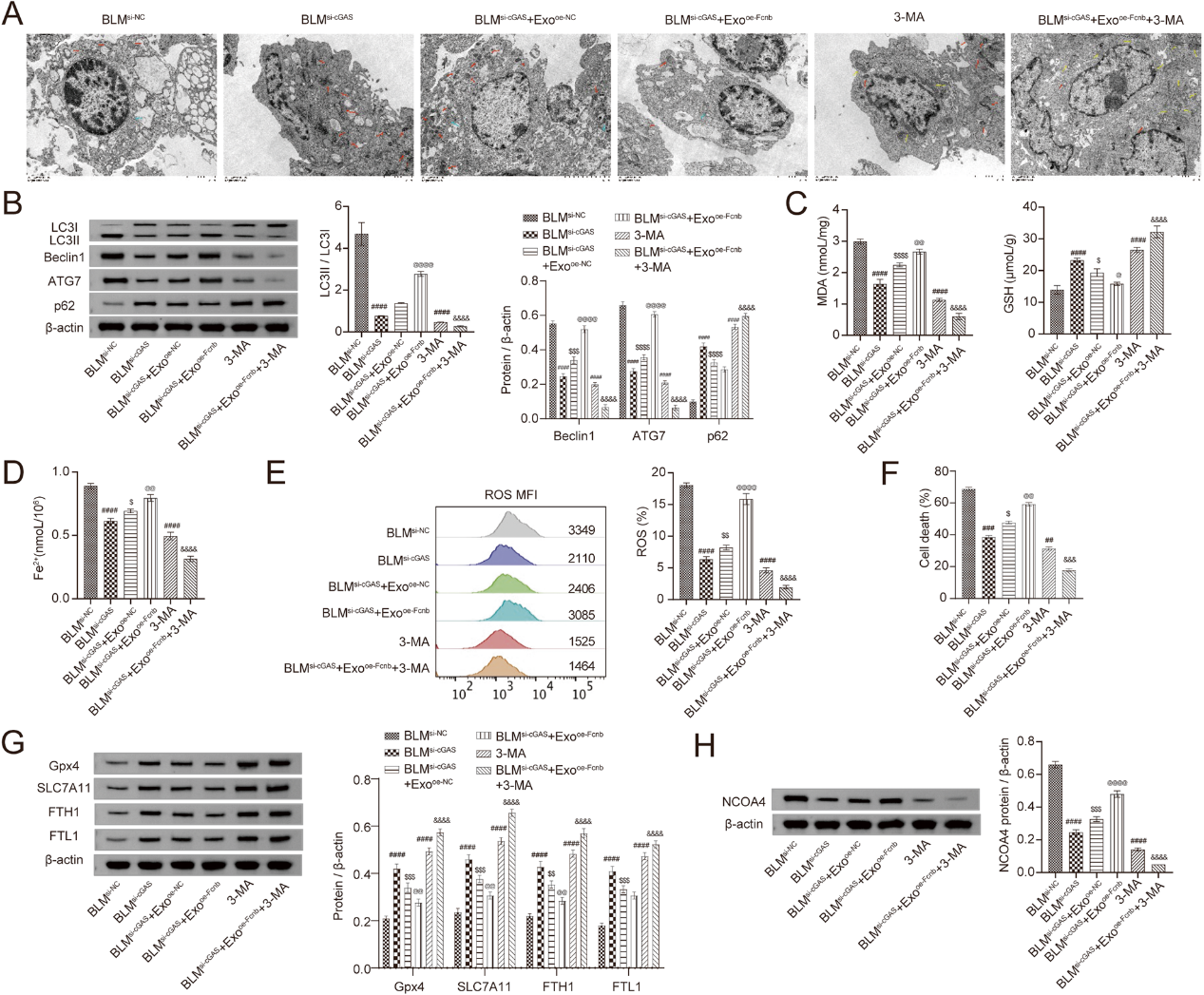
图6:抑制自噬可通过cGAS-STING通路减轻BLM诱导的AMs外泌体中的Fcn B 促进的肺上皮细胞铁死亡
7.在BLM诱导的小鼠模型中,从AMs外泌体转运的Fcn B通过铁死亡促进肺损伤和纤维化
为了研究AMs外泌体衍生的Fcn B在体内的功能,WT和Fcnb-/-小鼠受到BLM刺激后,尾静脉注射转染oe-Fcnb和BLM诱导的AMs外泌体进行干预。HE 染色显示,与WT+BLM组相比,Fcnb-/-+BLM组的肺泡结构更完整,炎症浸润更少。然而,与Fcnb-/-+BLM+Exooe-NC组相比,Fcnb-/-+BLM+Exooe-Fcnb组的肺泡结构不完整,炎症浸润增加(图7A)。Masson染色还显示,Fcnb-/-+BLM+Exooe-Fcnb组的肺间质纤维化增加(图7B)。此外,我们还发现Fcnb-/-+BLM+Exooe-Fcnb组比Fcnb-/-+BLM+Exooe-NC组肺组织BALF总蛋白浓度增加、羟脯氨酸和α-SMA表达增加(图7C-E)。此外,与Fcnb-/-+BLM+Exooe-NC 组相比,Fcnb-/-+BLM+Exooe-Fcnb组肺部组织中受损线粒体数量增加(图8A)。此外,与Fcnb-/-+BLM+Exooe-NC组相比,Fcnb-/-+BLM+Exooe-Fcnb组肺中LC3II/LC3I、Beclin1和ATG7的表达明显上调,p62的表达明显下调(图8B)。生化检测显示,与Fcnb-/-+BLM+Exooe-NC组相比,Fcnb-/-+BLM+Exooe-Fcnb组肺组织和血清中MDA和Fe2+浓度显著升高,而GSH浓度降低(图8C,D)。流式细胞术显示,Fcnb-/-+BLM+Exooe-Fcnb组肺组织中的ROS水平高于Fcnb-/-+BLM+Exooe-NC组(图8E)。此外,与Fcnb-/-+BLM+Exooe-NC组相比,Fcnb-/-+BLM+Exooe-Fcnb组肺组织中GPX4、SLC7A11、FTH1和FTL1的表达显著下调,而NCOA4的表达上调(图8F,G)。此外,Fcnb-/-+BLM+Exooe-Fcnb组中cGAS的表达和STING的磷酸化明显高于Fcnb-/-+BLM+Exooe-NC组(图8H)。这些结果表明,在BLM诱导的小鼠模型中,从AMs外泌体转运的Fcn B通过铁死亡促进了肺损伤和肺纤维化。
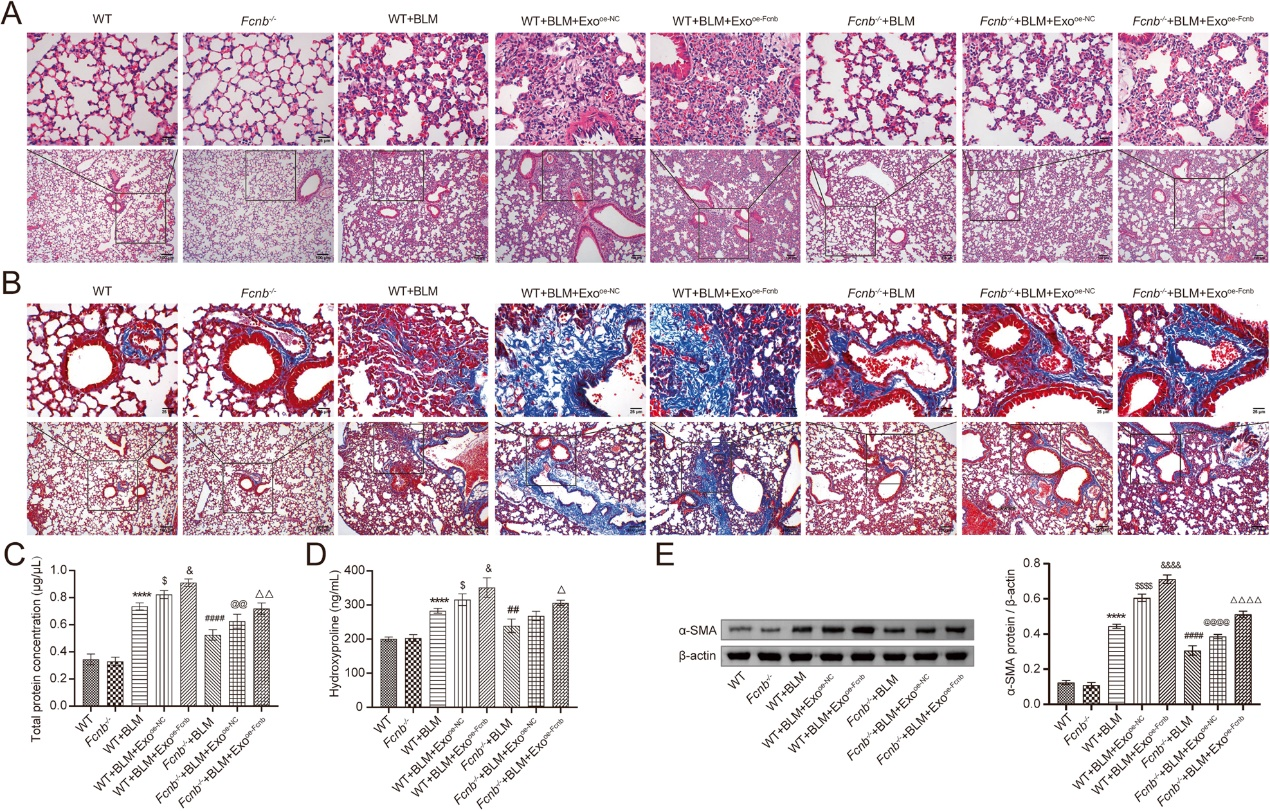
图7:AMs外泌体转运的Fcn B有助于BLM诱导的小鼠模型的肺损伤和肺纤维化

图8:AMs外泌体转运的Fcn B促进了BLM诱导的小鼠的铁死亡
结论
总之,这是第一篇研究Fcn B在BLM诱导的肺损伤中的作用的报道,它表明由AMs外泌体转运的Fcn B可通过cGAS-STING途径促进肺上皮细胞铁凋亡,从而加重BLM诱导的肺损伤(图9)。
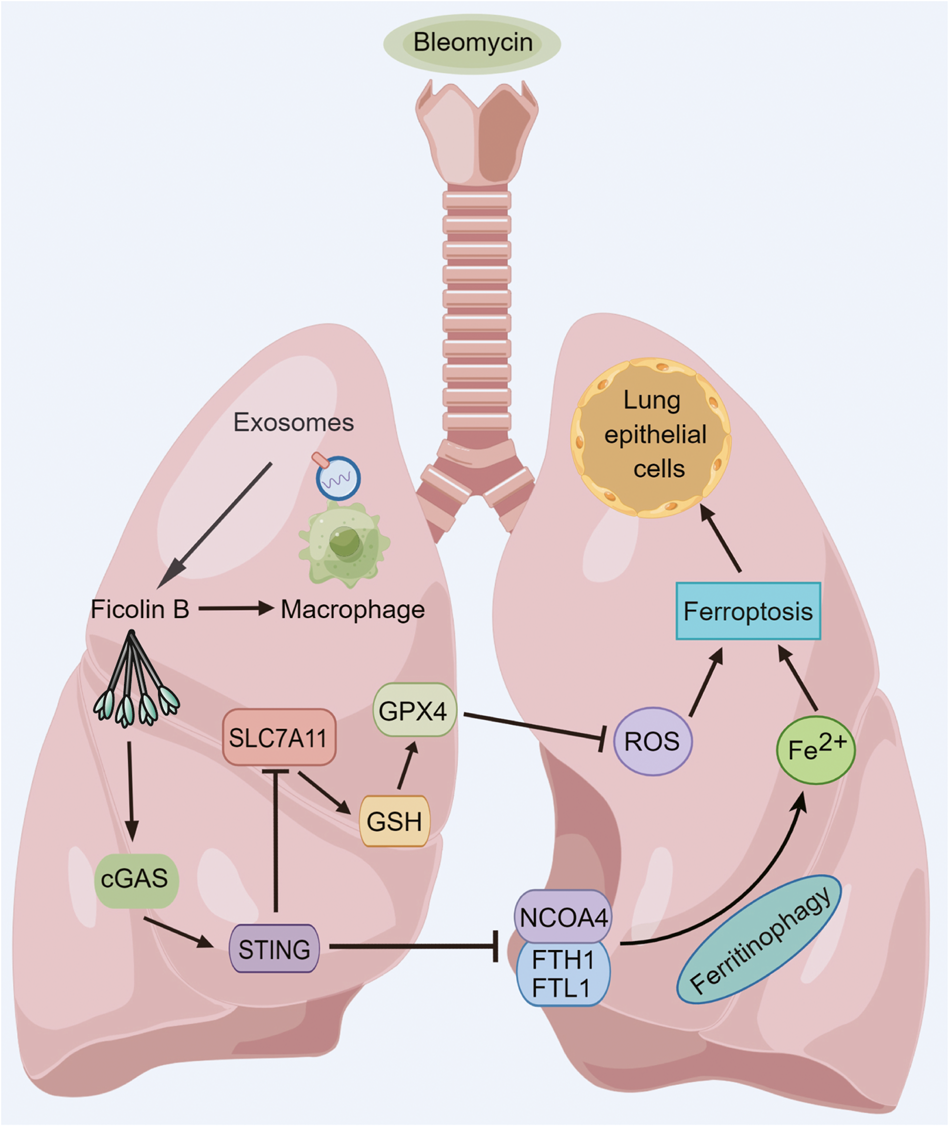
图9
参考文献
Wu, X., Jiang, Y., Li, R. et al. Ficolin B secreted by alveolar macrophage exosomes exacerbates bleomycin-induced lung injury via ferroptosis through the cGAS-STING signaling pathway. Cell Death Dis 14, 577 (2023). https://doi.org/10.1038/s41419-023-06104-4
常规分子实验
外泌体的提取和鉴定、HE染色、Masson染色、生化检测、蛋白质印迹检测、RT-qPCR
细胞实验
细胞培养和处理、流式细胞术
动物模型及病理实验
BLM诱导肺损伤模型的构建与干预






