FABP5通过降低FASN表达调控mTOR介导的自噬抑制结肠癌进展
脂质代谢在结肠癌的发生和发展中起重要作用。在本研究中,作者研究了脂肪酸结合蛋白5(FABP5)在结直肠癌(CRC)中的作用。首先,他们观察到CRC中FABP5显著下调,FABP5对细胞增殖、克隆形成、体内迁移、侵袭以及肿瘤生长有抑制作用。FABP5与脂肪酸合酶(FASN)相互作用,激活泛素蛋白酶体通路,导致FASN表达和脂质积累降低,抑制mTOR信号传导,促进细胞自噬。奥利司他是一种FASN抑制剂,在体内和体外均具有抗癌作用。此外,上游RNA去甲基化酶ALKBH5通过m6A非依赖性机制正向调控FABP5表达。该研究于2023年6月发表在《International Journal of Biological Sciences》,IF:9.2。
技术路线

主要研究结果
1. CRC中FABP5下调
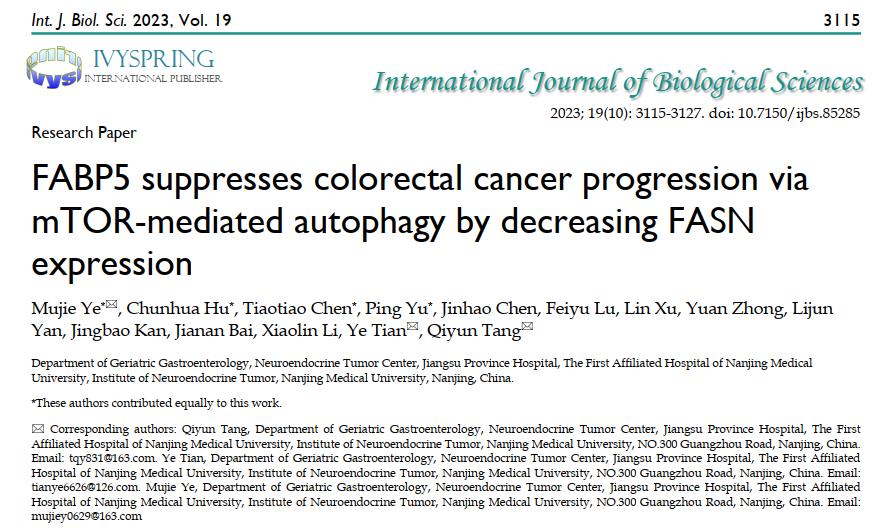
FABP5在肾透明细胞癌和肝癌中过表达,而在肺癌、乳腺癌和结肠癌中下调(图1A)。此外,肿瘤中FABP5 mRNA水平低于对照组织,但差异不显著(图1B)。生存分析数据表明,FABP5水平较高的患者预后更好(图1C)。作者最初创建了由90个CRC和肿瘤周围组织组成的肿瘤微阵列。其结果显示FABP5在CRC中显著下调(图1E-1F)。
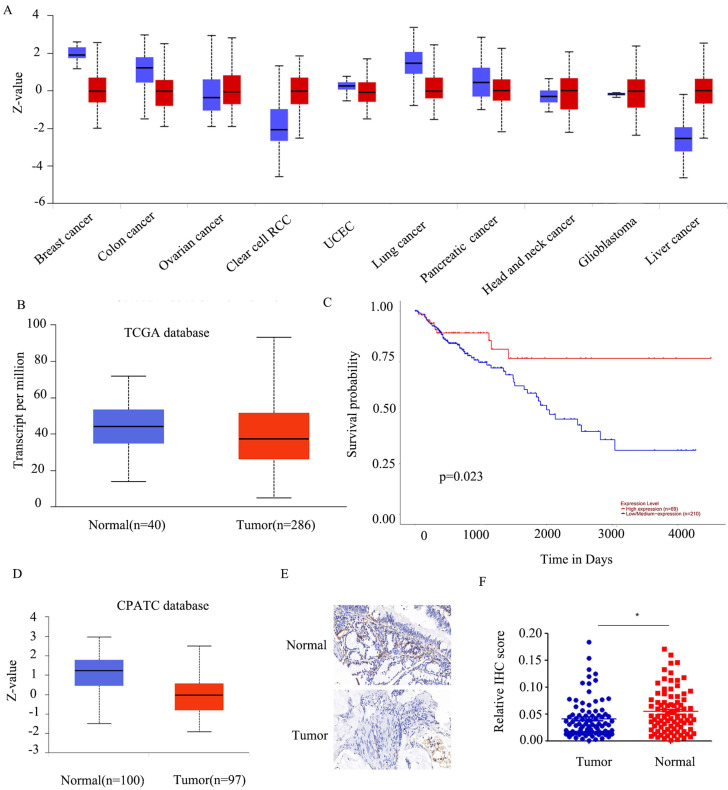
图1:CRC中FABP5沉默
2. FABP5过表达与CRC细胞增殖、迁移和侵袭减少有关
为明确FABP5是否在CRC中发挥肿瘤抑制作用,作者通过稳定转染产生稳定过表达FABP5的HCT116和SW620细胞系。WB结果验证了FABP5过表达的效率(图2A)。在CCK-8和EdU实验中,FABP5上调伴随着细胞增殖的抑制(图2B-2C;2F-2G)。此外,过表达FABP5的HCT116和SW620细胞克隆数量减少(图2D-2E)。在transwell实验中,FABP5上调抑制细胞迁移和侵袭(图2H-2J)。总之,FABP5在CRC中具有抗癌作用。
图2:FABP5过表达抑制细胞增殖、迁移和侵袭
3. 敲低FABP5促进CRC细胞增殖、迁移和入侵
为进一步探索FABP5在结直肠癌中的抗癌功能,作者在HCT116 和 SW620 细胞系中稳定敲低FABP5 。WB结果证实FABP5敲低效果(图3A)。在CCK-8和EdU实验中,FABP5下调促进细胞增殖(图3B-3C、3F-3G)。克隆形成测定中,FABP5抑制增加了HCT116和SW620细胞克隆数量(图3D-3E)。transwell结果显示,FABP5沉默促进HCT116和SW620细胞的迁移和侵袭(图3H-3J),这些结果均支持FABP5在CRC细胞中的抑瘤作用。

图3:FABP5敲除促进CRC细胞恶性生物学行为。
4. FABP5与FASN相互作用并促进泛素-蛋白酶体通路
通过免疫沉淀和质谱联合分析,作者共鉴定出395个与FABP5相互作用的蛋白。在这些互作蛋白中,FASN引起了作者的注意,它是一种脂肪酸合成酶。而Co-IP则证实FABP5与FASN发生互作(图4A)。敲低FABP5导致FASN表达增加,相反,过表达FABP5诱导FASN减少(图4B)。用CHX处理后,FASN稳定性在FABP5敲低组中增加,而在FABP5过表达组中降低。此外,MG132处理后FASN水平显著升高(图4C)。FASN和泛素的Co-IP结果表明,FABP5过表达导致泛素与FASN结合增加(图4D)。然后,作者通过shRNA或奥利司他抑制FASN。FASN敲低条件下(图4E),细胞增殖(图4F,4H)、克隆形成(图4G)、细胞迁移和侵袭(图4I)受到抑制。在奥利司他处理组中也观察到类似的结果(图4J-4M)。以上结果表明,FABP5通过刺激泛素-蛋白酶体通路调节FASN。
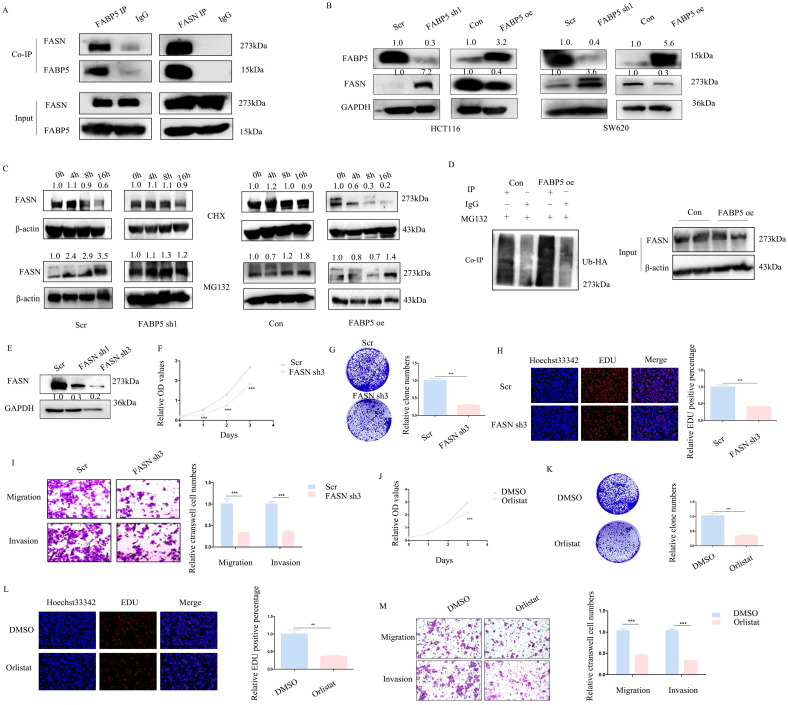
图4:FABP5与FASN互作发挥肿瘤抑制作用
5.敲低或抑制FASN抑制由FABP5下调激活的恶性生物学行为
上述结果表明,FABP5下调促进CRC中的恶性生物学行为。为探讨FASN上调是否介导致癌活性,作者在FABP5下调稳定转染的细胞中进行FASN敲低或奥利司他处理。首先,WB检测到敲低效果(图5A)。CCK-8、克隆形成和EdU实验表明,下调FASN或抑制其活性则抑制了由FABP5敲低促进的细胞增殖(图5B-5F)。在transwell中,FASN沉默或抑制逆转了由FABP5下调诱导的迁移和侵袭增加(图5G-5H)。尼罗红染色结果表明,FABP5过度表达减少脂质积累,而其敲低增加脂质积累(图5I)。FASN耗竭引起FABP5沉默诱导的脂质积累减弱,突出FASN在FABP5调节恶性行为中的关键作用(图5J)。此外,野生型CRC细胞中只有FASN敲除始终导致脂质积累减少(图5K)。这些结果表明,由FABP5下调启动的致癌进展能够被CRC细胞中抑制FASN而恢复。

图5:奥利司他恢复FABP5下调诱导的CRC细胞恶性行为
6.FABP5通过FASN介导的mTOR通路失活促进自噬
作者对FABP5过表达和FASN敲除进行RNA-seq和脂质组学研究。与许多生物学过程和信号通路相关的基因发生失调,其中包括TGF-β、Hippo、Wnt、NF-κB和mTOR,正如RNA-seq中观察到的一样(图6A)。脂质组学分析表明,FABP5和FASN通过影响脂质代谢调节自噬(图6B,6D)。WB结果证实,FABP5上调促进自噬,而FABP5敲低抑制自噬(图6E)。此外,FASN沉默或奥利司他处理挽救了FABP5沉默诱导的自噬抑制(图6F)。而FABP5过表达抑制mTOR通路,FABP5敲低激活mTOR通路(图6G)。FASN沉默和FASN抑制剂处理均使mTOR通路失活(图6H),这些结果支持FABP5通过FASN抑制mTOR发挥肿瘤抑制作用。
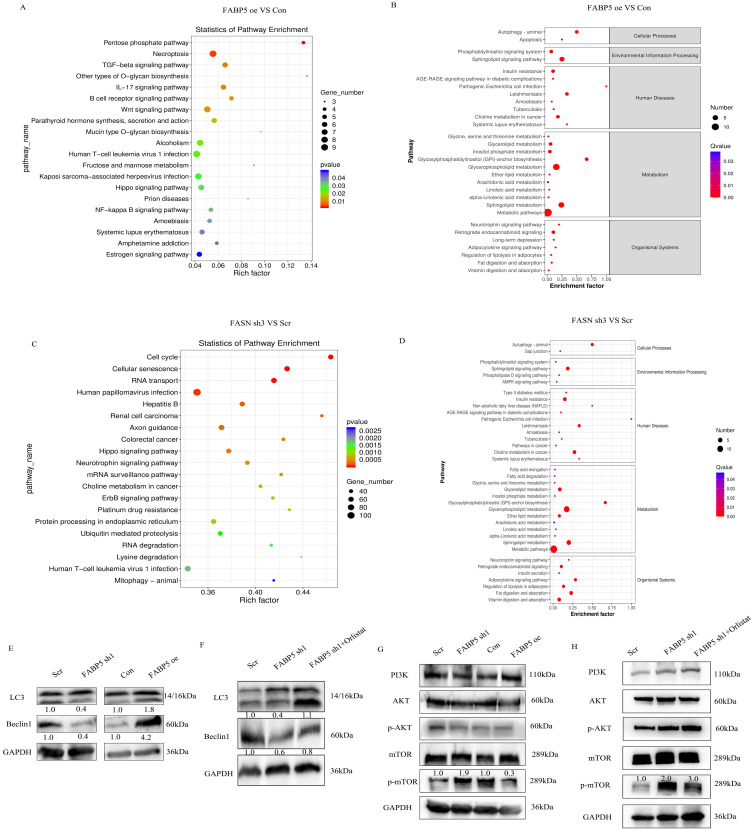
图6:FABP5与FASN互作通过mTOR通路促进细胞自噬
7. FABP5过表达和FASN敲除抑制体内肿瘤生长
作者借助肿瘤异种移植物模型进一步研究FABP5和FASN在体内的作用。作者将FABP5过表达或FASN敲低载体、FABP5敲低载体加奥利司他和对照载体转染SW620细胞,然后细胞植入裸鼠当中。注入FABP5过表达和FASN敲低载体的SW620细胞的小鼠异种移植物中,肿瘤重量和体积降低(图7A-7F)。相反,与对照组相比,具有稳定FABP5敲低的SW620细胞显示出肿瘤生长加速,而对照组被奥利司他抑制(图7G-7I)。FABP5和FASN的免疫荧光染色表明FABP5在体内负向调节FASN(图7I-7J)。总之,以上结果支持体外和体内FABP5在FASN介导的CRC进展中发挥重要作用。
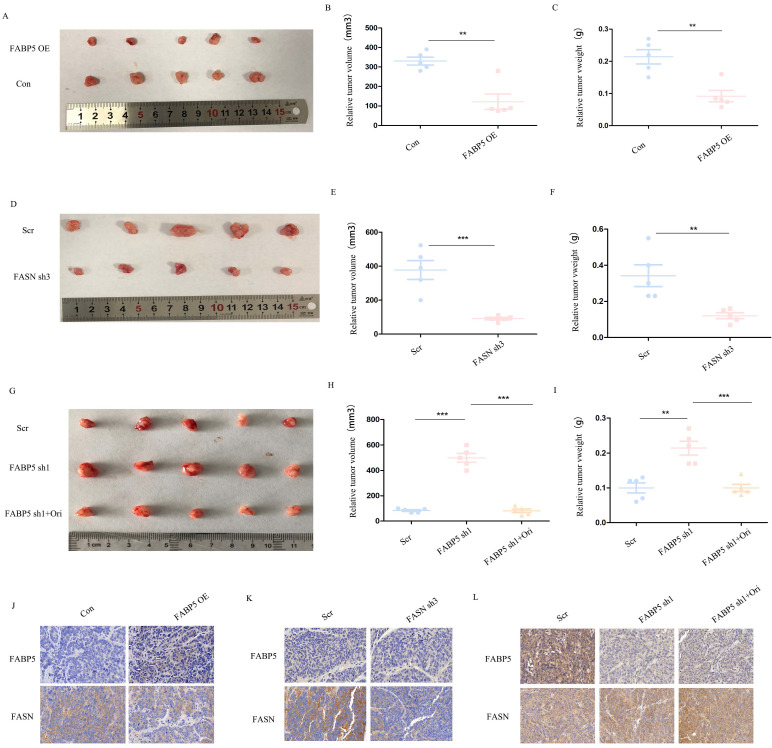
图7:FABP5通过体内调节FASN抑制肿瘤生长
8. ALKBH5以m6A独立方式调节FABP5
接下来,作者重点研究CRC中FABP5下调机制。m6A预测服务器SRAMP揭示FABP5上丰富的m6A修饰位点。敲除m6A阅读器(METTL3、METTL14、WTAP)和去甲基化酶(FTO和ALKBH5)后,ALKBH5缺失条件下,观察到FABP5正向调节(图8A、8B)。此外,ALKBH5负向调节FASN水平(图8C-8E)。为探索ALKBH5是否通过FABP5抑制CRC,作者耗竭了ALKBH5过表达细胞中的FABP5(图8F)。ALKBH5的抗癌作用(包括抑制细胞增殖、迁移和侵袭)通过FABP5沉默部分恢复,这表明FABP5可能是ALKBH5的下游基因(图8G-8M)。

图8:ALKBH5正向调控FABP5发挥抗癌作用
结论
本研究表明,CRC中FABP5下调,FASN被泛素-蛋白酶体抑制所诱导激活,导致CRC通过mTOR信号调节自噬。在FABP5缺失条件下,脂质积累增加,最终加速CRC进展。作者的研究支持ALKBH5/FABP5/FASN/mTOR轴在CRC进展调节中的关键作用,并为该疾病的治疗提供有希望的治疗靶点。
实验方法
细胞培养,real time Qpcr,稳定转染,CCK,EdU,细胞迁移与增殖,WB,co-IP,RNA-seq
参考文献:
Ye M, Hu C, Chen T, Yu P, Chen J, Lu F, Xu L, Zhong Y, Yan L, Kan J, Bai J, Li X, Tian Y, Tang Q. FABP5 suppresses colorectal cancer progression via mTOR-mediated autophagy by decreasing FASN expression. Int J Biol Sci. 2023 Jun 12;19(10):3115-3127. doi: 10.7150/ijbs.85285. PMID: 37416772; PMCID: PMC10321282.






