化疗后存活的癌细胞更易衰老和转移?
转移是鼻咽癌(NPC)治疗失败的主要原因。作者的III期临床试验显示吉西他滨和顺铂诱导化疗可以消除局部区域晚期鼻咽癌患者的微转移并延长生存期。然而,化疗耐药患者屈服于转移,确切的潜在机制尚不清楚。新的研究表明,化疗引起的DNA损伤不仅会导致细胞毒性死亡,还会引发原代细胞和肿瘤细胞的细胞衰老。衰老是一种多方面的状态,细胞在这种状态下细胞周期停滞,并对肿瘤的发展起抑制或促进作用。最近的发现表明,化疗诱导的衰老可通过肿瘤细胞获得的衰老相关分泌表型(SASP)的有害作用促进癌细胞转移。因此,抑制SASP的有害作用可能有助于预防化疗后衰老肿瘤的转移。
促炎细胞因子、趋化因子和生长因子的分泌是SASP的主要特征。核因子κB(NF-κB)是参与SASP生成的关键分子模块。累积的基因组研究报道,在鼻咽癌中,身体变化和EB病毒(EBV)协同维持炎性NF-κB激活。然而,个体NPC患者的躯体变异率相对较低,维持组成型NF-κB激活的内源性分子尚不清楚。环状RNA(circRNAs)的特征在于它们的结构共价闭环结构,并且在真核生物中广泛存在。它们已被证明在转录后调节免疫反应和肿瘤发生相关基因的表达。最近的研究表明,circRNAs在NF-κB信号调控中起着重要作用。然而,有关circRNAs参与鼻咽癌中SASP相关的NF-κB活化的研究尚不清楚。
在这项研究中,利用全球表达谱,作者确定了远处转移的鼻咽癌患者中与衰老相关的表型,并将CircWDR37作为关键的参与调节因子。CircWDR37基因缺失使鼻咽癌细胞对化疗诱导的衰老敏感,但抑制了肿瘤转移。在机制上,CircWDR37与双链核糖核酸激活的蛋白激酶R相互作用,促进其同源二聚化和磷酸化,并激活NF-κB信号,诱导SASP组分基因转录。临床上,CircWDR37低表达的鼻咽癌患者可从诱导化疗中获益。综上所述,作者的数据揭示了化疗诱导衰老和转移的新机制,并为鼻咽癌提供了有前景的治疗靶点。本文于2023年3月发表在《Advanced Science》IF: 15.1期刊上。
主要技术路线
![]()
![]()
![]()
![]()
![]()
![]()

![]()
![]()
![]()

![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
1、鼻咽癌远处转移患者的衰老相关表型特征
为了探索衰老对肿瘤转移的贡献,作者重新分析了作者先前发表的微阵列转录组数据,这些数据来自局部区域晚期鼻咽癌组织(n=24)和没有远处转移(n=24)的根治性化疗后的鼻咽癌组织。基因集浓缩分析(GSEA)显示,在有远处转移的鼻咽癌患者中,衰老和SASP相关信号显著丰富(图1a)。在有远处转移和无远处转移的137个鼻咽癌组织中差异表达的mRNAs中(图1a),有22个与衰老和SASP相关,其中90.9%在有远处转移的鼻咽癌患者中显著上调(图1b)。上调的SASP信号包括那些编码生长因子和趋化因子的信号,如C-X-C基序趋化因子配体10(cxcl 10;倍数变化= 1.92847,p = 0.02894)和C-X-C基序趋化因子配体16(cxcl 16;倍数变化= 1.80415,p = 0.00187)。基于22个信号表达的主成分分析(PCA)揭示了有和没有远处转移的NPC患者之间的区别。
为了验证NPC转移的表达模式,作者采用了一对具有高(S18)和低(S26)转移能力的NPC细胞模型进行微阵列表达谱分析。正如预期的那样,S18 NPC细胞显示出类似的衰老相关和SASP相关信号丰度的表达改变(图1b)。综上所述,这些结果表明患有远处转移的NPC患者表现出衰老特征,并且参与衰老的基因可能有助于NPC转移。
2、CircWDR37是NPC衰老和转移的关键调节因子
新的证据表明,circRNAs通过直接或间接调节基因表达,在肿瘤进展和治疗耐药中发挥关键作用。为了研究circRNA是否参与鼻咽癌的衰老相关转移,作者分析了S18和S26细胞系中circRNA的表达谱。在高转移潜能的S18细胞表达上调的56个CircRNA中,有48个在CircBase数据库中被注释,40个在肿瘤特异性CircRNA数据库(CSCD)中通过4种不同的算法进一步验证。值得注意的是,hSA_CIRC_0000206,被称为CircWDR37,在CircRNA候选序列中显示了最高的CircRNA/宿主线性mRNA表达比率,这表明CircWDR37相对于其线性WDR37mRNA的表达水平较高(图1c)。
CircWDR37是WDR37基因第6-9外显子的头部到尾部剪接;Sanger测序证实了连接位置(图1D)。通过实时荧光定量PCR(RT-qPCR)验证circWDR37在鼻咽癌细胞(S18、S26、HONE1和HK1)中的表达。结果证实,与低转移能力的S26细胞相比,circWDR37在高转移能力的S18细胞中表达显著上调(p < 0.05,图1e)。使用反向转录的随机引物,circWDR37可以在cDNA中用不同的引物扩增,但不能在相应的基因组DNA中扩增(图1f)。经Dactinomycin处理后,CircWDR37表达的半衰期明显长于线性WDR37表达的半衰期(p<0.05,图1g;图S1d,支持信息)。对RNase R消化的抗性进一步证实了CircWDR37的闭环结构(图1h)。细胞核和细胞质分离以及荧光原位杂交(FISH)分析表明,circWDR37主要定位于细胞质中(图1i,j)。这些数据表明circWDR37在具有高转移潜力的鼻咽癌细胞中是一个真正上调的circRNA。
为了研究CircWDR37的功能,作者首先设计了针对CircWDR37的反向剪接位点的短干扰RNA(SiRNA),在不改变线性WDR37 mRNA表达的情况下特异性地下调CircWDR37的表达(p<0.05)。然后进行RNA测序(RNA-seq)分析,检测circWDR37敲低和不敲低的S18细胞的表达谱。结果发现,circWDR37敲低后,S18细胞中有267个基因上调,256个基因下调。GSEA分析显示,circWDR37表达后,与转移、SASP和鼻咽癌相关的基因特征显著富集(FDR < 0.05,图1k)。此外,KEGG分析表明,细胞衰老途径中差异表达基因显著富集(图1l)。综上所述,这些发现表明circWDR37是与鼻咽癌衰老和转移相关的关键circRNA。
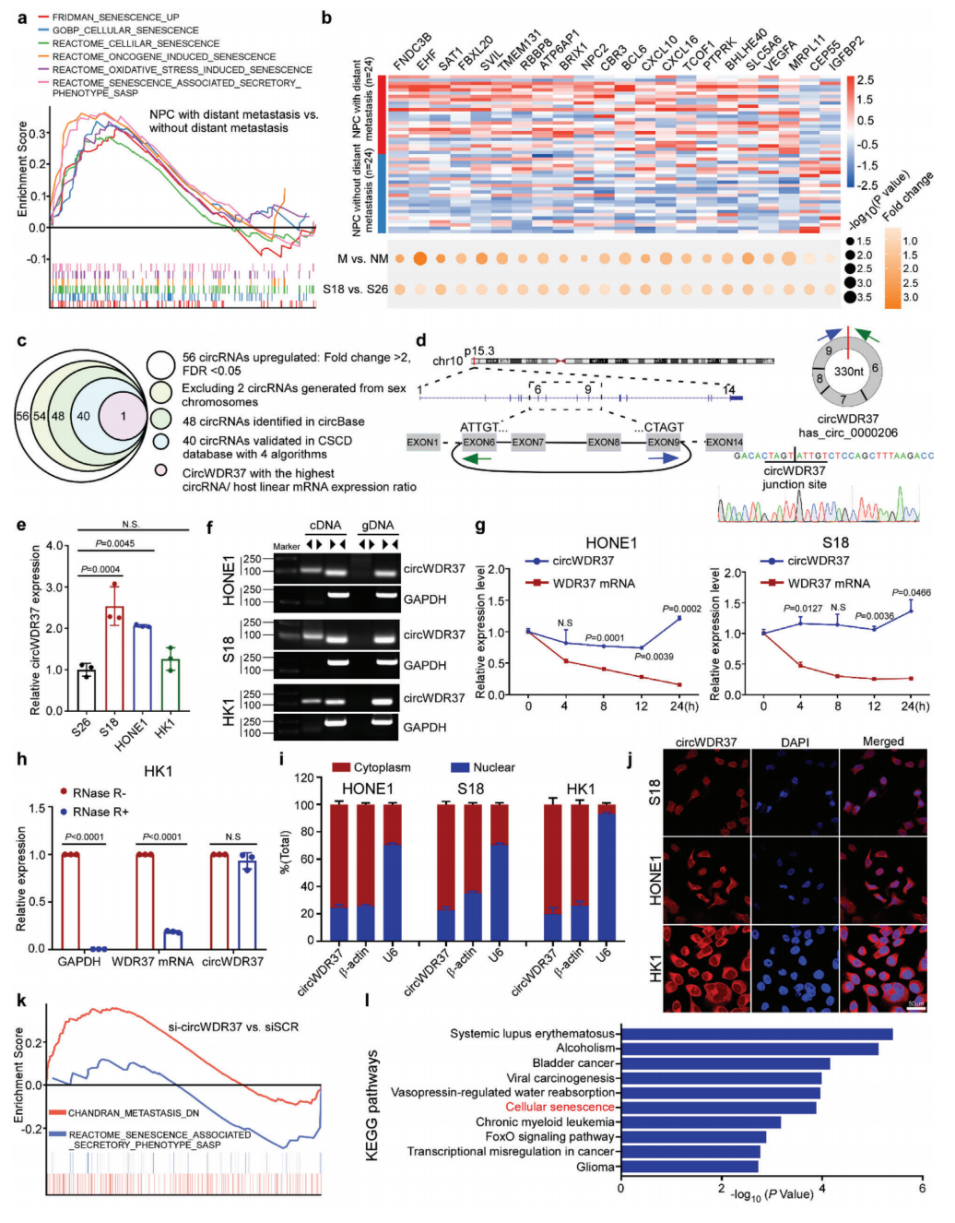
图1 CircWDR37是NPC衰老和转移的关键调节因子
3、circWDR37缺陷抑制化疗诱导的鼻咽癌衰老细胞的体外转移
为了验证circWDR37在NPC中的功能,作者进行了体外Transwell和衰老实验。与GSEA结果一致,与相应的对照相比,circWDR37敲低显著抑制了NPC细胞系的迁移和侵袭能力(p < 0.05,图2a),而circWDR37过表达显著促进了这些表型(p < 0.05)。接下来,作者试图确定circWDR37是否影响衰老细胞的迁移和侵袭性。由于顺铂和吉西他滨是NPC的标准化疗方案并且能够诱导衰老,作者用顺铂或吉西他滨处理鼻咽癌细胞以诱导衰老,并进行β半乳糖苷酶(SA-β-gal)染色,这是一种标准的细胞衰老标记。结果显示circWDR37缺失显著降低了用顺铂或吉西他滨治疗的NPC细胞中的细胞生长(p < 0.05,图2b)并增加了SA-β-gal的表达(图2c)。此外,在用顺铂和吉西他滨治疗的NPC细胞中,circWDR37敲除显著增强了p16INK4a(细胞周期蛋白依赖性激酶2a,CDKN2A)的表达,p16INK4A是细胞衰老的最具代表性的标志(图2d)。总之,这些数据表明circWDR37下调增强了NPC顺铂或吉西他滨诱导的细胞衰老。
尽管最近的研究表明化疗诱导的衰老通过SASP促进肿瘤转移,但作者惊讶地发现,在顺铂或吉西他滨诱导衰老后,circWDR37敲低显著抑制了NPC细胞的迁移和侵袭能力(p < 0.05,图2e)。总之,这些数据表明circWDR37缺陷促进了化疗诱导的衰老,但削弱了衰老NPC细胞的体外转移能力。
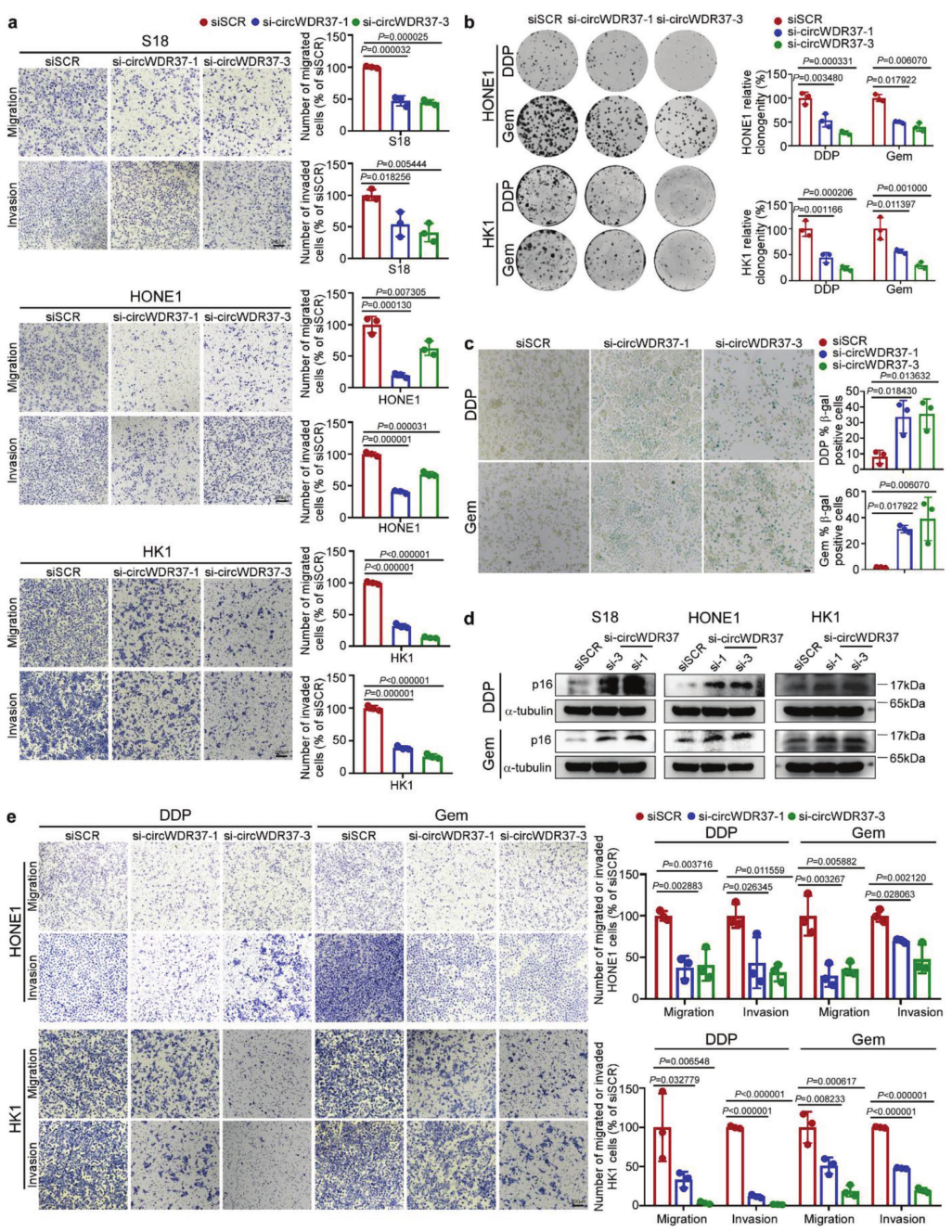
图2 CircWDR37缺陷抑制化疗诱导的衰老NPC细胞的体外转移
4、CircWDR37刺激NF-κB激活以促进化疗诱导的促炎SASP基因转录
接下来作者阐明了circWDR37调节NPC衰老和转移的潜在机制。RNA-seq转录组图谱的GSEA显示,与NF-κB信号通路相关的基因集与circWDR37表达显著正相关(FDR < 0.05,图3a)。发现circWDR37敲低后,一组18个NF-κB靶基因在NPC细胞中下调。RT-qPCR 分析验证,与siSCR对照相比,circWDR37敲低显着降低了HONE1、S18和HK1细胞中10个NF-κB靶基因的表达(p < 0.05,图3b)。双荧光素酶测定证实,circWDR37缺失显着抑制NPC细胞中NF-κB的转录活性(p < 0.05,图3c)。
上述下调的基因包括多种细胞因子和趋化因子编码基因,例如白细胞介素1α(IL1A)、白细胞介素1β(IL1β)、白细胞介素8(IL8,也称为CXCL8)和C-C基序趋化因子配体20(CCL20),都是关键的促炎SASP因子。考虑到SASP是衰老最重要的特征,对于衰老促进转移至关重要,作者进一步评估了circWDR37是否影响化疗诱导后的SASP。结果表明,circWDR37缺陷确实显着抑制了顺铂或吉西他滨诱导的SASP获得,如IL1A、IL1B、IL8和CCL20丰度降低所示(图3d)。作者还注意到,在敲除circWDR37的NPC细胞中,化疗后NF-κB靶基因Cyclin D1(CCND1)的表达在mRNA和蛋白质水平上均显著降低(图3d,e)。CCND1是一种p16抑制剂,可激活细胞周期蛋白依赖性激酶4/6(CDK4/6),通过G1/S期检查点诱导细胞周期进展以克服细胞周期停滞,这可能解释了circWDR37缺陷通过下调Cyclin D1表达使NPC细胞对顺铂或吉西他滨诱导的衰老敏感的机制。这些结果表明circWDR37缺失抑制化疗诱导的促炎性SASP。
I-kappaB激酶α/β(IKKα/β)、NF-κB抑制因子α(IκBβ)和RELA(又称p65)的磷酸化是经典的NF-κB信号激活的关键步骤。作者发现,CircWDR37基因敲除显著抑制了IKKα/β、IκBβ和p65的磷酸化,而不影响它们的总蛋白表达(图3f),而CircWDR37过表达显著增强了它们的磷酸化。核因子NF-κB p50/p65异源二聚体的磷酸化和移位有助于靶基因的转录。作者发现,CircWDR37基因敲除后,磷酸化p65的核位置显著减少(图3G),而CircWDR37过表达则起到相反的作用。免疫荧光试验也证实了circWDR37敲除后p65的核转位减少(p < 0.05,图3h)。总的来说,这些结果表明circWDR37激活NF-κB信号以促进鼻咽癌细胞中化疗诱导的促炎性SASP成分基因转录。
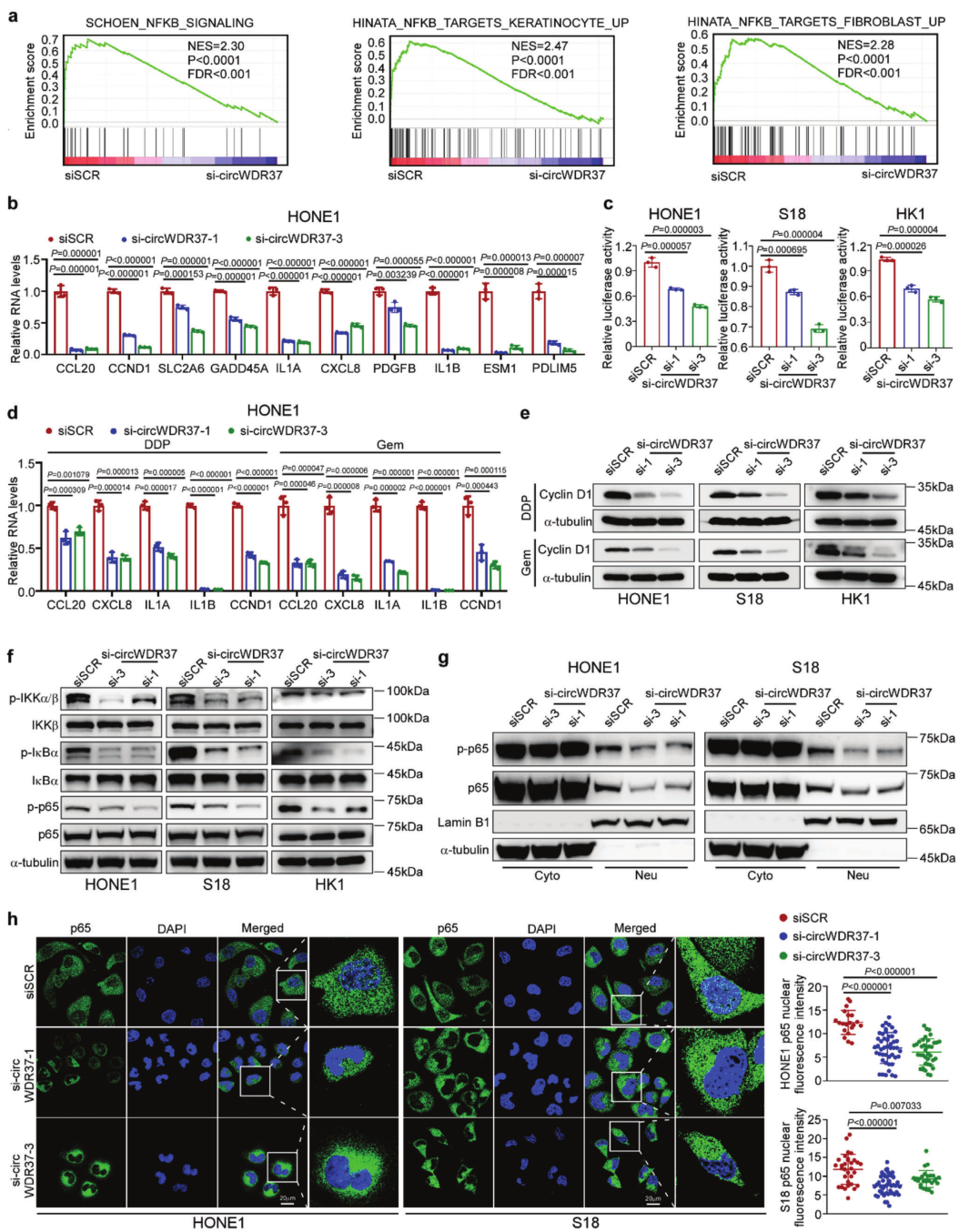
图3 CircWDR37刺激NF-κB介导的化疗诱导的促炎性SASP基因转录
5、CircWDR37诱导PKR同二聚化和磷酸化
为了研究circWDR37激活NF-κB途径的机制,作者使用生物素标记的体外转录的circWDR37进行了RNA pull-down分析,然后进行了质谱分析。在pull-down的蛋白质中,circWDR37被发现与双链RNA激活的蛋白激酶R(PKR)相互作用,PKR是一种与NF-κB激活相关的双链RNA传感器(图4a)。RNApull-down试验后的Western印迹分析进一步证实,与反义RNA相比,生物素标记的circWDR37与鼻咽癌细胞中的PKR特异性结合(图4b)。用抗PKR抗体进行的RNA免疫沉淀(RIP)分析显示circWDR37显著富集(p < 0.05,图4c)。一致地,免疫荧光测定证明circWDR37在细胞质中与PKR共定位(图4d)。接下来,为了确定PKR与circWDR37结合的关键结构域,作者产生了一系列PKR缺失突变体并进行RIP分析。随后的RT-qPCR分析显示,PKR N末端的dsRNA结合结构域(dsRBMs)与全长PKR结合circWDR37的效率一样高(p < 0.05,图4e),这表明dsRBMs结构域对于PKR结合circWDR37是至关重要的。
已经确定PKR可以在感染和肿瘤促进炎症过程中启动NF-κB激活,作者进一步评估了PKR是否诱导NPC中NFκB级联的激活。结果表明PKR敲除显著抑制了IKKα/β、IκBα和p65的磷酸化(图4f)。此外,p65的核转位在PKR缺陷下减弱(图4g,h),这与circWDR37敲除的影响一致。鉴于NF-κB级联的激活是由磷酸化的PKR诱导的,作者进一步评估circWDR37对NF-κB激活的影响是否依赖于PKR的磷酸化。值得注意的是,PKR在Thr446和Thr451这两个对PKR激活至关重要的磷酸化位点的磷酸化被circWDR37沉默所抑制(图4i)。相反,强制circWDR37表达能够诱导PKR磷酸化,这表明circWDR37通过结合PKR并诱导其磷酸化来激活NF-κB途径。
作者接下来探索circWDR37如何启动PKR磷酸化和激活。据报道,TAR RNA结合蛋白(TRBP)和PKR蛋白激活因子(PACT)是两种双链RNA结合蛋白,对PKR发挥相反的调节作用。因此,作者想知道circWDR37是否影响了PKR和PACT/TRBP之间的互动。然而,在circWDR37缺失后,PKR与PACT或TRBP的结合没有明显变化(图4j)。最近的证据表明,长链非编码RNA在双链RBM上与PKR结合,诱导PKR单体形成同质体并随后磷酸化。然后,作者进一步研究了circWDR37是否修饰PKR同型二聚化的形成。结果显示,circWDR37沉默减少了HA与flag标记的PKR之间的相互作用(图4k),这表明circWDR37诱导了PKR的同二聚化。综上所述,这些结果表明circWDR37在dsRBMs结构域与PKR结合,诱导PKR二聚体化和磷酸化,从而激活NF-κB信号传导(图4l)。

图4 CircWDR37诱导PKR二聚体化和磷酸化
6、CircWDR37在非依赖于PKR激酶活性下促进PKR刺激的IKKβ磷酸化
为了阐明circWDR37对PKR启动的NF-κB激活的调节作用,作者首先进行了共免疫沉淀(co-IP)分析来评估circWDR37是否与NF-κB蛋白结合。然而,circWDR37和IKKβ、p65或IκBα之间没有观察到直接的相互作用。然后,作者评估circWDR37是否影响PKR与NF-κB成分的结合。首先,co-IP分析证明异位表达的PKR与IKKβ相互作用(图5a),谷胱甘肽-s-转移酶(GST)pull-down分析证实了它们的直接相互作用(图5b)。为了探索PKR - IKK/β相互作用的关键区域,作者生成了IKKβ截断突变体,包括IKKβ-1(仅具有n端激酶结构域(KD))、IKKβ-2,4(具有泛素化类域(ULD)和NEM结合结构域(NBD))、IKKβ-2,3(ULD与二聚化所需的非旋支架/二聚化结构域(SDD)结合)和IKKβ-3,4(SDD与NBD结合)(图5c)。进一步的co-IP分析揭示了IKKβ-2,4和IKKβ-3,4突变体,但是没有NBD结构域的突变体与PKR的结合效率不如全长的IKKβ(图5d),并且PKR的KD结构域与IKKβ特异性相互作用(图5e)。这些结果表明,IKKβ和PKR之间的相互作用特别依赖于IKKβ的NBD结构域和PKR的KD结构域。
接下来,作者评估了circWDR37是否促进了PKR和IKKβ之间的相互作用。co-IP分析显示,在circWDR37过表达后,PKR与IKKβ的结合增强(图5f)。尽管先前的研究报道PKR通过磷酸化IKKβ启动NF-κB激活,但是调节机制是否依赖于PKR激酶活性仍不清楚。使用体外激酶试验,作者发现纯化的GST标记的PKR以剂量依赖的方式直接磷酸化GST-真核起始因子2(eIF2α),一种公认的PKR底物,但不磷酸化GST-IKKβ。综上所述,上述发现表明circWDR37促进PKR与IKK-β的结合,从而以独立于PKR激酶活性的方式诱导IKK-β磷酸化。
7、CircWDR37-磷酸化PKR与抑制性IκB结合并释放p65
P65与p50的复合体是含量最丰富的NF-κB蛋白。之前的一项研究报告称PKR并不直接相互作用或磷酸化p65。令人惊讶的是,作者发现鼻咽癌细胞中PKR缺失后p65磷酸化减弱(图4f)。此外,co-IP实验显示PKR与p65结合(图5g),GST pull-down实验进一步证实了这一点(图5h)。为了研究与PKR-p65结合有关的结构域,作者根据p65的功能结构域构建了p65截断突变体:Rel同源结构域(RHD)和转录激活结构域(TAD)(图5i)。co-IP分析表明,p65中的RHD结构域与PKR的结合效率与p65的全长一样,而TAD结构域则没有p65的结合能力(图5j)。此外,KD结构域,而不是PKR中的dsRBM与p65特异性相互作用(图5k)。
考虑到RHD结构域是p65与抑制蛋白IκBα结合所必需的,作者探讨了PKR对p65与IκBα相互作用的影响。强制表达PKR显著减少了IκBα与p65的结合(图51),表明PKR占据了p65上的IκBα结合位点。此外,作者还发现PKR与IκBα在物理上相互作用,这一作用因异位CircWDR37表达而增强。这些发现与先前的一项研究相一致,该研究表明PKR与IκBα相互作用并被磷酸化。接下来,作者研究了WDR37是否影响PKR和IκBα结合p65的竞争。外源CircWDR37的增加促进了PKR/IκBα复合体的形成(图5m),并以剂量依赖的方式减少P65/IκBα复合体的形成(图5n),这提示CircWDR37促进PKR与IκBα的结合,并从抑制性的IκBα蛋白中释放p65。
由于CircWDR37启动了PKR的磷酸化并触发了NF-κB信号,作者进一步评估了CircWDR37诱导的PKR磷酸化在PKR/IκBα相互作用中的作用。作者用天冬氨酸(T446DT451D)取代Thr446和Thr451残基,构建了突变的PKR。体外纯化的PKRT446DT451D蛋白与迫使其去磷酸化的小牛肠道碱性磷脂预先孵育,然后进行GST pull-down实验。结果表明,PKR去磷酸化减少了PKR与IκBα的相互作用,提示PKR与IκBα的结合能力依赖于PKR的磷酸化(图5o)。总的来说,这些数据表明circWDR37磷酸化的PKR结合并从p65中分离IκBα,从而释放p65转运到细胞核中(图5p)。

图5 CircWDR37促进PKR与IKKβ的结合,并促进PKR与IκB 的相互作用,从而从抑制性IκBκ中释放p65
8、PKR是circWDR37的功能性中介
PKR在鼻咽癌细胞转移和衰老中的作用尚不清楚。接下来,作者研究了PKR在鼻咽癌细胞中的功能。与circWDR37缺失的影响类似,PKR敲低显著抑制鼻鼻癌细胞的迁移、侵袭和集落形成(p < 0.05,图6a)。此外,顺铂或吉西他滨治疗后,PKR缺失显著增加SA-β-gal染色的鼻咽癌细胞(p < 0.05,图6b)。在顺铂或吉西他滨处理的鼻咽癌细胞中,衰老标记物p16INK4a的表达持续增加,而细胞周期蛋白D1的表达因PKR缺失而降低(图6c)。这些结果证实了PKR缺失对鼻咽癌细胞迁移和侵袭的抑制作用,以及对细胞衰老的促进作用。此外,PKR耗竭后化疗诱导的衰老鼻咽癌细胞的迁移和侵袭能力显著受损(p<0.05,图6d)。综上所述,这些数据表明,PKR沉默的作用类似于circWDR37基因敲除,促进了化疗诱导的鼻咽癌细胞的衰老,并限制了它们在体外的迁移和侵袭。
为了证实circWDR37通过激活PKR来对抗化疗诱导的衰老和促进鼻咽癌的转移,作者用circWDR37-siRNA和PKRT446DT451D过表达的质粒转染鼻咽癌细胞。在T446和T451残基持续的PKR磷酸化显著逆转了circWDR37缺失的鼻咽癌细胞减弱的迁移和侵袭(p<0.05,图6e)。此外,异位PKRT446DT451D表达显著抑制了circWDR37敲除诱导的增强的化疗诱导的细胞衰老(p < 0.05,图6f)。双重荧光素酶报告基因分析和蛋白质印迹显示,外源PKRT446DT451D操作显著恢复了circWDR37缺失抑制的NFκB激活(图6g,h)。此外,PKRT446DT451D的过表达取消了circWDR37基因敲除细胞中衰老标记物p16INK4a表达的增加和细胞周期蛋白D1表达的降低(图6h)。这些结果表明,PKR的激活在circWDR37介导的鼻咽癌细胞的抗衰老、迁移和侵袭过程中起关键作用。
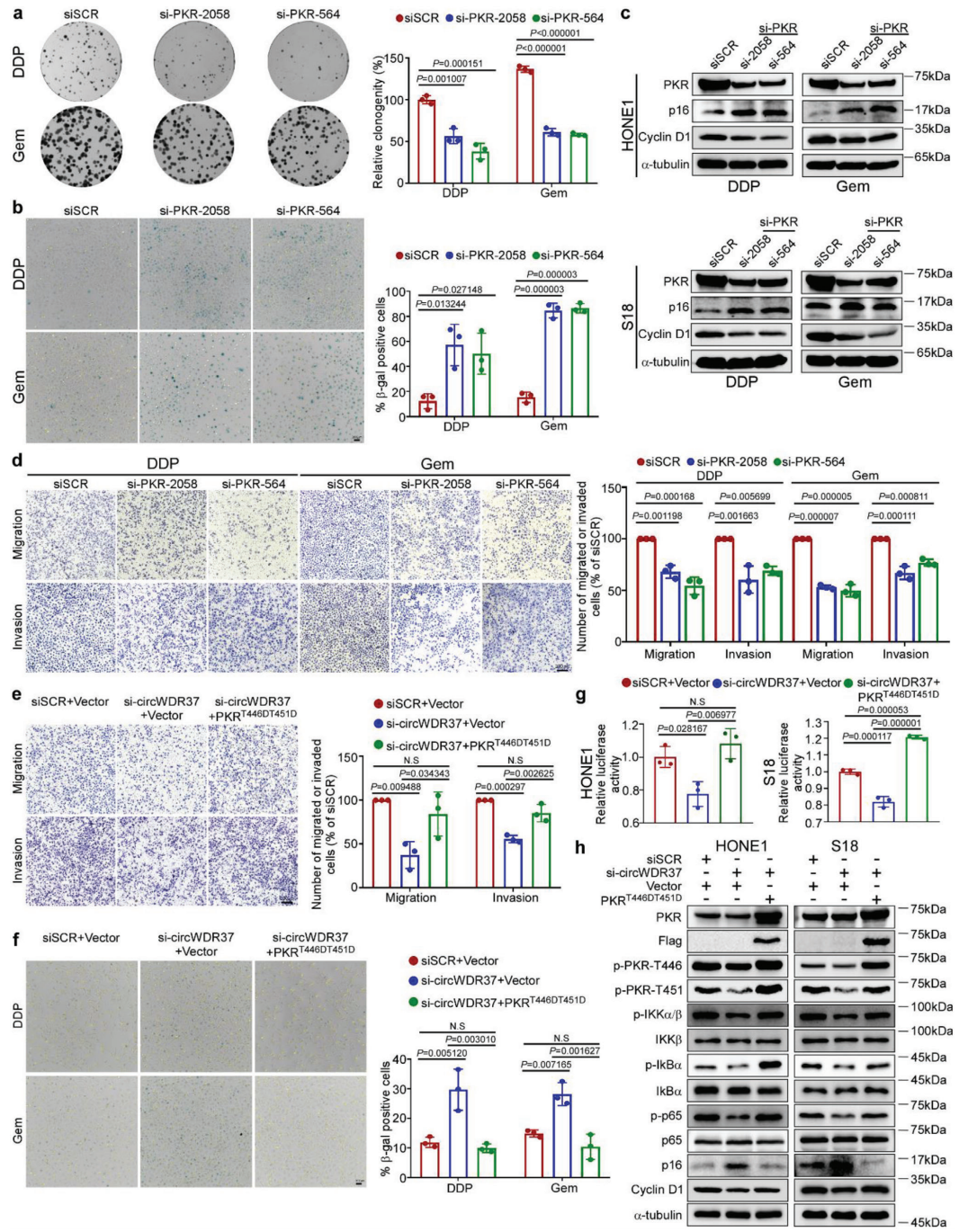
图6 PKR是CircWDR37的功能调节因子
9、CircWDR37缺失损害NPC细胞体内转移
为了在体内验证circWDR37的功能,作者首先建立了一个腹股沟淋巴结转移模型。将稳定的WDR37基因敲除的S18细胞或杂乱对照的S18细胞移植到裸鼠的足垫中。4周后,切除足垫和腹股沟淋巴结上的原发肿瘤(图7a)。H&E染色显示,在WDR37基因敲除组,足底肿瘤侵袭性较弱,对皮肤和肌肉的侵袭相对较少(图7b)。根据泛角蛋白染色的结果,circWDR37缺失显著减少了肿瘤体积(p<0.05,图7c,d)和腹股沟淋巴结转移率(p<0.05,图7e,f)。接下来,将稳定的WDR37缺失的S18细胞或杂乱对照的S18细胞经尾静脉注入裸鼠体内,建立肺转移定植模型。如图7g,h所示,WDR37缺失可显著减少体内肺转移结节数(p<0.05)。此外,H&E染色显示,抑制circWDR37可显著减少和缩小肺转移结节(p<0.05,图7i,j)。总之,这些结果证实circWDR37敲低抑制了体内NPC细胞转移。
作者进一步使用腹股沟淋巴结转移模型研究circWDR37在顺铂和吉西他滨治疗后对NPC细胞转移的影响。在肿瘤形成后,每隔3天给小鼠腹腔注射顺铂(5mg·kg-1)和吉西他滨(50mg·kg-1)。与sh-载体对照组相比,circWDR37基因敲除抑制了顺铂和吉西他滨治疗后足垫肿瘤对皮肤和肌肉的侵袭(图7K)。此外,经顺铂和吉西他滨治疗后,WDR37缺失组的腹股沟淋巴结体积和转移率显著降低(p<0.05,图7l-o)。综上所述,这些数据表明,具有CircWDR37基因敲除的鼻咽癌细胞可以从顺铂和吉西他滨的治疗中受益于转移控制。
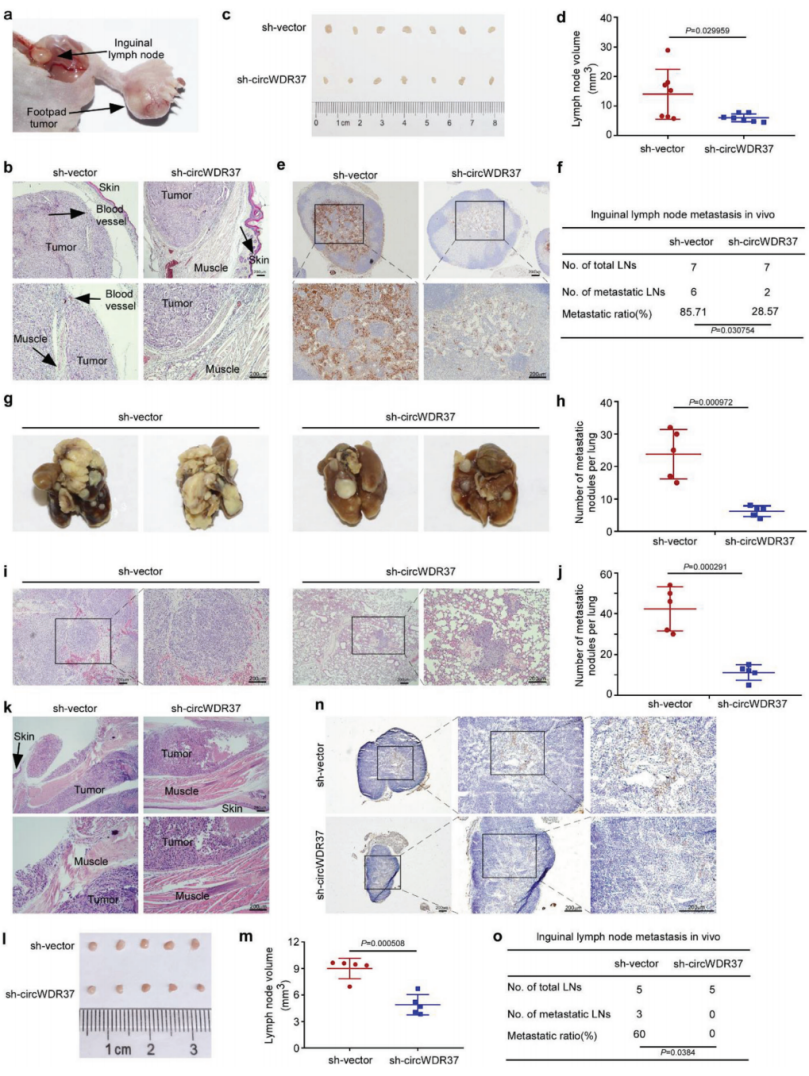
图7 CircWDR37缺陷对鼻咽癌细胞体内转移的影响
10、CircWDR37低表达与鼻咽癌患者良好的预后和较好的诱导化疗疗效相关
根据这些发现,作者的下一个目标是利用RT-qPCR来验证circWDR37在140例鼻咽癌组织中表达的临床潜力。根据X-tile分析将患者分为WDR37高表达组(n=101)和低表达组(n=39)。生存分析显示,circWDR37高表达患者的总生存率、无瘤生存期(DFS)和无远处转移生存期(DMFS)显著低于circWDR37低表达患者(p<0.05,图8a-c)。进一步分析发现,WDR37表达水平、N分期和治疗前血浆EBV DNA是影响鼻咽癌预后的独立因素(p<0.05,图8d-f)。这些结果表明,在鼻咽癌患者中,circWDR37的高表达提示预后不良,并与远处转移有关。
利用上述队列中63名患者在放疗前接受吉西他滨或顺铂诱导化疗的优势,作者评估了circWDR37表达与患者对顺铂或吉西他滨诱导化疗的反应之间的关系。患者在诱导化疗前后进行了磁共振成像(图8G)。在大多数患者应答者中(40/56),circWDR37的表达水平较低(图8h),与circWDR37高表达的患者相比,他们的DFS和DMF更好(p<0.05,图8i,j),这表明circWDR37低表达的患者在顺铂或吉西他滨诱导化疗中获得了更好的疗效和生存。综上所述,这些结果与实验数据一致,该实验数据表明,在鼻咽癌患者中,circWDR37的低表达与顺铂或吉西他滨化疗的反应以及远处转移风险的降低之间存在关联。
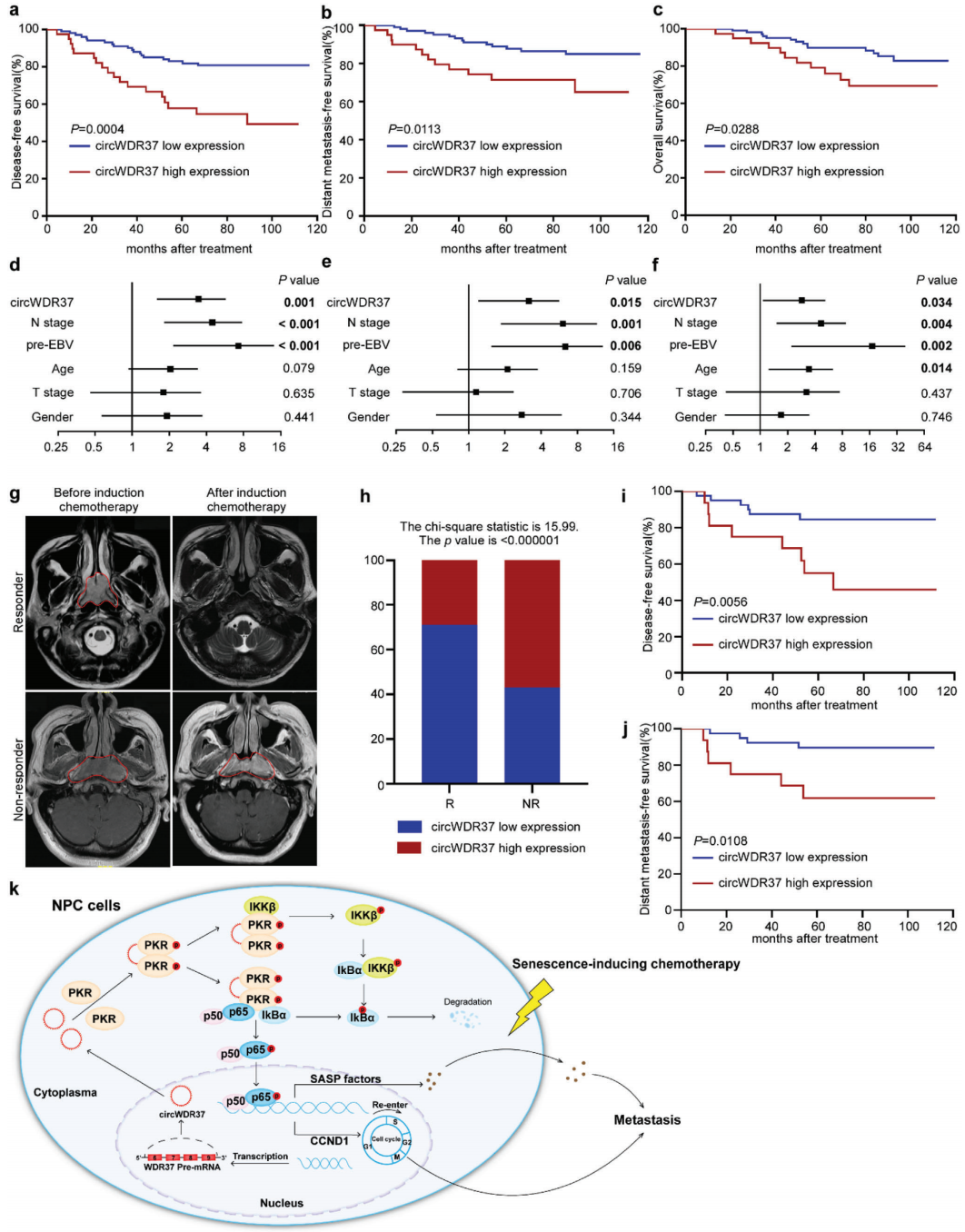
图8 CircWDR37的高表达与鼻咽癌患者的不良预后和对诱导化疗缺乏反应性有关
总之,此研究揭示了circWDR37激活的PKR通过NF-κB触发的SASP成分基因转录促进鼻咽癌中化疗诱导的衰老肿瘤细胞转移。由于circWDR37的缺失使肿瘤细胞对化疗引起的衰老敏感、减少转移、增加化疗的益处,circWDR37可能成为预测化疗疗效的潜在生物标志物和鼻咽癌有吸引力的治疗靶点。
实验方法
基因芯片测序分析、RNA提取和RT-qPCR、RNA FISH -免疫荧光显微镜、RNA免疫沉淀反应、RNA pull down试验
参考文献
Q. Li, Y.H. Zhao, C. Xu,et al. Chemotherapy-Induced Senescence Reprogramming Promotes Nasopharyngeal Carcinoma Metastasis by circRNA-Mediated PKR Activation, Advanced Science, 2023, 10(8). doi: 10.1002/advs.202205668.






